Содержание
- 2. Надлежащая лабораторная практика / Правила лабораторной практики (Стандарт GLP — Good Laboratory Practice GLP): Система требований
- 3. Правила GLP применяются в доклинических (неклинических) исследованиях по безопасности испытуемых веществ, содержащихся в лекарственных средствах и/или
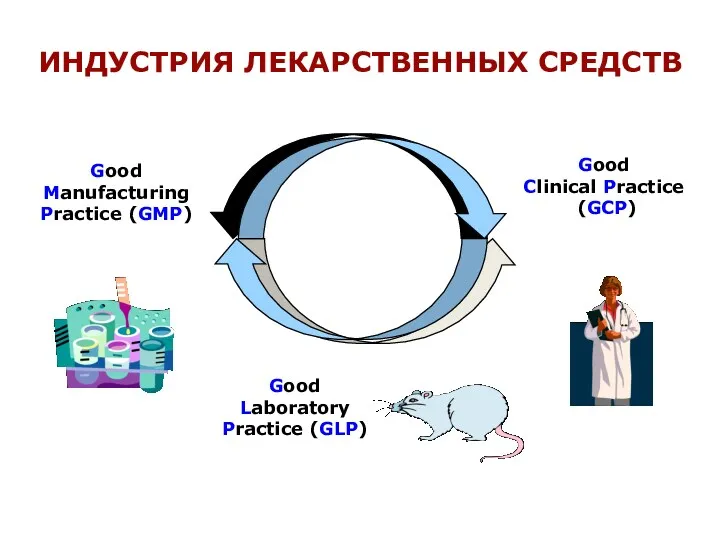
- 4. Good Manufacturing Practice (GMP) Good Clinical Practice (GCP) Good Laboratory Practice (GLP) ИНДУСТРИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
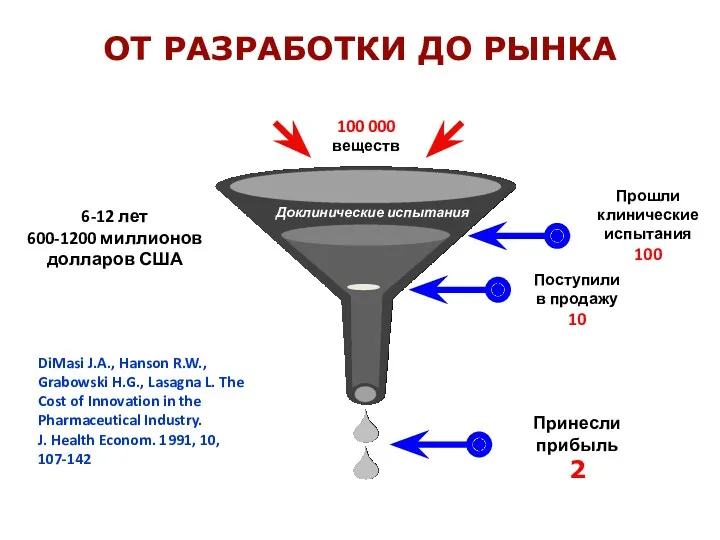
- 5. ОТ РАЗРАБОТКИ ДО РЫНКА 6-12 лет 600-1200 миллионов долларов США Прошли клинические испытания 100 100 000
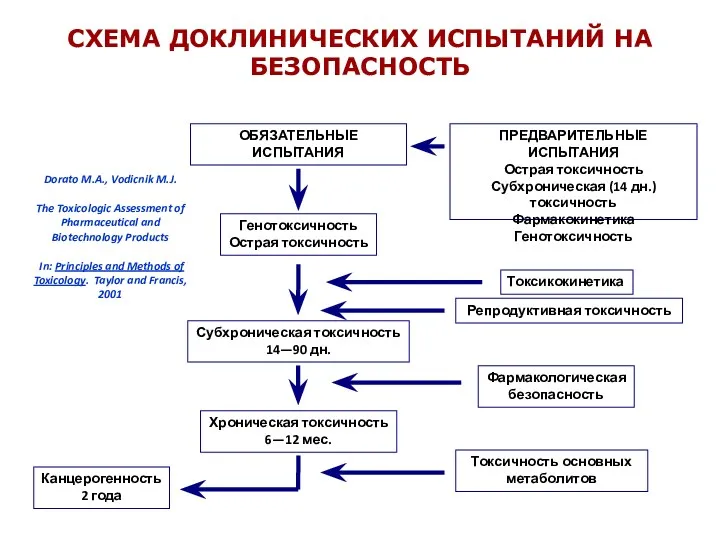
- 6. СХЕМА ДОКЛИНИЧЕСКИХ ИСПЫТАНИЙ НА БЕЗОПАСНОСТЬ
- 7. МЕЖДУНАРОДНЫЙ СТАНДАРТ «OECD Principles on Good Laboratory Practice» (OECD, ENV/MC/CHEM(98)17, 1997 г.) НАЦИОНАЛЬНЫЕ СТАНДАРТЫ «Принципы надлежащей
- 8. Организация и персонал испытательного центра Программа обеспечения качества Помещения Оборудование, материалы и реагенты Тест-системы Испытуемые и
- 9. 58.31 Руководство исследовательской организации (Testing facility management) 58.33 Руководитель исследования (Study director) 58.35 Группа обеспечения качества
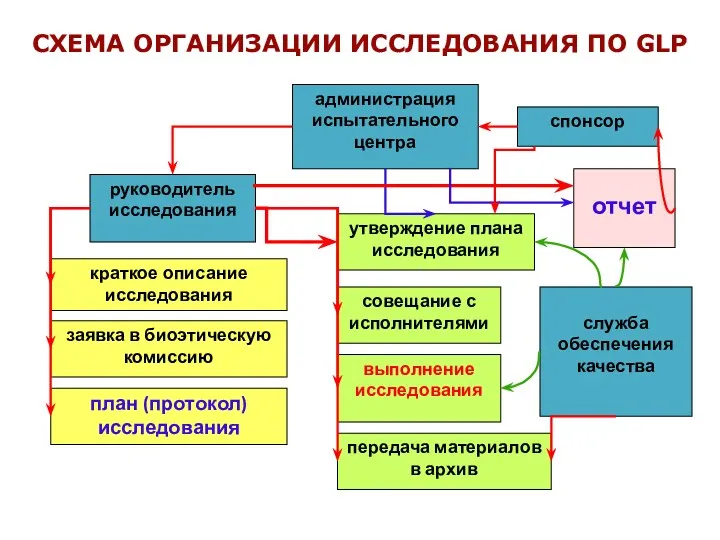
- 10. СХЕМА ОРГАНИЗАЦИИ ИССЛЕДОВАНИЯ ПО GLP руководитель исследования краткое описание исследования заявка в биоэтическую комиссию план (протокол)
- 11. Статья 11 Доклиническое исследование лекарственного средства для медицинского применения 2. Доклиническое исследование лекарственного средства для медицинского
- 12. ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ КАЗАХСТАН НАДЛЕЖАЩАЯ ЛАБОРАТОРНАЯ ПРАКТИКА. ОСНОВНЫЕ ПОЛОЖЕНИЯ СТ РК 1613-2006 Издание официальное Комитет по
- 13. Введение Надлежащая лабораторная практика (Good Laboratories Practice; GLP) устанавливает единый подход и единые требования к проведению
- 14. Нормативные ссылки В настоящем стандарте использованы ссылки на следующие нормативные документы: СТ РК 2.75-2004 Государственная система
- 15. РУКОВОДСТВО ПО ДОКЛИНИЧЕСКИМ ИССЛЕДОВАНИЯМ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ РУКОВОДСТВО ПО ЭКСПЕРИМЕНТАЛЬНОМУ (ДОКЛИНИЧЕСКОМУ) ИЗУЧЕНИЮ НОВЫХ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ Москва,
- 16. Пункт 12. Руководитель организации согласовывает план доклинического исследования, организует работу по его выполнению, назначает ответственного исполнителя
- 17. Лаборатория размещена в корпусе биомедицинских исследований (2450 кв.м) Филиала ИБХ РАН (Институт биоорганической химии Российской академии
- 18. Лаборатория имеет необходимое оборудование и укомплектована персоналом, имеющим соответствующее образование, квалификацию и опыт работы для выполнения
- 20. Скачать презентацию













 Особенности проведения медицинских осмотров обучающихся в целях раннего выявления потребления наркотических средств
Особенности проведения медицинских осмотров обучающихся в целях раннего выявления потребления наркотических средств Медикалық-генетикалық кеңес. Пренатальдық диогностика әдістері
Медикалық-генетикалық кеңес. Пренатальдық диогностика әдістері Полимеразная цепная реакция
Полимеразная цепная реакция Исследование функции внешнего дыхания мое
Исследование функции внешнего дыхания мое Гипертоническая болезнь (Артериальная гипертония)
Гипертоническая болезнь (Артериальная гипертония) Проблемы адаптации и здоровья в образовании
Проблемы адаптации и здоровья в образовании Современные концепции психотерапии в клинической психологии
Современные концепции психотерапии в клинической психологии Lacalut. Стоматологи рекомендуют
Lacalut. Стоматологи рекомендуют Вступ в курс інфектології. Поняття про інфекційні хвороби. Принципи діагностики, лікування, профілактики
Вступ в курс інфектології. Поняття про інфекційні хвороби. Принципи діагностики, лікування, профілактики Новокузнецкая городская клиническая больница №2
Новокузнецкая городская клиническая больница №2 Осложнения после вакцинации
Осложнения после вакцинации Фиксация съёмных ортопедических конструкций. Виды кламмеров
Фиксация съёмных ортопедических конструкций. Виды кламмеров Сердечно-легочная и церебральная реанимация
Сердечно-легочная и церебральная реанимация Аккредитации специалистов
Аккредитации специалистов Экзема дегеніміз - эпидермис пен дерманың қабынуы
Экзема дегеніміз - эпидермис пен дерманың қабынуы Введение в медицинскую рецептуру
Введение в медицинскую рецептуру Особенности организации работы детских поликлиник
Особенности организации работы детских поликлиник Жиектер
Жиектер Облачные технологии управления. Модуль скорая помощь
Облачные технологии управления. Модуль скорая помощь History of the Kanash Central District Hospital
History of the Kanash Central District Hospital Из опыта работы по организации подготовки и защиты ВКР по специальности СД
Из опыта работы по организации подготовки и защиты ВКР по специальности СД Нормальный Менструальный цикл. Эндометриоз
Нормальный Менструальный цикл. Эндометриоз Лечение гриппа
Лечение гриппа Программа подготовки медицинского персонала к проведению предрейсовых, послерейсовых и текущих медицинских осмотров
Программа подготовки медицинского персонала к проведению предрейсовых, послерейсовых и текущих медицинских осмотров Описание клинического случая
Описание клинического случая Адамның психикалық қызметтерінің ерекшеліктері (зейін,түйсік,ой,сана,сөз)
Адамның психикалық қызметтерінің ерекшеліктері (зейін,түйсік,ой,сана,сөз) Барєрні методи контрацепції
Барєрні методи контрацепції Болезнь Гиршпрунга
Болезнь Гиршпрунга