Содержание
- 2. Тканевая инженерия Тканевая инженерия (англ. tissue engineering) — создание новых тканей и органов для терапевтической реконструкции
- 3. Современная тканевая инженерия начала оформляться в самостоятельную дисциплину после работ Д.Р. Уолтера и Ф.Р. Мейера (1984),
- 4. Имитация естественного органогенеза Органогенез - процесс формирования органов в ходе эмбрионального развития Органогенез сопровождается дифференцировкой клеток,
- 5. 1. Отбор и культивирование собственного или донорского клеточного материала Клеточный материал может быть представлен клетками регенерируемой
- 6. 3. Нанесение культуры клеток на матрицу и размножение клеток в биореакторе со специальными условиями культивирования Где
- 7. Классы биоматериалов, применяемых в тканевой инженерии
- 8. Одними из первых в тканевой инженерии стали применяться биодеградируемые синтетические биоматериалы на основе полимеров органических кислот,
- 9. Коллаген практически не имеет антигенных свойств. Использованный в качестве матрицы, он разрушается за счет ферментативного гидролиза
- 10. Дифференцированные клетки Это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора хирургическим путем
- 11. Большинство исследований в области тканевой инженерии направлены на получение того или иного эквивалента тканей. Самое изученное
- 12. Основными точками приложения тканевой инженерии в кардиологии можно считать создание искусственных клапанов сердца, реконструкцию крупных сосудов
- 13. Биоинженерные органы Выращивание органов — перспективная биоинженерная технология, целью которой является создание различных полноценных жизнеспособных биологических
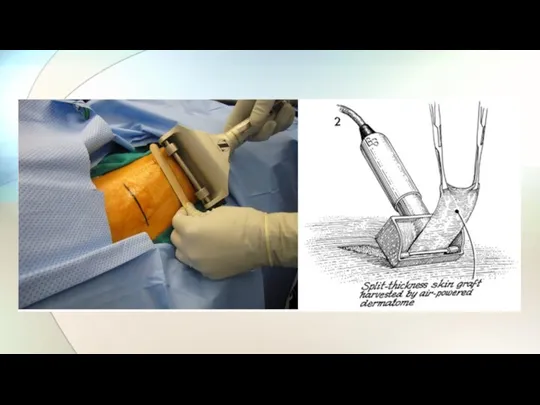
- 14. Восстановление повреждённых участков кожи уже является частью клинической практики. В ряде случаев используются методы регенерации кожи
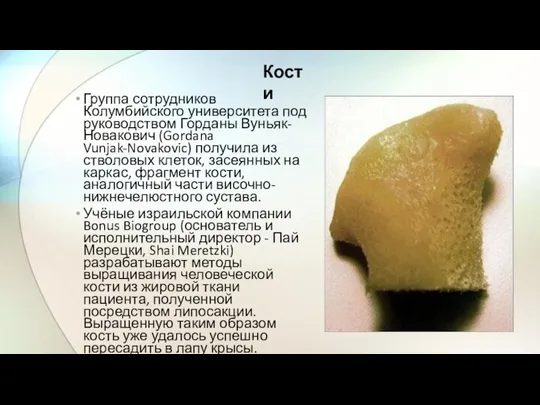
- 16. Группа сотрудников Колумбийского университета под руководством Горданы Вуньяк-Новакович (Gordana Vunjak-Novakovic) получила из стволовых клеток, засеянных на
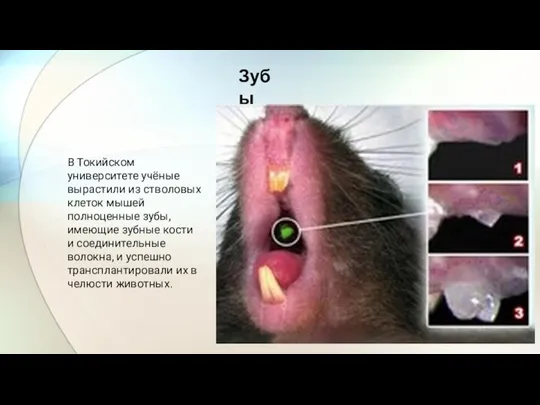
- 17. В Токийском университете учёные вырастили из стволовых клеток мышей полноценные зубы, имеющие зубные кости и соединительные
- 18. Исследователи из Университета Пьера и Марии Кюри в Париже под руководством Люка Дуая (Luc Douay) впервые
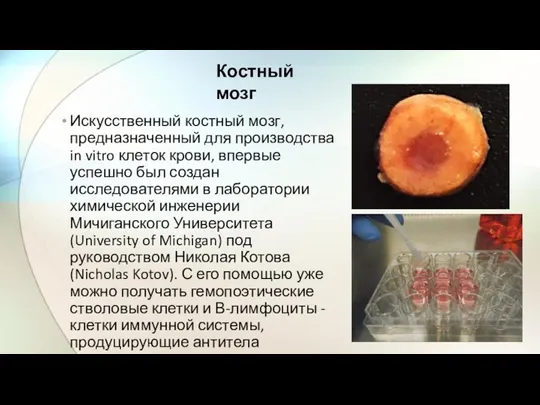
- 19. Искусственный костный мозг, предназначенный для производства in vitro клеток крови, впервые успешно был создан исследователями в
- 20. Доктор Энтони Атала (Anthony Atala) и его коллеги из американского университета Вэйк Форест (Wake Forest University)
- 22. Компания Advanced Cell Technology в 2002 г. сообщила об успешном выращивании полноценной почки из одной клетки,
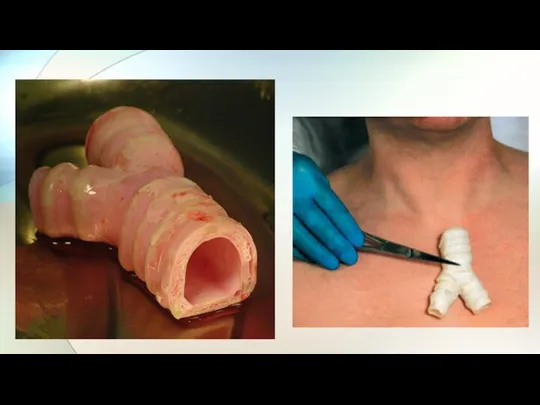
- 24. Испанские хирурги провели первую в мире трансплантацию трахеи, выращенной из стволовых клеток пациентки - 30-летней Клаудии
- 26. Американские ученые из Йельского университета (Yale University) под руководством Лауры Никласон (Laura Niklason) вырастили в лаборатории
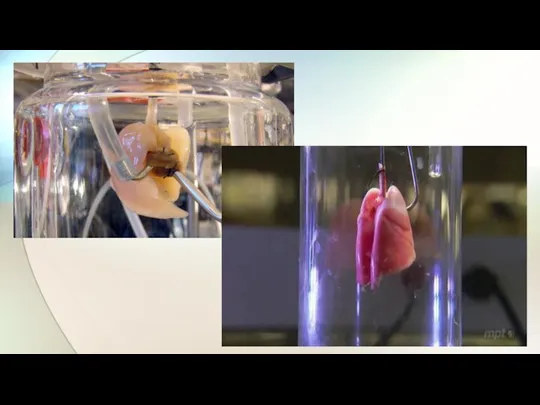
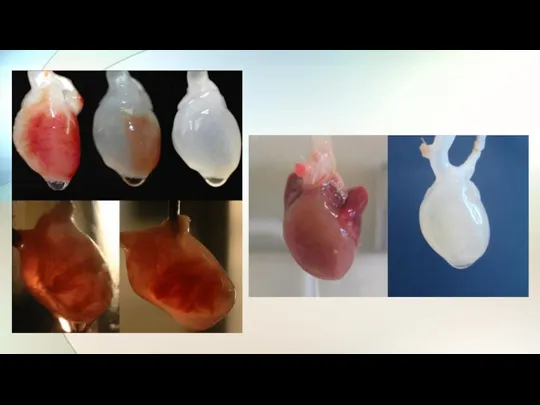
- 28. Ученые из британского госпиталя Хэафилд под руководством Мегди Якуба впервые в истории вырастили часть сердца, использовав
- 30. Американские специалисты из Массачусетской больницы общего профиля (Massachusetts General Hospital) под руководством Коркута Югуна (Korkut Uygun)
- 32. Скачать презентацию





















 Эксперименты нацистов на людьми
Эксперименты нацистов на людьми Острые лимфобластные лейкозы
Острые лимфобластные лейкозы Температура тела человека и терморегуляция. Лекция № 21
Температура тела человека и терморегуляция. Лекция № 21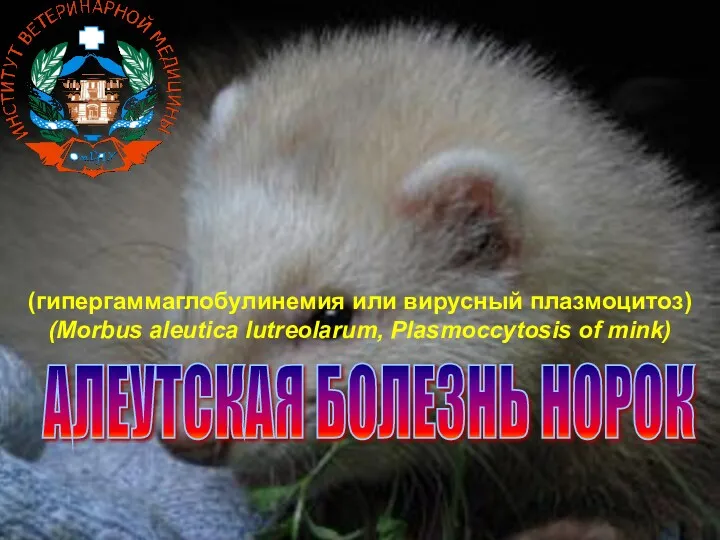 Алеутская болезнь норок
Алеутская болезнь норок Репродуктивное здоровье человека
Репродуктивное здоровье человека Клиническая психология
Клиническая психология Наследие В.И. Разумовского
Наследие В.И. Разумовского Неврологиялық науқастың негізгі реабилитациясы. Емдік гимнастика, физиоем, эрготерапия кабинеттерінде жұмыс жасау
Неврологиялық науқастың негізгі реабилитациясы. Емдік гимнастика, физиоем, эрготерапия кабинеттерінде жұмыс жасау Әлеуметтану ғылым ретінде. Әлеуметтану және медицина
Әлеуметтану ғылым ретінде. Әлеуметтану және медицина Инфекциялық процеске сипаттама. Бактериялардың патогендігі мен токсигендігі. Вирустардың жұқпалылығы
Инфекциялық процеске сипаттама. Бактериялардың патогендігі мен токсигендігі. Вирустардың жұқпалылығы Кишечная форма муковисцидоза у детей
Кишечная форма муковисцидоза у детей Депрессия
Депрессия Ленточные черви у детей
Ленточные черви у детей Организация деятельности акушерского стационара, задачи, роль акушерки
Организация деятельности акушерского стационара, задачи, роль акушерки Вирусные гепатиты
Вирусные гепатиты Особенности оценки функционального состояния органов и систем организма больных при сопутствующих заболеваниях
Особенности оценки функционального состояния органов и систем организма больных при сопутствующих заболеваниях Основы хирургии пороков развития
Основы хирургии пороков развития Гонорея и негонорейные уретриты
Гонорея и негонорейные уретриты Острое повреждение легкого. Острый респираторный дистрессиндром
Острое повреждение легкого. Острый респираторный дистрессиндром Дисциркуляторная энцефалопатия
Дисциркуляторная энцефалопатия Паразитарные заболевания кожи. Дерматозоонозы. Чесотка
Паразитарные заболевания кожи. Дерматозоонозы. Чесотка Сестринский уход при острых кишечных инфекциях у детей
Сестринский уход при острых кишечных инфекциях у детей Robert Koch
Robert Koch Сравнительная характеристика процедур регистрации лекарственных препаратов в России, странах ЕС и США
Сравнительная характеристика процедур регистрации лекарственных препаратов в России, странах ЕС и США Микроспория
Микроспория Отит
Отит Генетикалық инженерия негіздері
Генетикалық инженерия негіздері Современные представления о миоме матки
Современные представления о миоме матки