Содержание
- 2. …Главный вопрос, который требует безотлагательного решения как с медицинских, так и с экономических позиций – это
- 4. 3.1.1 качество ( quality): степень соответствия совокупности присущих характеристик требованиям ISO 9000:2007 Обеспечение пациента и/или врача,
- 5. Эта задача может быть выполнена, если медицинская лаборатория отвечает требованиям качества и компетентности • Требования к
- 6. Основной документ, регламентирующий работу медицинских лабораторий: ISO 15189 : 2012 (Е) Медицинские лаборатории. Требования к компетентности
- 7. Требования ИСО 15189 (Медицинские лаборатории. Требования к компетентности и качеству) 4 Требования к менеджменту 4.1 Организация
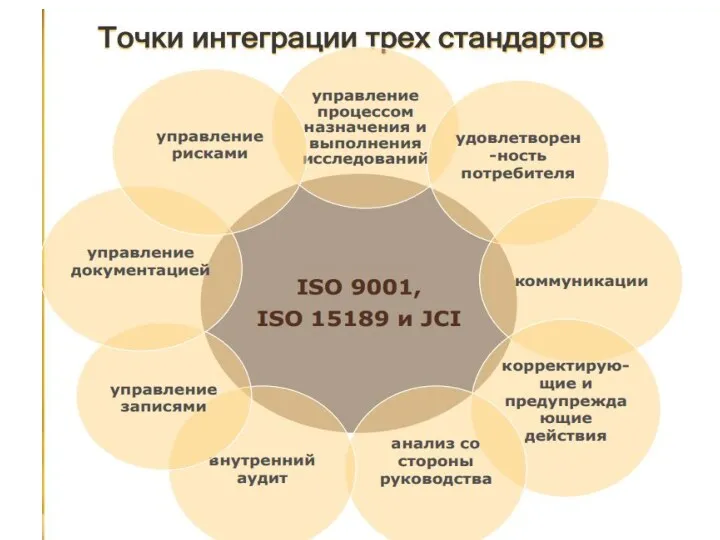
- 8. В целом, качество и компетентность медицинской лаборатории определяются: • - организационной компетентностью, внедрением системы менеджмента качества
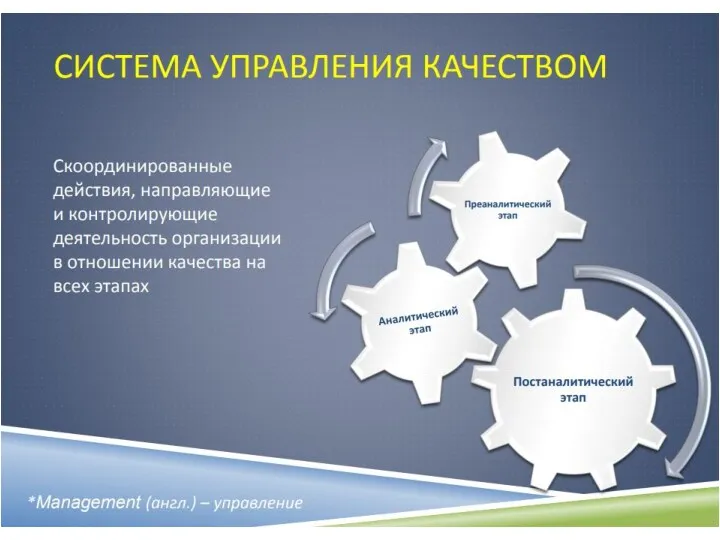
- 11. Система менеджмента качества Все аспекты деятельности лаборатории должны быть рассмотрены с точки зрения организации достижения, поддержания
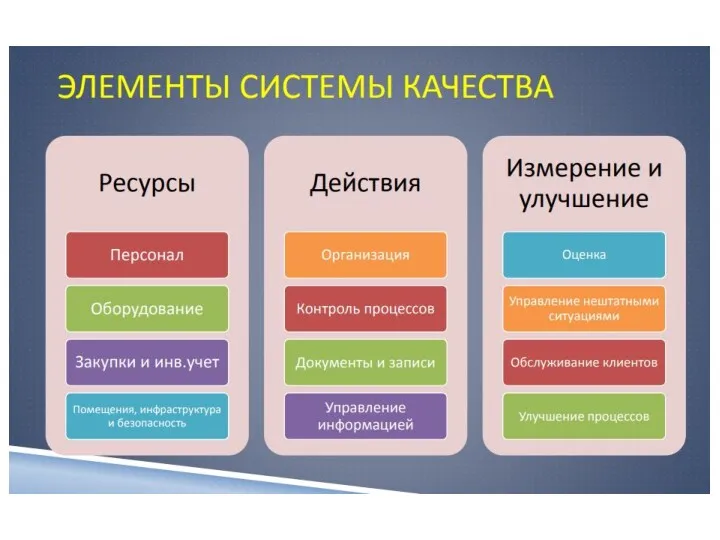
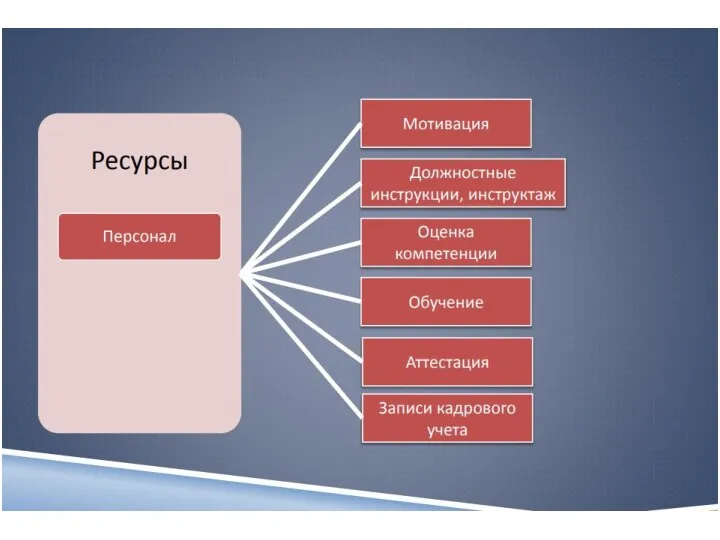
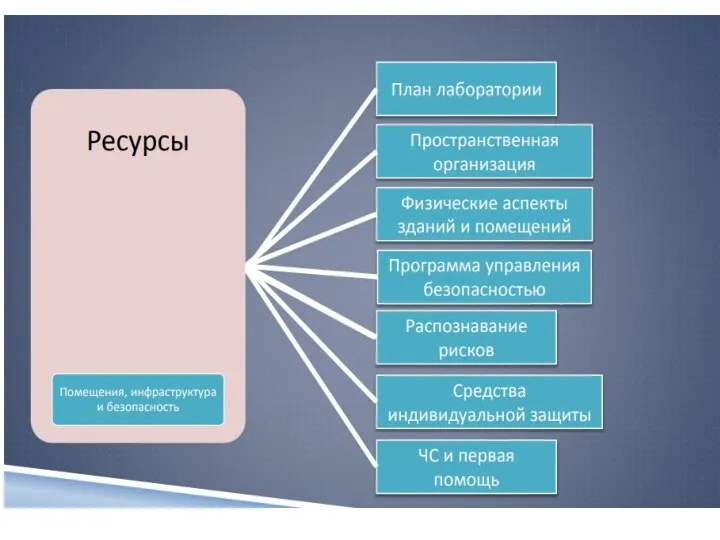
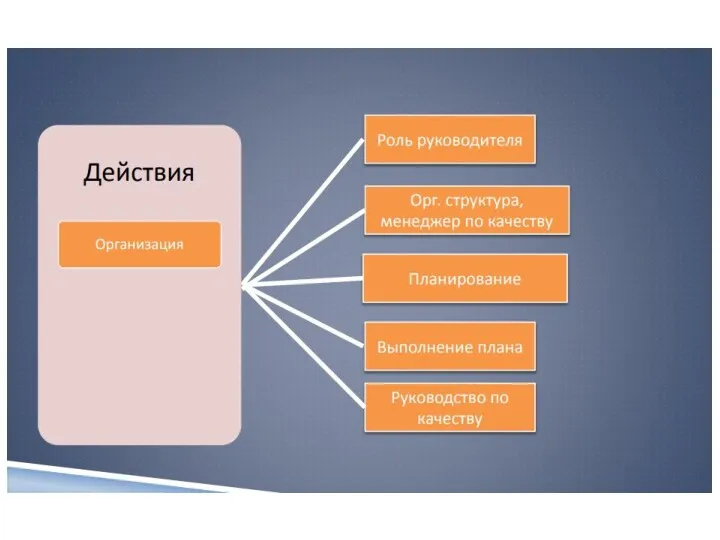
- 12. Система качества лаборатории 1 Оптимизация организации работы 2 Персонал лаборатории 3 Регламентирующая и учетная документация. 4
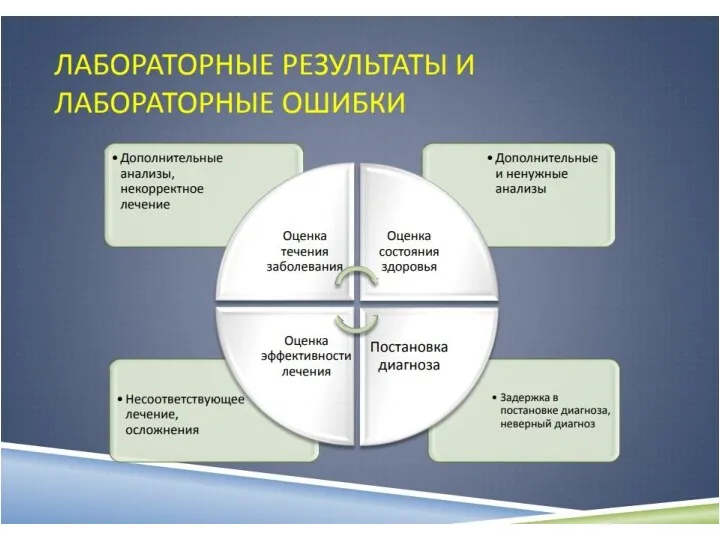
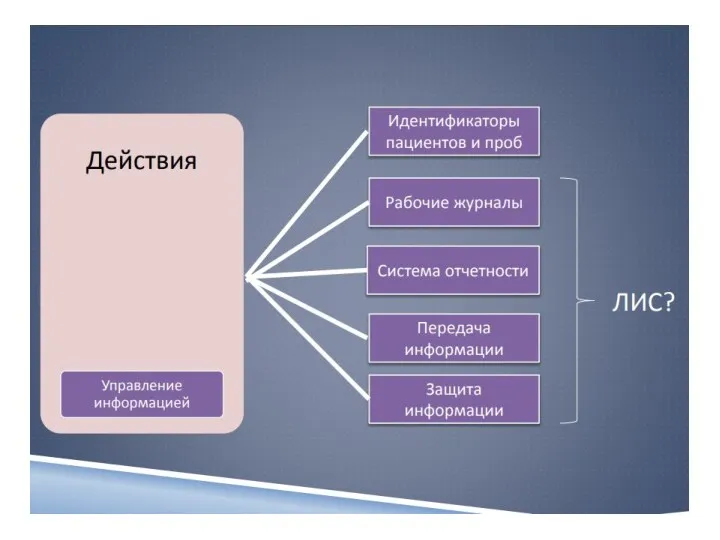
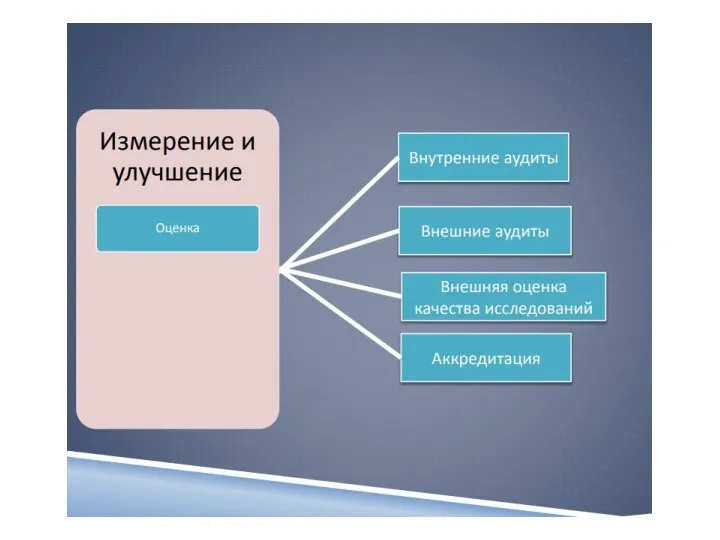
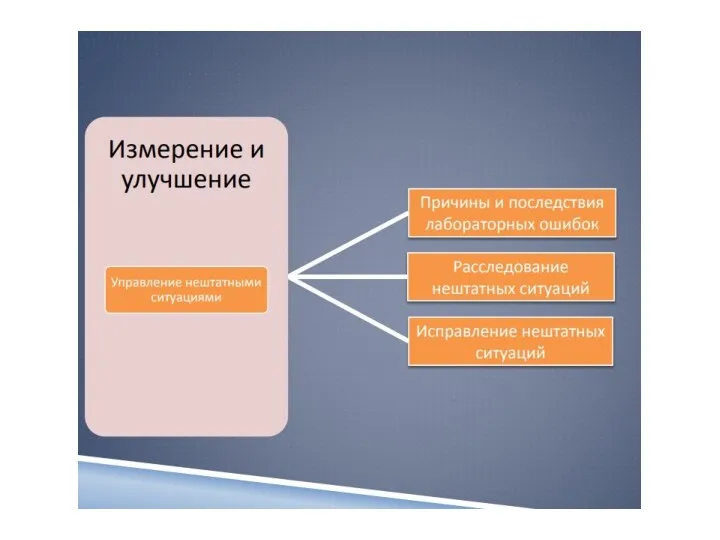
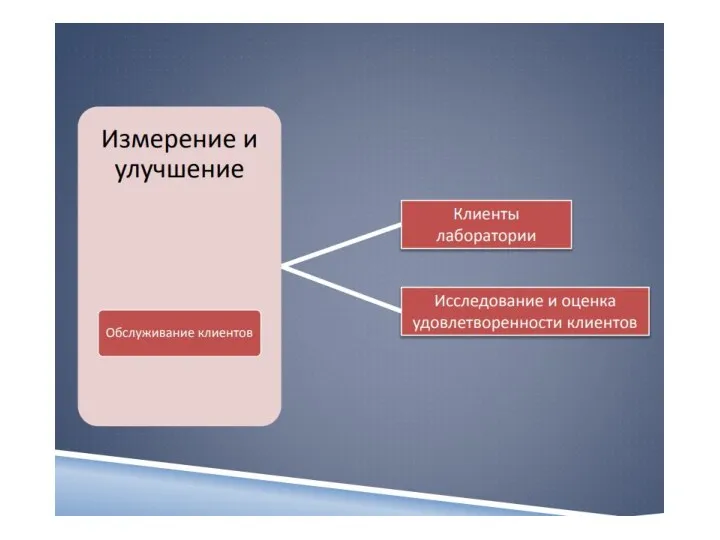
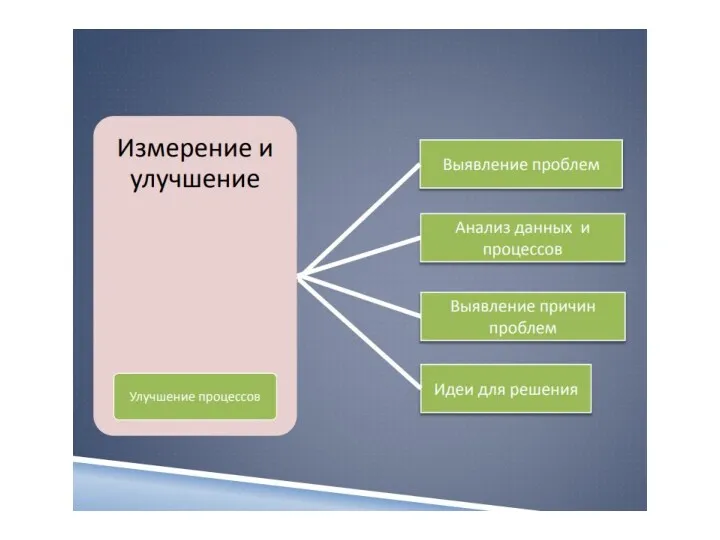
- 13. 7 Менеджмент несоответствующих событий 8 Оценивание работы лаборатории 9 Управление информационными потоками 10 Обслуживание клиентов и
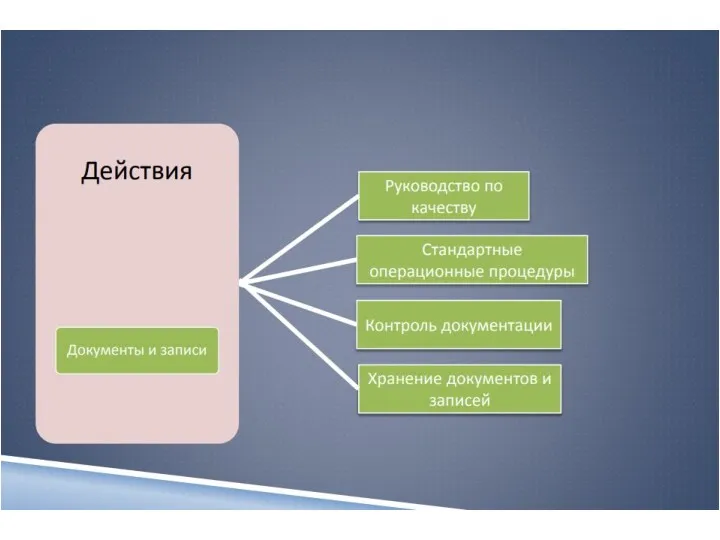
- 27. Документация и документирование
- 28. Регламентирующая и учетная документация. Система документации лаборатории состоит из регламентирующих документов, которые содержат описания всех типов
- 29. Управление документами Основная цель управления документацией – обеспечение того, что находящиеся в обращении документы «правильные» и
- 30. Управление документацией Установлены процедуры управления документацией Имеется журнал регистрации документов Все документы проверены и утверждены Периодически
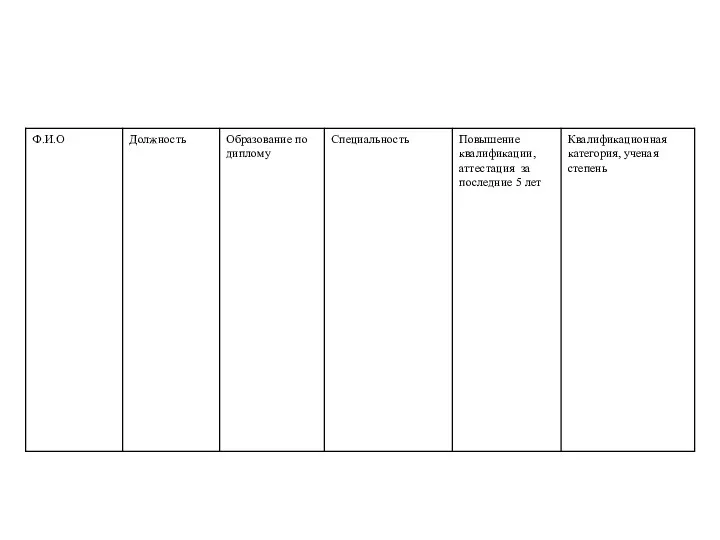
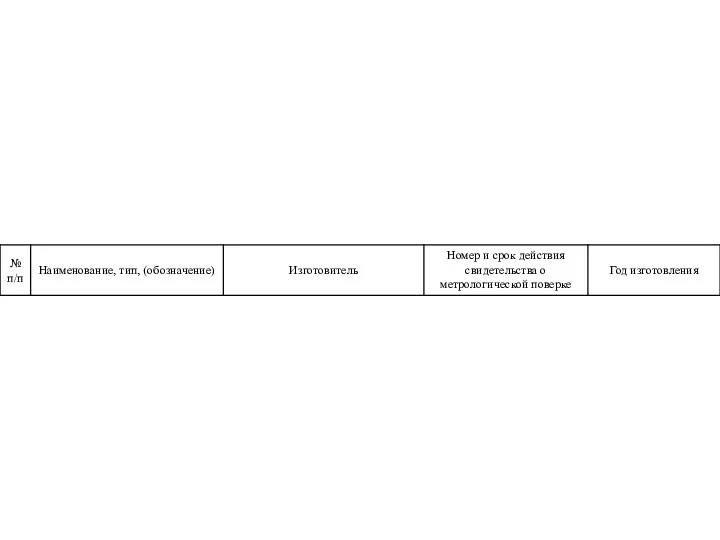
- 31. Паспорт Клинико – Диагностической лаборатории Перечень выполняемых исследований Перечень основного оборудования (средства измерения) Перечень вспомогательного оборудования
- 36. Основа планирования и организации работы- стандартные операционные процедуры (СОП) СОП - документально оформленные инструкции по выполнению
- 37. Разрабатываемые в лаборатории СОП должны охватывать все виды деятельности и процессы, выполняемые в лаборатории персонал лаборатории,
- 38. процедуры управление данными; меры предосторожности и меры безопасности; обработку и удаление отходов, включая биоотходы; процедуры внутреннего
- 39. Стандартная операционная процедура (СОП) Соблюдение и документирование правил проведения клинических лабораторных исследований в лаборатории осуществляется путем
- 40. СОП составляются непосредственно в лаборатории для каждого рабочего места и для каждой целенаправленной группы действий оператора
- 41. С целью описания алгоритма действий, регламентации процесса лабораторного исследования, его этапов и стандартных операционных процедур в
- 42. Национальные стандарты – для регламентации организации всего процесса лабораторного исследования и отдельных его этапов, требо- ваний
- 43. Стандартизованные или гармонизированные аналитические технологии, представленные в виде клинических рекомендаций проведения клинических лабораторных исследований – для
- 44. Нормативные документы РФ используемые для составления СОП в КДЛ СанПиН 2.1.3.2630-10, СанПин 1.3.2322-08, СанПиН 2.1.7.2790-10, СанПин
- 45. Минимальный перечень СОП преаналитического этапа, утвержденный руководителем медицинской организации, после их представления руководителем Лаборатории и согласования
- 46. заполнение бланка-запроса на лабораторное исследование лечащим врачом; первичная регистрация пациента; контроль соблюдения пациентом правил подготовки к
- 47. Минимальный перечень СОП преаналитического этапа, утверждаемый заведующим лаборатории: прием, регистрация и оценка качества биоматериала лабораторией; правила
- 48. Минимальный перечень СОП аналитического этапа, утверждаемый руководителем лаборатории: СОП по всем «ручным методам» и методам, где
- 49. правила оценки данных, полученных в ходе внутреннего контроля качества (по видам исследований); правила калибровки оборудования (с
- 50. правила работы с информационными системами лаборатории; организация межлабораторных сличений; проведение верификации и реверификации анализаторов; проведение верификации
- 51. правила расчета неопределенности; правила расчета общей ошибки; правила гармонизации данных, полученных в одной лаборатории для одного
- 52. Важность внедрения СОП: Возможность обеспечить единообразие, согласованность и контроль над проводимыми процессами и гарантировать, что процедура
- 53. Хорошая СОП дает детальные, ясные и полные инструкции по выполнению анализов легко доступна, понятна новым сотрудникам
- 54. Требования к технической компетентности медицинских лабораторий
- 55. ISO 15189 устанавливает требования к технической компетентности лабораторий, включающие: техническую компетентность персонала условия проведения исследований выбор,
- 56. Лаборатория должна обеспечить подготовку персонала по следующим направлениям (5.1.5) система менеджмента качества; процессы и процедуры, касающиеся
- 57. Оценивание технической компетентности персонала должна осуществляться (5.1.6): прямым наблюдением за ходом подготовки образцов и осуществления исследований,
- 58. Помещения и условия работы (5.2) Лаборатория должна иметь помещения, необходимые для осуществления ее деятельности, конструкция которых
- 59. Лаборатории должны использовать только валидированые или верифицированные методики (5.5.1)
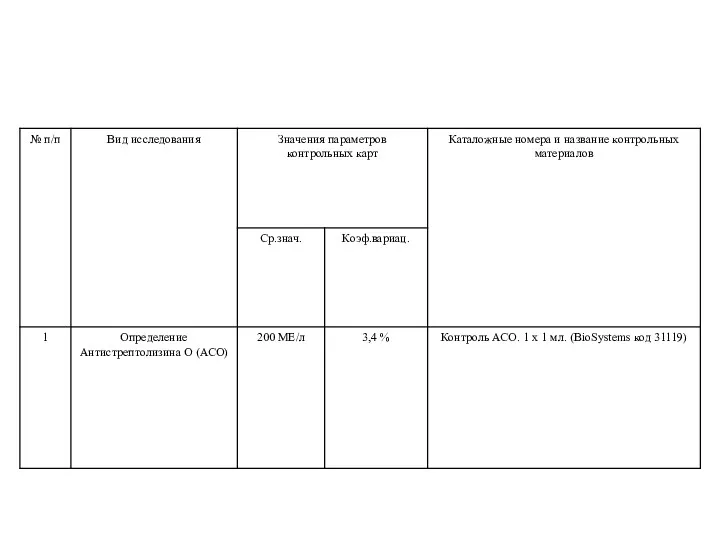
- 60. Обеспечение качества результатов исследования (5.6) Лаборатория должна разработать и внедрить процедуры внутрилабораторного контроля качества, с помощью
- 61. Лаборатория должна обязательно участвовать в программе ( программах ) межлабораторных сравнений , (таких , как программы
- 64. Скачать презентацию









































 Интегративная психотерапия снижения вреда
Интегративная психотерапия снижения вреда Кровотечение. Гемостаз. Лекция 2
Кровотечение. Гемостаз. Лекция 2 Стабилизация инъекционных растворов
Стабилизация инъекционных растворов Маркировка и прослеживаемость товаров. Целевая схема решения Сheck, Track & Trace для фармацевтического рынка
Маркировка и прослеживаемость товаров. Целевая схема решения Сheck, Track & Trace для фармацевтического рынка Патология нервной системы
Патология нервной системы Коклюш у детей раннего возраста
Коклюш у детей раннего возраста Боль, условные рефлексы
Боль, условные рефлексы Поражение Лор-органов при острой респираторной вирусной инфекции
Поражение Лор-органов при острой респираторной вирусной инфекции Бұлшықет жиырылуы, механизмы. Қозудын синапс арқылы өтуі
Бұлшықет жиырылуы, механизмы. Қозудын синапс арқылы өтуі Методы исследования больных с патологией органов мочевыделения. Лекция №8
Методы исследования больных с патологией органов мочевыделения. Лекция №8 Ревматизм. Набуті вади серця
Ревматизм. Набуті вади серця Введение в торакальную хирургию
Введение в торакальную хирургию Ожирение среди подростков. Ожирение - хроническое заболевание
Ожирение среди подростков. Ожирение - хроническое заболевание Организация и структура системы первичной медико-санитарной помощи
Организация и структура системы первичной медико-санитарной помощи Навязчивые (обсессивно-компульсивные) расстройства
Навязчивые (обсессивно-компульсивные) расстройства Препараты гормонов и их аналогов
Препараты гормонов и их аналогов Современные остоиндуктивные материалы
Современные остоиндуктивные материалы Биоревитализация, как базовая процедура в эстетической медицине
Биоревитализация, как базовая процедура в эстетической медицине Оказание неотложной помощи в психиатрии и неврологии
Оказание неотложной помощи в психиатрии и неврологии Диагностика тромбоза мезентериальных сосудов
Диагностика тромбоза мезентериальных сосудов Строение, особенности химического поведения алкалоидов, обладающих биологической активностью
Строение, особенности химического поведения алкалоидов, обладающих биологической активностью Дезинфекция, дезинсекция, дератизация
Дезинфекция, дезинсекция, дератизация Аномалия формы зубных рядов
Аномалия формы зубных рядов Синдром раздраженного кишечника в амбулаторной практике
Синдром раздраженного кишечника в амбулаторной практике Морфофункциональная характеристика зубочелюстной системы при врожденных аномалиях развития лица и челюстей
Морфофункциональная характеристика зубочелюстной системы при врожденных аномалиях развития лица и челюстей Гепатит A (Болезнью Боткин)
Гепатит A (Болезнью Боткин) Листериялар. Морфологиясы, физиологиясы, листериялардың антигендері. Экологиясы. Әйелдер патологиясындағы ролі
Листериялар. Морфологиясы, физиологиясы, листериялардың антигендері. Экологиясы. Әйелдер патологиясындағы ролі Инфекции, передаваемые половым путем. Меры их профилактики
Инфекции, передаваемые половым путем. Меры их профилактики