Содержание
- 2. Мастерство лектора
- 3. Основные определения Требования к лекции: научность доступность посильная трудность эмоциональность наличие обратной связи связь с другими
- 4. Структура и формат лекции Характер изложения материала: объяснительно-описательный проблемно-дискуссионный систематический и системный опережающее изучение материала (связь
- 5. Техника чтения лекции Внутренняя организация лекции Приветствие Актуализация опорных знаний (в формате «вопрос – ответ») Поддержание
- 6. Оценка качества лекции Свободное посещение лекций Посещение лекций по выбору Уровень обратной связи «студент – лектор»
- 7. Лекция: технические средства Традиционные ТСО: плакаты, таблицы, портреты лекционные демонстрации (вещества, минералы, изделия) химический демонстрационный эксперимент
- 8. Анимированные презентации Оптимальное сочетание: информативность + наглядность Иллюстрации Видео Анимированные объяснения Далее: примеры анимированных презентаций к
- 9. Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз смеси HF и KF)
- 10. Простые вещества: F2, Cl2, Br2, I2, At2 Иод Бром Фтор Хлор
- 11. Фтор: распространение в природе Кларк 0,03% Флюорит (плавиковый шпат) CaF2 Криолит Na3[AlF6] Фторапатит 3Ca3(PO4)2 · CaF2
- 12. Обнаружение соединений бора Na2B4O7 + 12C2H5OH + 2H2SO4 = = 4B(OC2H5)3 + 7H2O + 2NaHSO4 2B(OC2H5)3
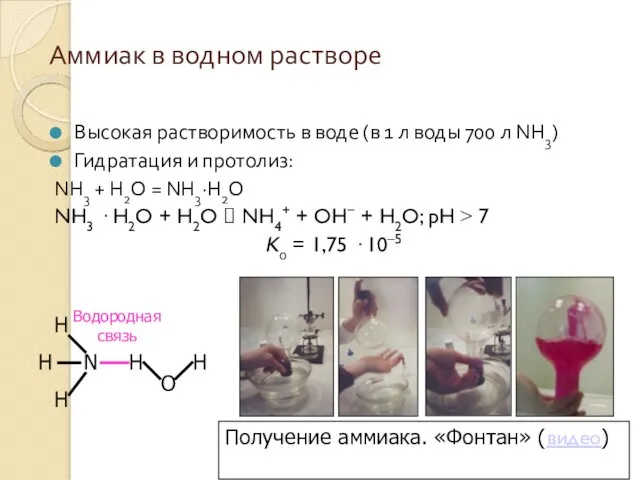
- 13. Аммиак в водном растворе Высокая растворимость в воде (в 1 л воды 700 л NH3) Гидратация
- 14. 2 NO2(г) ⮀ N2O4 (г); ΔH°298 = −57кДж При повышении температуры (горячая вода) газ внутри правого
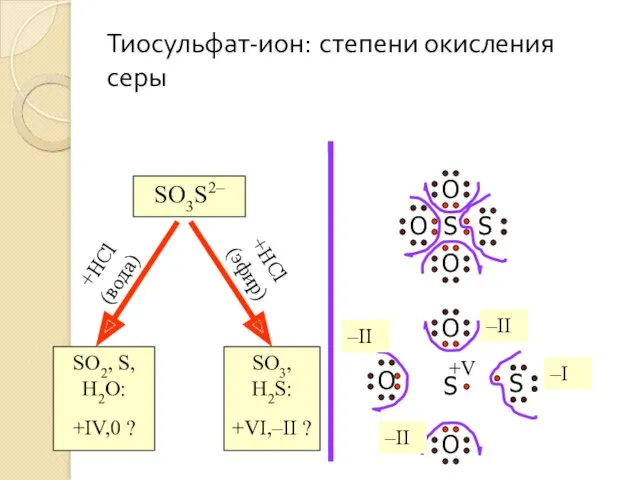
- 15. +HCl (вода) +HCl (эфир) Тиосульфат-ион: степени окисления серы SO3S2– SO2, S, H2O: +IV,0 ? SO3, H2S:
- 16. T = const Вода Исследование растворимости веществ
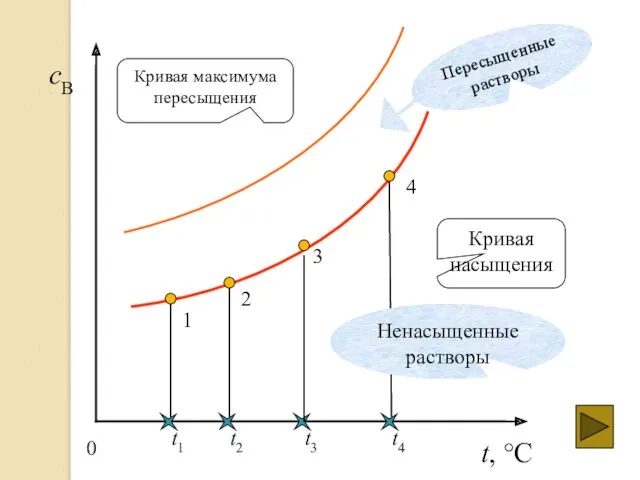
- 17. Диаграмма растворимости График зависимости растворимости от температуры – диаграмма (политерма) растворимости
- 18. t, °C cB t1 1 t2 2 t3 3 t4 4 Кривая насыщения Кривая максимума пересыщения
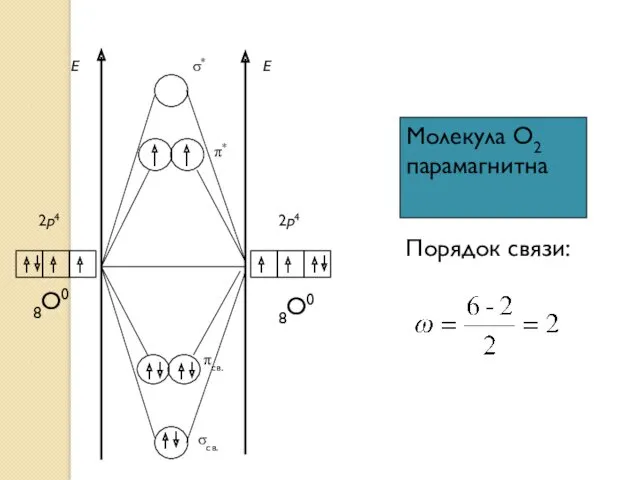
- 19. Молекула O2 парамагнитна Порядок связи:
- 20. Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ + 4 NH4+ ; Kc
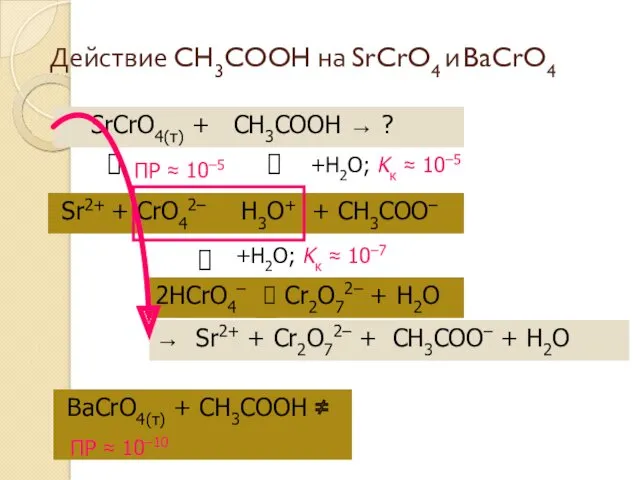
- 21. Действие CH3COOH на SrCrO4 и BaCrO4 SrCrO4(т) + CH3COOH → ? ⮃ Sr2+ + CrO42– ⮃
- 22. Федеральный центр информационно-образовательных ресурсов (http://fcior.edu.ru/about.page) Каталог сайта ФЦИОР объединяет более 12 000 электронных учебных модулей, созданных
- 23. Портал ФЦИОР
- 24. Пример модуля ФЦИОР
- 25. Единая коллекция цифровых образовательных ресурсов (http://school-collection.edu.ru/)
- 26. Из коллекции «Химия»
- 27. Видеоопыт «Взаимодействие алюминия с бромом» Демонстрация видеоопыта
- 28. Дополнительно… Обобщение и систематизация лекционного материала (как задания для внеаудиторной СРС) Организация деловых игр и поточных
- 29. Семинарские занятия Семинар – этап громкой внешней речи Разъяснение правил, формулировок, законов Решение расчетных задач Опробование
- 30. Активная форма проведения семинара (примеры) Включение элементов текущего персонального контроля (примеры) Подготовка преподавателя к проведению семинаров
- 31. Структура и формат семинара Организационный момент: проверка присутствия студентов на семинаре. Краткое вступительное слово преподавателя (связь
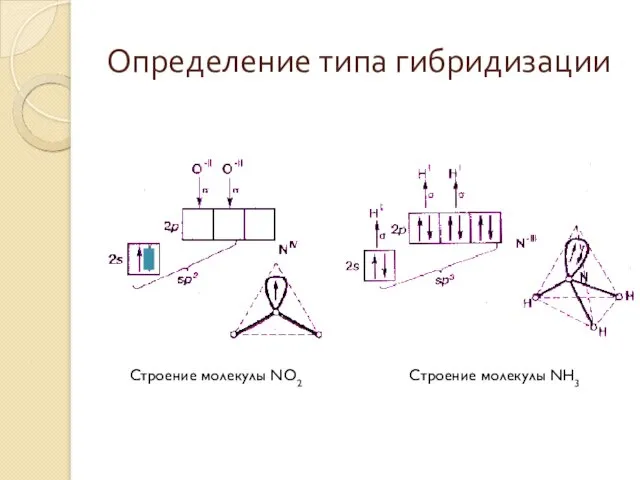
- 32. Алгоритм предсказания типа гибридизации и формы частицы находят центральный атом и определяют число σ-связей (по числу
- 33. Определение типа гибридизации
- 34. Семинарские занятия В группах, неоднородных по возрасту или уровню подготовки студентов, применяются сочетания письменной и устной
- 36. Скачать презентацию









![Фтор: распространение в природе Кларк 0,03% Флюорит (плавиковый шпат) CaF2 Криолит Na3[AlF6] Фторапатит 3Ca3(PO4)2 · CaF2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/111025/slide-10.jpg)



![Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/111025/slide-19.jpg)








 Исследовательская работа: основные особенности
Исследовательская работа: основные особенности Формирование универсальных учебных действий
Формирование универсальных учебных действий Что мешает ребенку в успешной учебе?
Что мешает ребенку в успешной учебе? Классный час Вредная еда.
Классный час Вредная еда. Творческий курс Юный дизайнер
Творческий курс Юный дизайнер Формы организации внеурочной деятельности
Формы организации внеурочной деятельности Пластилиновая живопись. Занятие 3
Пластилиновая живопись. Занятие 3 Нравственно-патриотическое воспитание в проектно-исследовательской деятельности отделения дополнительного образования
Нравственно-патриотическое воспитание в проектно-исследовательской деятельности отделения дополнительного образования Фрукты. Урок логопеда
Фрукты. Урок логопеда Тайны мыльных пузырей. Исследовательская работа
Тайны мыльных пузырей. Исследовательская работа Сценарий литературно-музыкальной композиции Я помню! Я горжусь! для учащихся 5- 11 классов
Сценарий литературно-музыкальной композиции Я помню! Я горжусь! для учащихся 5- 11 классов Обновление профессиональной деятельности музыкального руководителя
Обновление профессиональной деятельности музыкального руководителя Почему ребёнок плохо учится?
Почему ребёнок плохо учится? Программа внеурочной деятельности Глиняные сказки. Обучение учащихся 1 класса лепке из глины. Кружок Послушная глина
Программа внеурочной деятельности Глиняные сказки. Обучение учащихся 1 класса лепке из глины. Кружок Послушная глина Поле чудес по ЧуковскомуК.И.
Поле чудес по ЧуковскомуК.И. Формирование информационной культуры учителя
Формирование информационной культуры учителя Изготовление поздравительной открытки с сюрпризом
Изготовление поздравительной открытки с сюрпризом Презентация к 8 марта!
Презентация к 8 марта! Сила Истины Гуманной Педагогики Шалвы Амонашвили
Сила Истины Гуманной Педагогики Шалвы Амонашвили Игра. Какого фрагмента не хватает
Игра. Какого фрагмента не хватает Виховна робота зі студентською молоддю
Виховна робота зі студентською молоддю Что такое пятый класс?
Что такое пятый класс? Портфолио. Косякова Анастасия Валерьевна
Портфолио. Косякова Анастасия Валерьевна Оптические иллюзии
Оптические иллюзии Использование здоровьесберегающих технологий в работе с детьми дошкольного возраста
Использование здоровьесберегающих технологий в работе с детьми дошкольного возраста Компетентностный подход в образовании
Компетентностный подход в образовании Жить здорово здорово!
Жить здорово здорово! Презентация по теме: Наркотики(для родителей)
Презентация по теме: Наркотики(для родителей)