Содержание
- 2. Физические свойства низшие имеют резкий запах хорошо растворимые в воде с С 1-3; имеют душистый запах
- 3. Физические свойства альдегидов формальдегид уксусный альдегид
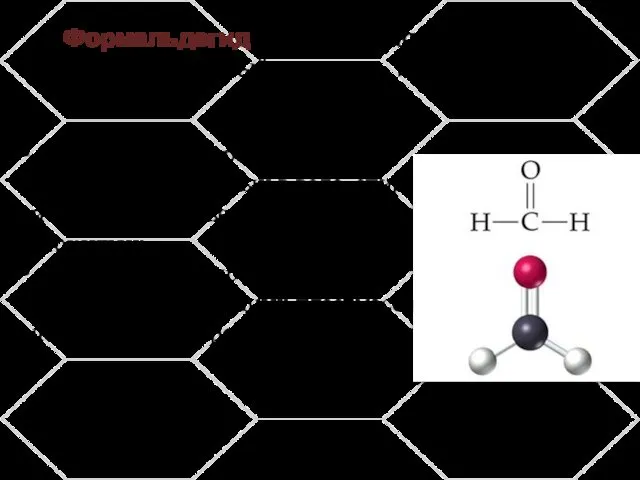
- 4. Формальдегид (от лат. formīca «муравей»), муравьиный альдегид, метаналь. бесцветный газ с резким запахом; хорошо растворимый в
- 5. Уксусный альдегид (этаналь, ацетальдегид, метилформальдегид). Летучая жидкость; хорошо растворимая в воде; ядовит; используется для производства уксусной
- 6. КЕТОНЫ низшие представители – жидкость, растворимые в воде со своеобразным запахом. высшие - твердые вещества, без
- 7. Ацетон бесцветная горючая жидкость с характерным запахом; хорошо растворяется в воде и органических веществах; не полимеризуется.
- 8. Реакции присоединения: А) реакция гидрирования Б) реакция присоединения NaHSO3 В) присоединение спиртов Г) присоединение синильной кислоты
- 9. Химические свойства альдегидов Реакции присоединения водорода (гидрирование)
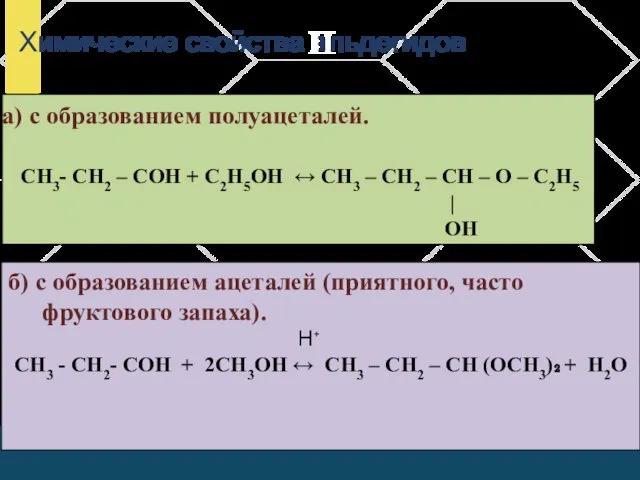
- 10. Химические свойства альдегидов П а) с образованием полуацеталей. СН3- СН2 – СОН + С2Н5ОН ↔ СН3
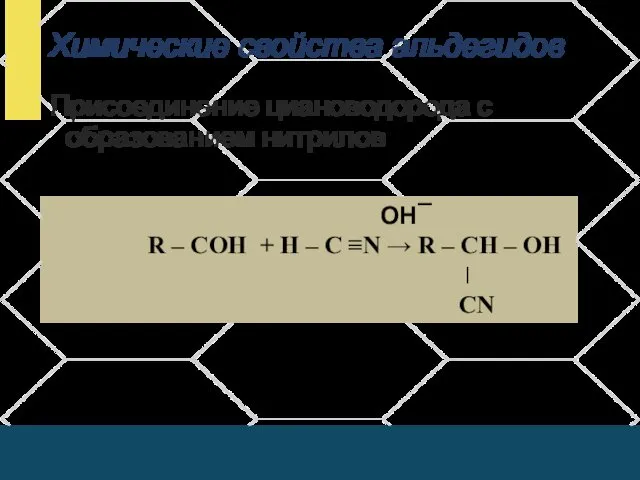
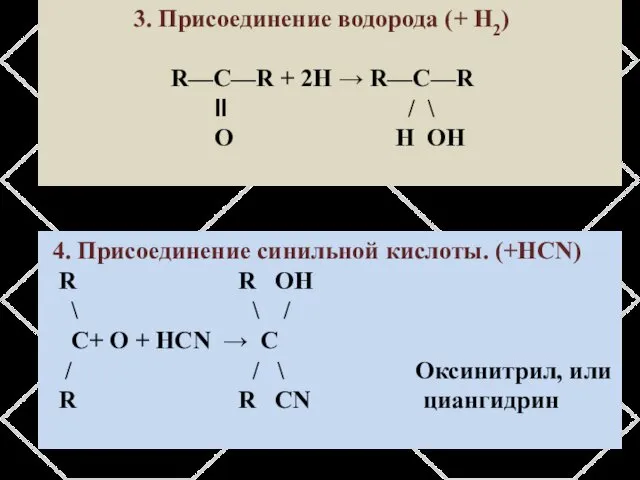
- 11. Химические свойства альдегидов Присоединение циановодорода с образованием нитрилов ОН¯ R – СОН + Н – С
- 12. Реакция "серебряного" зеркала. Качественная реакция на альдегидную группу Реакции окисления
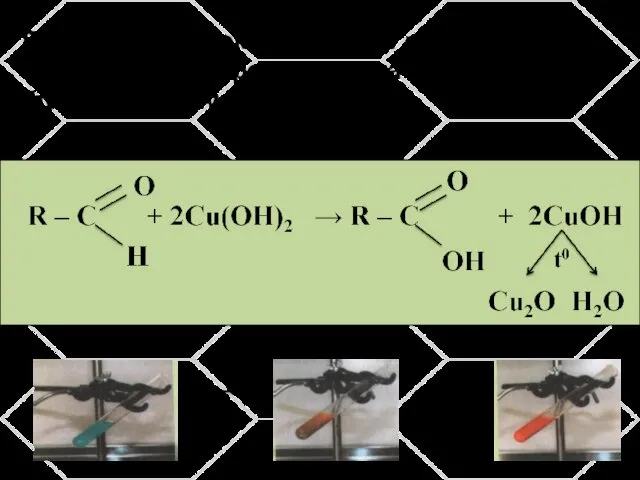
- 13. Реакция с гидроксидом меди при нагревании. Качественная реакция на альдегидную функциональную группу.
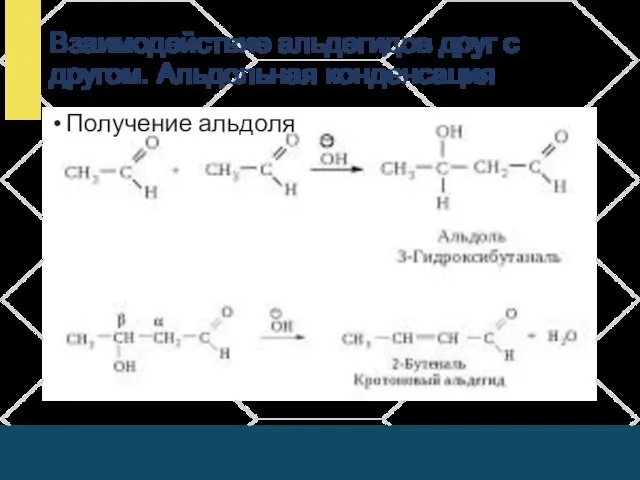
- 14. Взаимодействие альдегидов друг с другом. Альдольная конденсация Получение альдоля
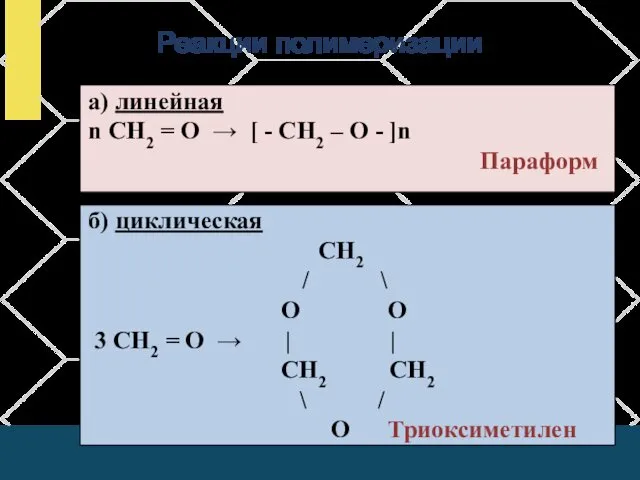
- 15. Реакции полимеризации а) линейная n СН2 = О → [ - СН2 – О - ]n
- 16. Химические свойства кетонов Гидрирование кетонов Ni R1 — C — R2 + H2 → R1 —
- 17. 3. Присоединение водорода (+ H2) R—C—R + 2H → R—C—R ӀӀ / \ O H OH
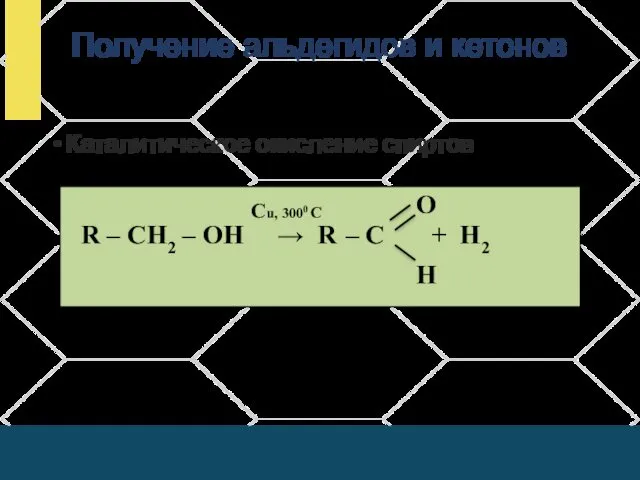
- 18. Получение альдегидов и кетонов Каталитическое окисление спиртов
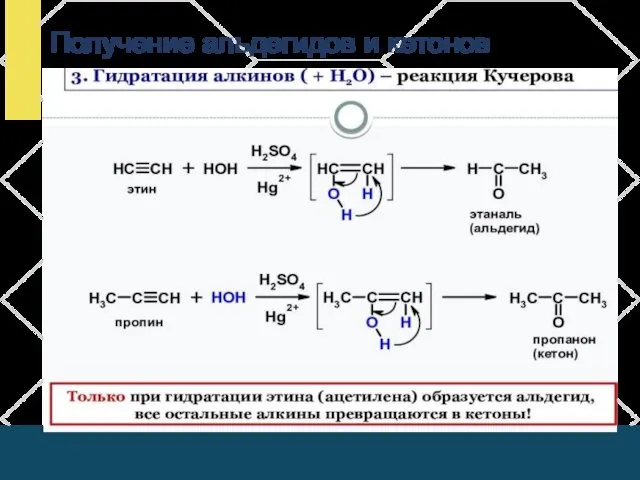
- 19. Получение альдегидов и кетонов
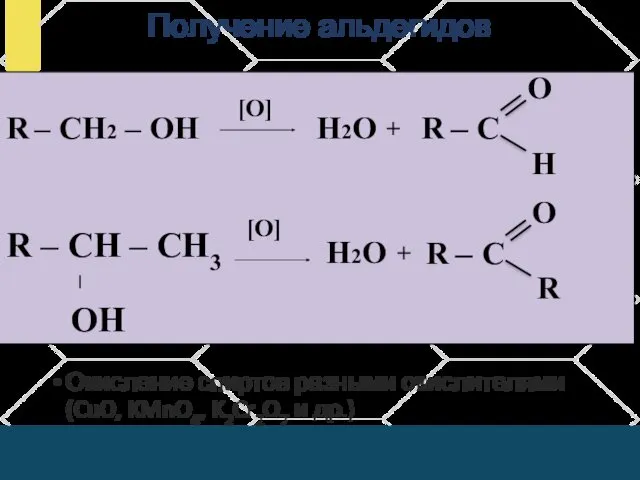
- 20. Получение альдегидов Окисление спиртов разными окислителями (CuO, KMnO4, K2Cr2O7 и др.) R – СH2 – OH
- 22. Скачать презентацию








 20190208_prezentatsiya_uch_goda
20190208_prezentatsiya_uch_goda Крымский пейзаж глазами художников
Крымский пейзаж глазами художников Гигиена почвы
Гигиена почвы Творческий проектДень матери
Творческий проектДень матери Публичная презентация профессиональному сообществу
Публичная презентация профессиональному сообществу Искусство иллюстрации. Слово и изображение. 7 класс
Искусство иллюстрации. Слово и изображение. 7 класс Монтаж строительных конструкций
Монтаж строительных конструкций Система продольного набора контейнеровоза
Система продольного набора контейнеровоза Презентация к родительскому собранию тема: Роль семьи в воспитании личности ребенка , о поощрениях и наказаниях в семье
Презентация к родительскому собранию тема: Роль семьи в воспитании личности ребенка , о поощрениях и наказаниях в семье 20230814_estafetnyy_beg
20230814_estafetnyy_beg Презентация Я помню, я горжусь...
Презентация Я помню, я горжусь... прикольные картинки (хорошее настроение 1)
прикольные картинки (хорошее настроение 1) Зороастризм
Зороастризм Основные понятия и задачи автоматизации
Основные понятия и задачи автоматизации Классификация военных радиорелейных средств связи. (Тема 1.2)
Классификация военных радиорелейных средств связи. (Тема 1.2) Сырье для производства гидроизоляционных материалов
Сырье для производства гидроизоляционных материалов Пища, которую мы едим. Вред или польза
Пища, которую мы едим. Вред или польза Основы технологического процесса выплавки и внепечной обработки стали ЭСПЦ - 1
Основы технологического процесса выплавки и внепечной обработки стали ЭСПЦ - 1 Троянский конь
Троянский конь New York City
New York City Флеш-карта по нравственно-патриотическому воспитанию
Флеш-карта по нравственно-патриотическому воспитанию Психологічна підготовка спортивних тренувань і змагань
Психологічна підготовка спортивних тренувань і змагань Внеклассное мероприятие Посвящение в химики
Внеклассное мероприятие Посвящение в химики Сущность и основные школы менеджмента
Сущность и основные школы менеджмента Проектная деятельность Наши будущие защитники
Проектная деятельность Наши будущие защитники Дидактическая игра Волшебный цветок
Дидактическая игра Волшебный цветок Жизненная форма
Жизненная форма Вежливое поведение детей
Вежливое поведение детей