Слайд 2

Цели урока
изучить способы получения,
химические свойства
применение алкенов
на примере
непредельного углеводорода - этилена
Слайд 3
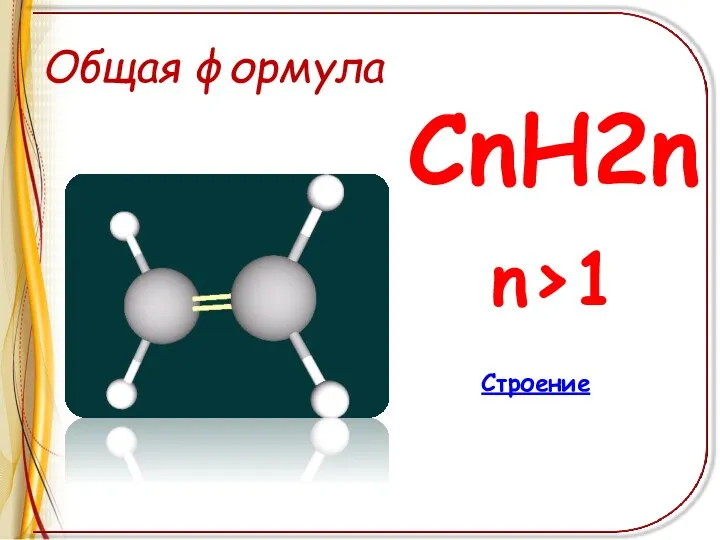
Общая формула
СnH2n
n>1
Строение
Слайд 4
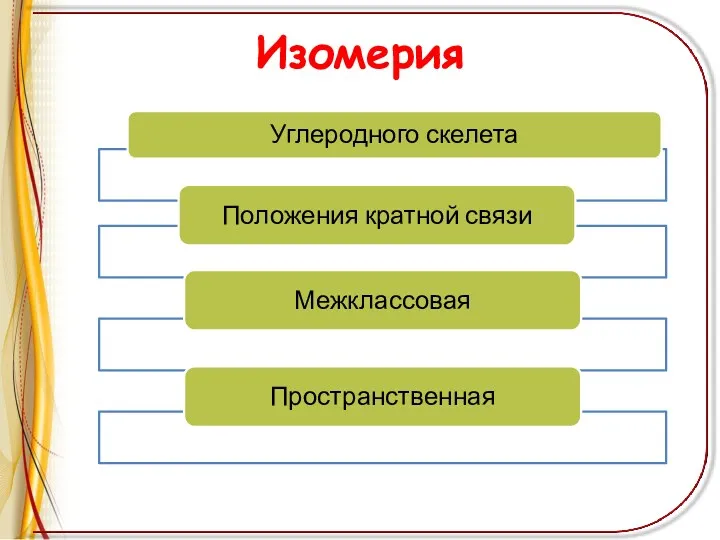
Слайд 5
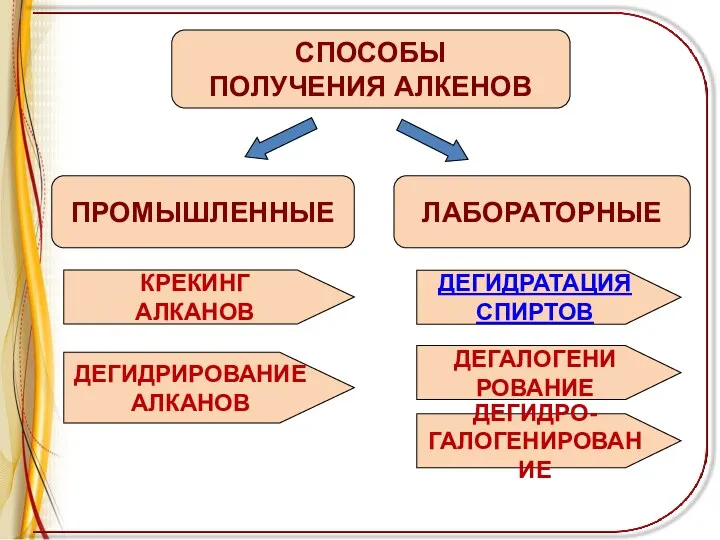
ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 6
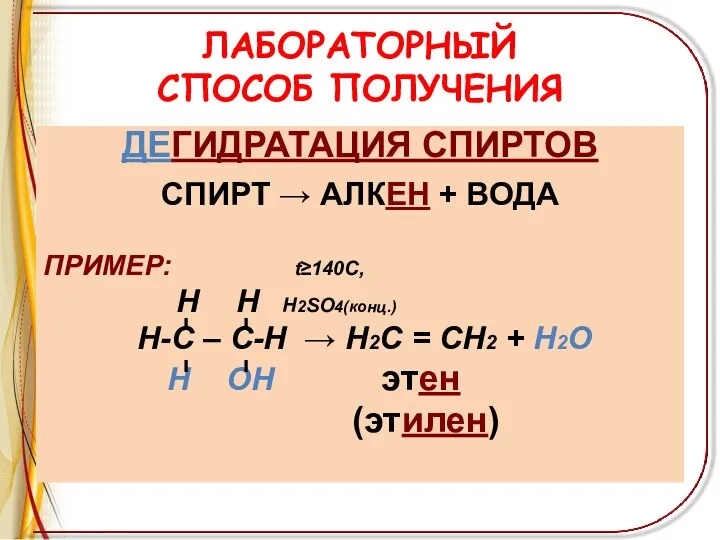
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР: t≥140C,
Н Н
Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 7

Получение алкенов
КРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ С
МЕНЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С 10 Н 22→ С5Н 12+ С5Н10
декан пентан пентен
Слайд 8
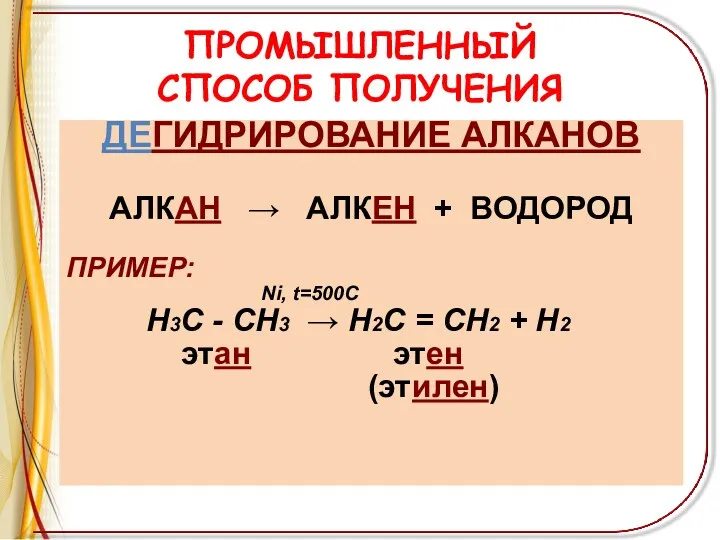
ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
Слайд 9
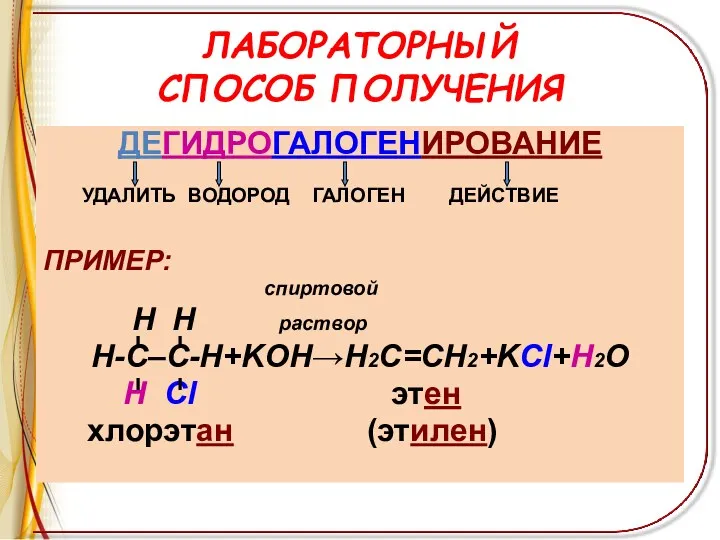
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н
Cl этен
хлорэтан (этилен)
Слайд 10

РЕАКЦИИ ОКИСЛЕНИЯ
ГОРЕНИЕ АЛКЕНОВ
ПРИМЕР:
С2Н4 + 3О2 2СО2 + 2Н2О
Слайд 11

РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция
Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O H2C - CH2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь
Слайд 12
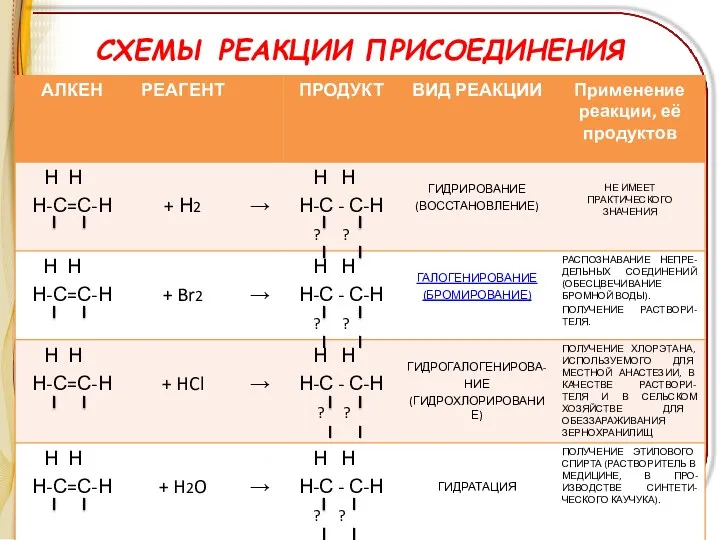
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Слайд 13

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n CH2=CH2
(-CH2-CH2-)n
этилен полиэтилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено












 Презентация к педагогическим чтениям
Презентация к педагогическим чтениям Кроссворд по теме: “Революция в Англии”
Кроссворд по теме: “Революция в Англии” Кадровая политика и кадровая безопасность России
Кадровая политика и кадровая безопасность России JavaScript Основы WEB-программирования
JavaScript Основы WEB-программирования Портфолио учащегося
Портфолио учащегося Финансы и финансовая система Республики Беларусь
Финансы и финансовая система Республики Беларусь Здоровье сберегающие технологии
Здоровье сберегающие технологии Биологиялық дозиметрия (электрондық парамагниттік резонанс және тағы басқалары) және олардың тәжірибеде қолданылуы
Биологиялық дозиметрия (электрондық парамагниттік резонанс және тағы басқалары) және олардың тәжірибеде қолданылуы Создание 3D анимации
Создание 3D анимации Віртуальна експрес-подорож до дня Європи. Подорожі країнами, їх устрій, права та моралі
Віртуальна експрес-подорож до дня Європи. Подорожі країнами, їх устрій, права та моралі Оборудование, необходимый инвентарь, посуда бариста
Оборудование, необходимый инвентарь, посуда бариста Подъёмно-транспортные устройства
Подъёмно-транспортные устройства Бюджетно-налоговая политика
Бюджетно-налоговая политика Морфологический разбор частей речи. Синтаксический разбор предложения
Морфологический разбор частей речи. Синтаксический разбор предложения Оса (ребенок и окружающий мир)
Оса (ребенок и окружающий мир) Увертюра-фантазия Ромео и Джульетта, П.И.Чайковский
Увертюра-фантазия Ромео и Джульетта, П.И.Чайковский СТС: Управление качеством 3.0 ISO 9001:2015
СТС: Управление качеством 3.0 ISO 9001:2015 Презентация творческий портрет воспитателя
Презентация творческий портрет воспитателя Презентация к проекту на тему Лучшие друзья Целью является повышение речевой активности и коммуникативных способностей детей через организацию игровой, художественно-творческой деятельности и познавательно-речевого развития.
Презентация к проекту на тему Лучшие друзья Целью является повышение речевой активности и коммуникативных способностей детей через организацию игровой, художественно-творческой деятельности и познавательно-речевого развития. Самара – крупный город в среднем Поволжье России
Самара – крупный город в среднем Поволжье России Мягкая игрушка Зайка
Мягкая игрушка Зайка Оценка шероховатости поверхностей деталей после механической обработки
Оценка шероховатости поверхностей деталей после механической обработки Робота гуртків спортивного орієнтування
Робота гуртків спортивного орієнтування День качества июнь 2017 г. ООО ПКФ „Саардоникс“ 2017 г
День качества июнь 2017 г. ООО ПКФ „Саардоникс“ 2017 г История и теории зоопсихологии
История и теории зоопсихологии Внеурочная деятельность в 1 классе в рамках реализации ФГОС НОО Диск
Внеурочная деятельность в 1 классе в рамках реализации ФГОС НОО Диск Особенности и проблемы информирования в СМИ о воздушно-спортивном эквилибре
Особенности и проблемы информирования в СМИ о воздушно-спортивном эквилибре Внеклассное мероприятие Путешествие по музеям края
Внеклассное мероприятие Путешествие по музеям края