Содержание
- 2. АЛЮМИНИЙ. Нахождение в природе Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O
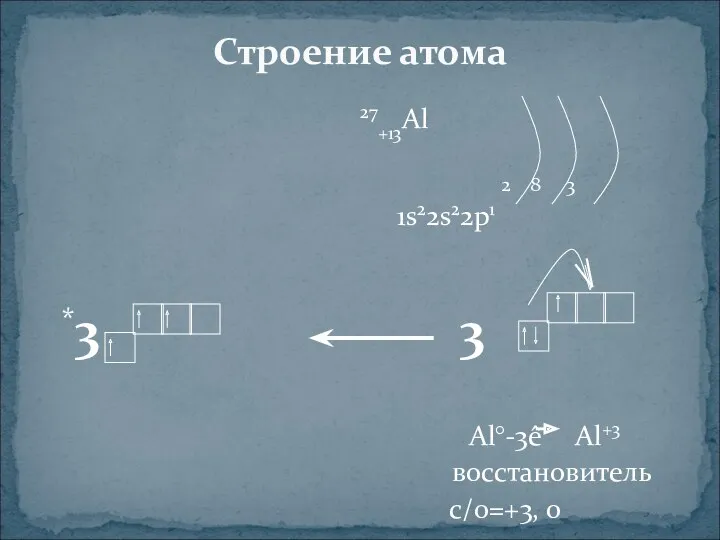
- 3. 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê Al+3 восстановитель с/о=+3, 0 Строение атома
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА Al-серебристо-белый металл Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы), легкий (плотность
- 5. ХИМИЧЕСКИЕ СВОЙСТВА Al – активный металл. На воздухе всегда покрыт пленкой Al2O3. Поэтому при обычных условиях
- 6. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ При обычных условиях Взаимодействие с кислородом: 4Al+ 3O2 =2Al2O3 +Q Взаимодействие с
- 7. Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует с растворами кислот 2Al
- 8. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4и HNO3 (он пассивируется),но при нагревании реакция возможна
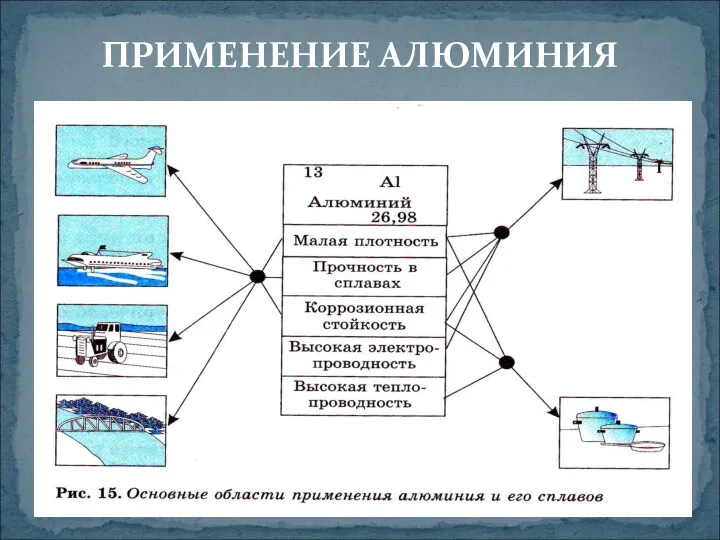
- 9. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 11. Скачать презентацию






 Предмет и метод теории государственного и муниципального управления
Предмет и метод теории государственного и муниципального управления Металлические материалы
Металлические материалы Формирование и развитие философии науки
Формирование и развитие философии науки Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Виды литья
Виды литья Технико-экономическая эффективность автоматизации технологических процессов
Технико-экономическая эффективность автоматизации технологических процессов Шаманы. Одежда и атрибуты надевавшиеся шаманом при калмании (поклонении) духам нижнего мира
Шаманы. Одежда и атрибуты надевавшиеся шаманом при калмании (поклонении) духам нижнего мира Интеллектуальная игра-викторина,посвящённая ВОВ И помнит мир спасённый... (из истории Сталинградской битвы)
Интеллектуальная игра-викторина,посвящённая ВОВ И помнит мир спасённый... (из истории Сталинградской битвы) Художня культура. Огляд основних напрямів художньої культури
Художня культура. Огляд основних напрямів художньої культури Вспомним всех поименно (презентация)
Вспомним всех поименно (презентация) Хирургическая инфекция
Хирургическая инфекция Энергосбережение в технологических процессах и электроприводах
Энергосбережение в технологических процессах и электроприводах Представление опыта работы учителя истории и обществознания МБОУ СОШ с. В - Казинка Долгоруковского района Липецкой области Боева Сергея Викторовича Реализация компетентностного подхода в курсе истории и обществознания через интерактивные формы р
Представление опыта работы учителя истории и обществознания МБОУ СОШ с. В - Казинка Долгоруковского района Липецкой области Боева Сергея Викторовича Реализация компетентностного подхода в курсе истории и обществознания через интерактивные формы р Project Management Tools - CPA
Project Management Tools - CPA Вступ в християнське богослов’я
Вступ в християнське богослов’я Счастливы вместе
Счастливы вместе Влияние ненормативной лексики на психическое состояние в группе
Влияние ненормативной лексики на психическое состояние в группе Динамические (функциональные) аспекты управления проектами
Динамические (функциональные) аспекты управления проектами Планирование и политика развития туризма
Планирование и политика развития туризма Автор и герой-рассказчик в тексте
Автор и герой-рассказчик в тексте Гипоксия (кислородное голодание)
Гипоксия (кислородное голодание) Перзентханадан ерте шығарылған жаңа туған нәресте мен ананың күтімі және медициналық қызмет көрсету ерекшеліктері
Перзентханадан ерте шығарылған жаңа туған нәресте мен ананың күтімі және медициналық қызмет көрсету ерекшеліктері Презентация по кубановедению на тему…БЕЗ ПРОШЛОГО НЕТ БУДУЩЕГО…
Презентация по кубановедению на тему…БЕЗ ПРОШЛОГО НЕТ БУДУЩЕГО… Christmas movies
Christmas movies Коробка для книг из пластиковых бутылок
Коробка для книг из пластиковых бутылок Место ребенка в семье Диск
Место ребенка в семье Диск Материал к конкурсу Учитель года Москвы - 2012
Материал к конкурсу Учитель года Москвы - 2012 Razdel_7_Ponyatie_faylovoy_sistemy_1
Razdel_7_Ponyatie_faylovoy_sistemy_1