Аминокислоты. Химический состав белков, строение белковой молекулы. Свойства и функции белков презентация
Содержание
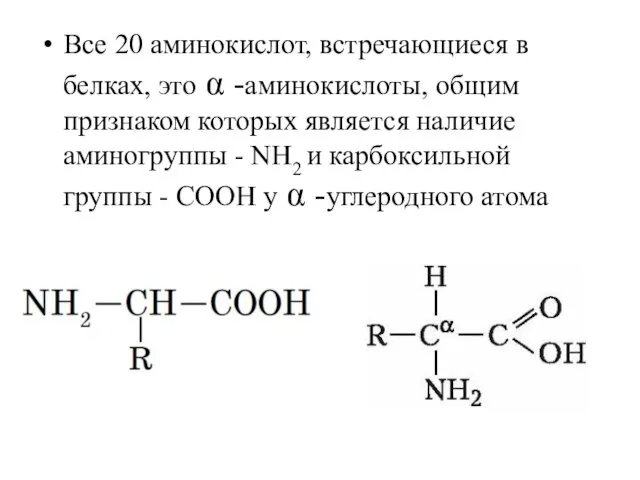
- 2. Все 20 аминокислот, встречающиеся в белках, это α -аминокислоты, общим признаком которых является наличие аминогруппы -
- 3. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ ПО ХИМИЧЕСКОМУ СТРОЕНИЮ По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические.
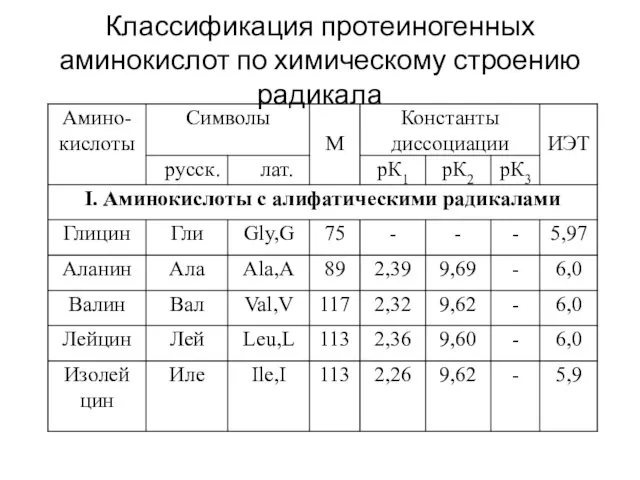
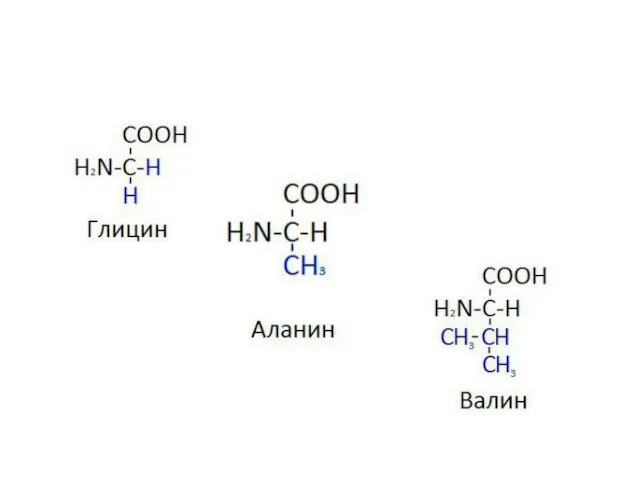
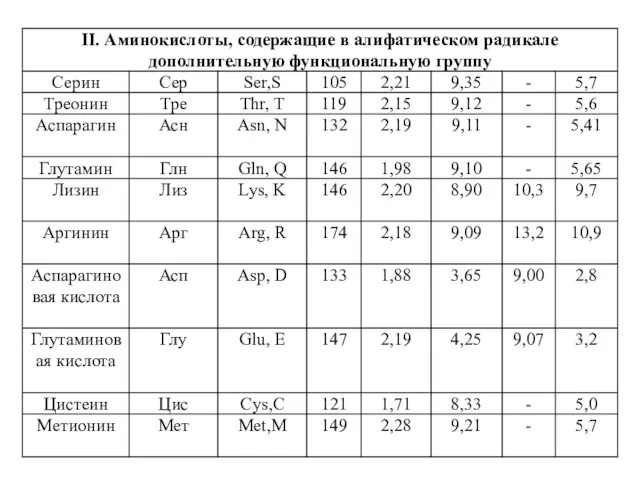
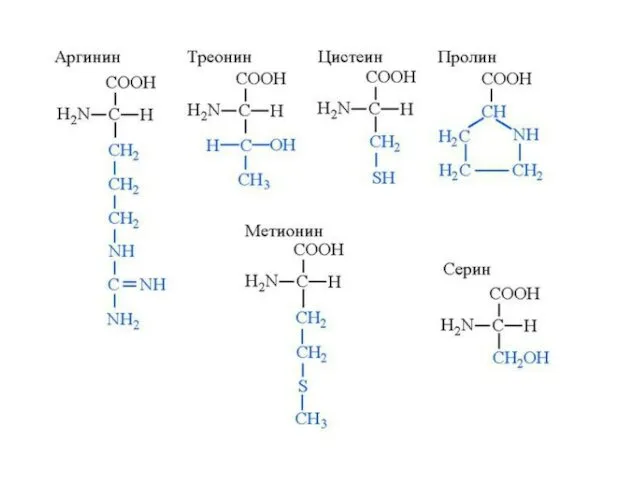
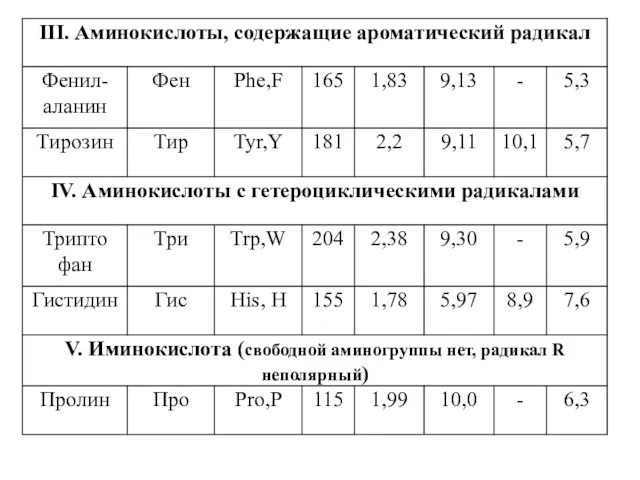
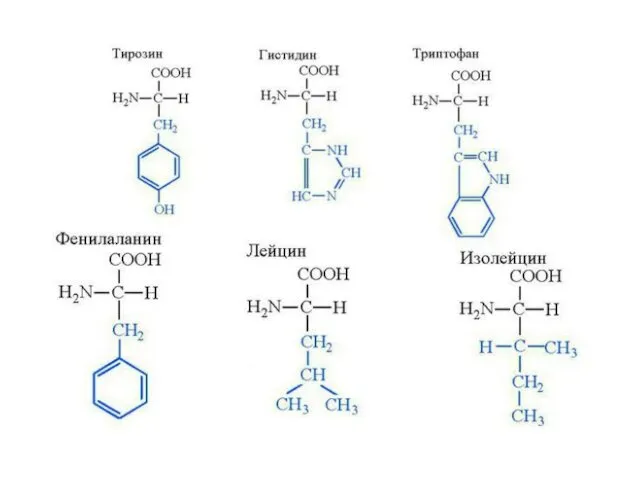
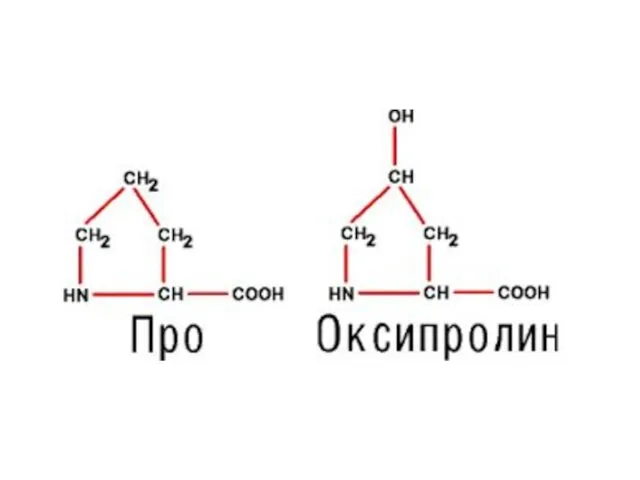
- 4. Классификация протеиногенных аминокислот по химическому строению радикала
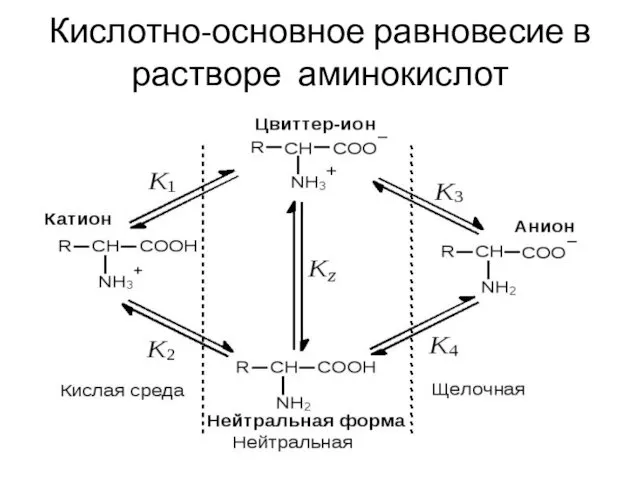
- 11. Кислотно-основное равновесие в растворе аминокислот
- 12. В природе известно более 100 аминокислот, из них 20 являются жизненно необходимыми. По способности синтезироваться в
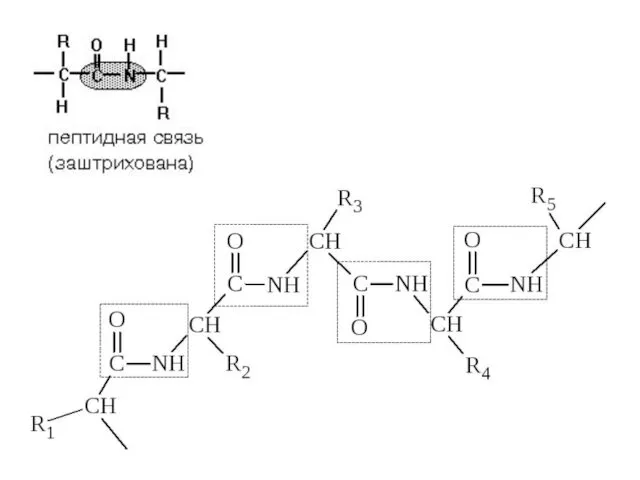
- 13. ПЕПТИДНАЯ СВЯЗЬ. СТРОЕНИЕ ПЕПТИДОВ α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная
- 14. СТРОЕНИЕ ПЕПТИДА Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют
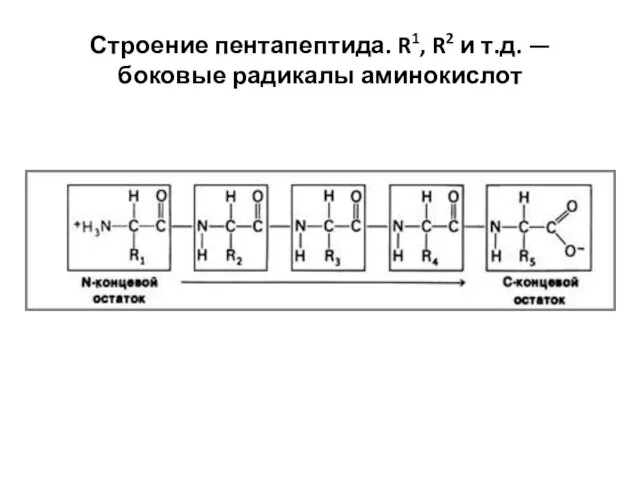
- 16. Строение пентапептида. R1, R2 и т.д. — боковые радикалы аминокислот
- 17. Белки - высокомолекулярные биополимеры, построенные из остатков аминокислот. Они составляют структурную и функциональную основу любого организма.
- 18. 5. Сократительная – белки мышц (актин, миозин, актомиозин) обеспечивают сокращение и расслабление мышц 6. Энергетическая –
- 19. Физико-химические и функциональные особенности белков Белки в среднем составляют 18-24% общей сырой массы организма и до
- 20. Сходство: медленность диффузии, неспособность к диализу, размер частиц. Различия: растворы ВМС – гомогенны, не имеют поверхности
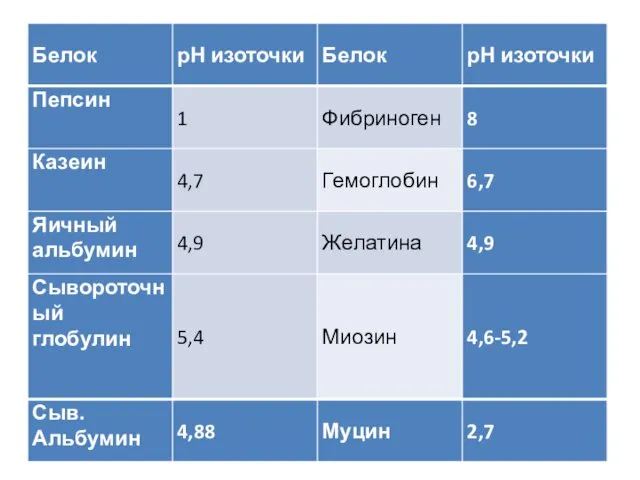
- 21. При определенной для каждого белка концентрации водородных ионов в молекуле белка устанавливается равенство положительных и отрицательных
- 23. В изоточке белок менее гидратирован, уменьшается его растворимость, он легче выпадает в осадок. Растворы ВМС устойчивы
- 24. Кроме явления коагуляции в растворах ВМС наблюдается при определенных условиях явление расслоения, при котором раствор ВМС
- 25. Одним из важнейших свойств белков, как лиофильных коллоидов, является их способность задерживать большое количество воды –
- 26. Все белки по форме молекул делят на фибриллярные и глобулярные. Фибриллярные (фибриллиа – волокно, лат.). Длина
- 27. Свойства глобулярных фибриллярных различны. Глобулярные растворимы в воде и в разбавленных солевых растворах. Фибриллярные в воде
- 28. Белки - это высокомолекулярные соединения (полимеры), состоящие из α -аминокислот - мономерных звеньев, соединенных между собой
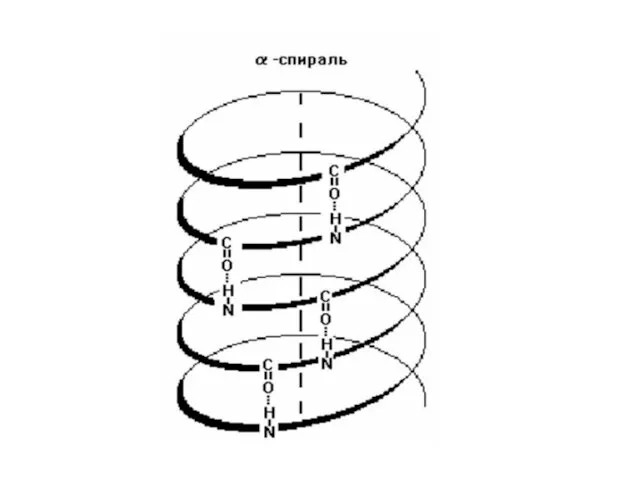
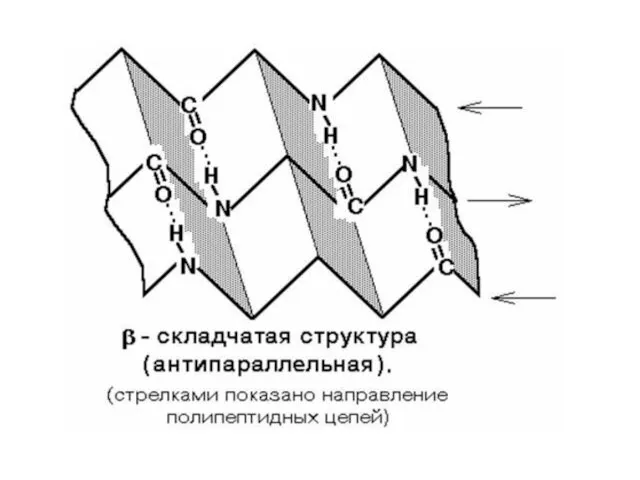
- 29. Первичная структура – это линейная последовательность аминокислотных остатков в полипептидной цепи. Вторичная структура белков – это
- 32. Третичная структура белка – это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые
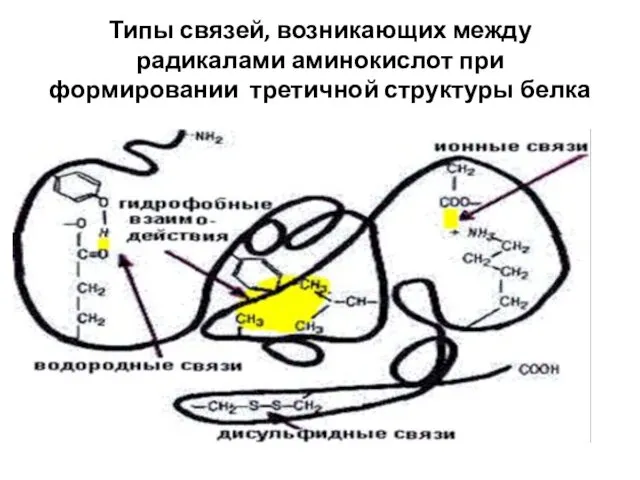
- 33. СВЯЗИ, СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ ГЛОБУЛЯРНОГО БЕЛКА Электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы
- 34. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка
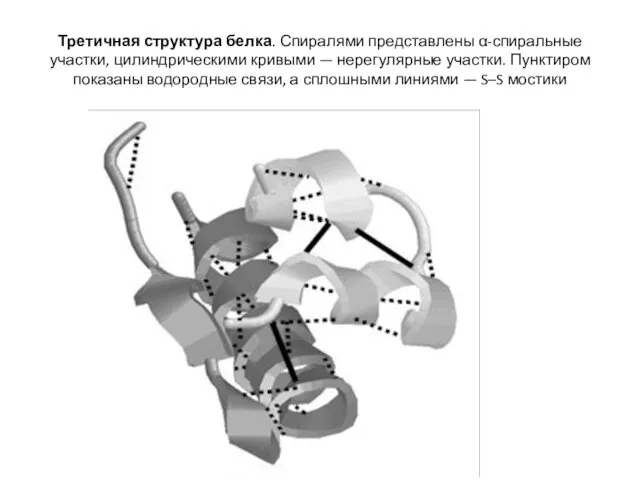
- 35. Третичная структура белка. Спиралями представлены α-спиральные участки, цилиндрическими кривыми — нерегулярные участки. Пунктиром показаны водородные связи,
- 36. ПРОСТРАНСТВЕННАЯ ЧЕТВЕРТИЧНАЯ СТРУКТУРА Ассоциация и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные
- 37. Четвертичная структура гемоглобина
- 38. ДЕНАТУРАЦИЯ БЕЛКОВ И ПОДДЕРЖАНИЕ ИХ НАТИВНОЙ КОНФОРМАЦИИ В УСЛОВИЯХ КЛЕТКИ Денатурация белков – это разрушение их
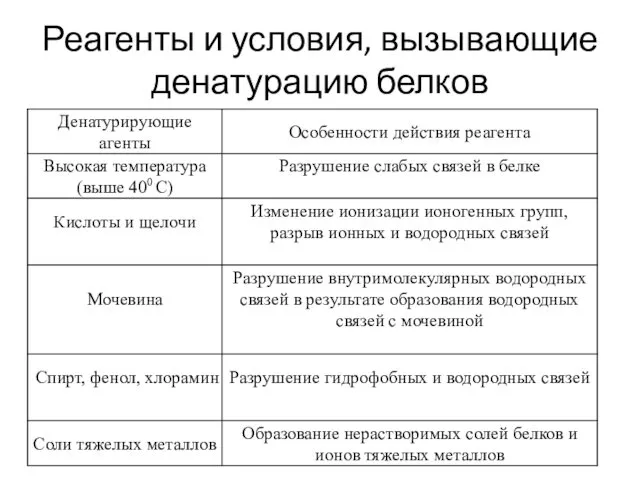
- 39. Реагенты и условия, вызывающие денатурацию белков
- 40. Денатурирующие агенты не разрушают первичную структуру белка. Сохранность первичной структуры белка - необходимое условие для восстановления
- 42. Скачать презентацию






















 Интерфейсы ПK
Интерфейсы ПK Денсаулықты кешенді бағалау денсаулық критерилері және денсаулық топтарын құрастыру
Денсаулықты кешенді бағалау денсаулық критерилері және денсаулық топтарын құрастыру Предоставление клиентам обязательной информации
Предоставление клиентам обязательной информации Иван Сергеевич Тургенев
Иван Сергеевич Тургенев Рождение ислама
Рождение ислама Назначение и состав операционной системы
Назначение и состав операционной системы Пәннің жалпылай мазмұны. Курс бойынша оқылатын машиналардың жалпы жіктемесі
Пәннің жалпылай мазмұны. Курс бойынша оқылатын машиналардың жалпы жіктемесі Свойства касательной
Свойства касательной Красноярская ГЭС
Красноярская ГЭС Создание кукольного театра в группе продлённого дня.
Создание кукольного театра в группе продлённого дня. 8 Марта
8 Марта Серебро. Текущая динамика и перспективы на 2021 г
Серебро. Текущая динамика и перспективы на 2021 г Огюст Конт (1798-1857)
Огюст Конт (1798-1857) Депрессивные расстройства в общей соматической практике
Депрессивные расстройства в общей соматической практике Презентация Путешествие по сказкам.
Презентация Путешествие по сказкам. Развивающая игра Ассоциации
Развивающая игра Ассоциации Василь Андрійович Симоненко
Василь Андрійович Симоненко Железнодорожная транспортная система
Железнодорожная транспортная система Музыка. Жанры музыки
Музыка. Жанры музыки Роль музыки в жизни детей. Презентация
Роль музыки в жизни детей. Презентация Фотосинтез. Биосферное значение фотосинтеза
Фотосинтез. Биосферное значение фотосинтеза Фотоальбом. С Днем учителя
Фотоальбом. С Днем учителя Умеем ли мы прощать?
Умеем ли мы прощать? Изменение имён прилагательных по падежам
Изменение имён прилагательных по падежам Новый закон об образовании
Новый закон об образовании Ульяновская область. Мой родной край
Ульяновская область. Мой родной край Застосування рідких кристалів
Застосування рідких кристалів Кесарево сечение в современном акушерстве
Кесарево сечение в современном акушерстве