Содержание
- 2. Биосферное значение фотосинтеза Обеспечение постоянства содержания СО2 в воздухе. Препятствие развитию парникового эффекта. Накопление кислорода в
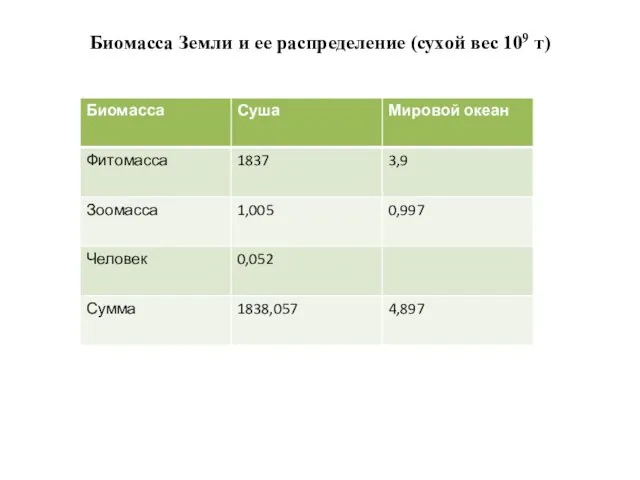
- 3. Биомасса Земли и ее распределение (сухой вес 109 т)
- 5. История развития представлений о фотосинтезе XVII в. фламандский врач Ван Гельмонт - материал, из которого образовалось
- 6. Голландский врач Ингенхауз обнаружил, что растения окисляют кислород лишь на солнечном свету и что только их
- 7. К середине 19 в. было установлено, что фотосинтез является процессом, как бы обратным дыхательному. Французский ученый
- 8. 1941 г. - американский биохимик Мелвин Калвин - процесс фотосинтеза заключается в фотолизе молекул воды, в
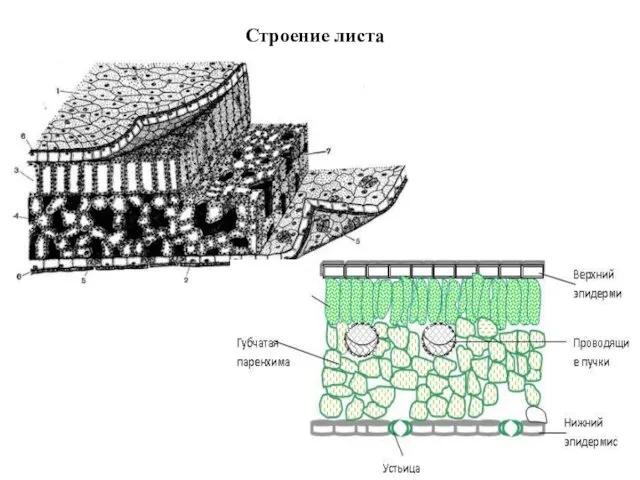
- 9. Строение листа
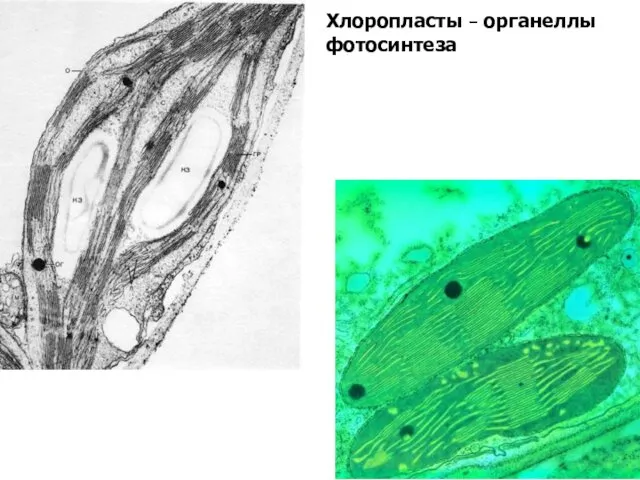
- 10. Хлоропласты – органеллы фотосинтеза
- 11. Химический состав хлоропластов (на сухую массу): белок — 35—55 %; липиды — 20—30 %; углеводы —
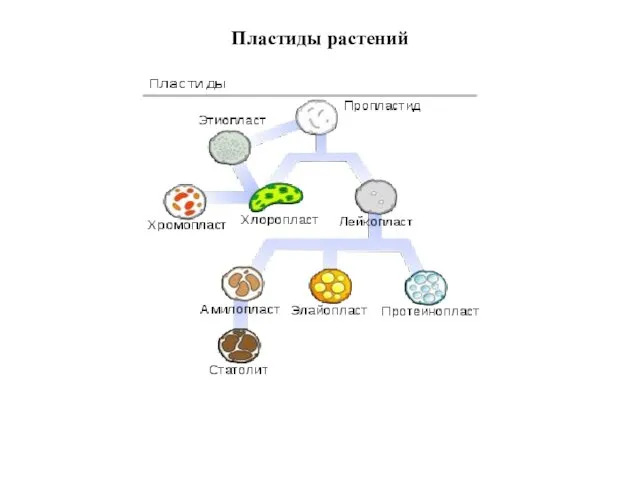
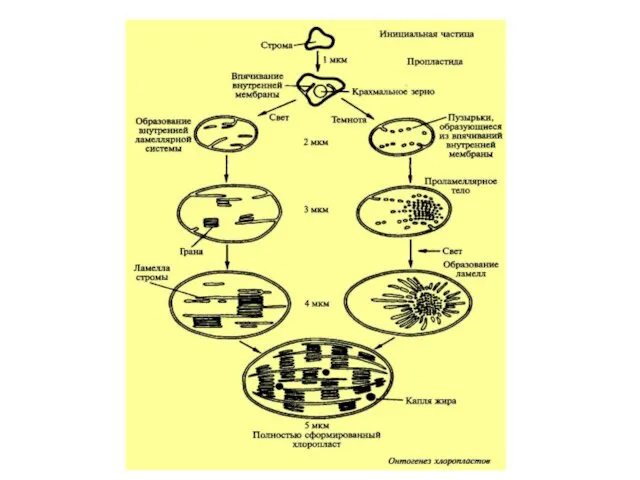
- 13. Пластиды растений
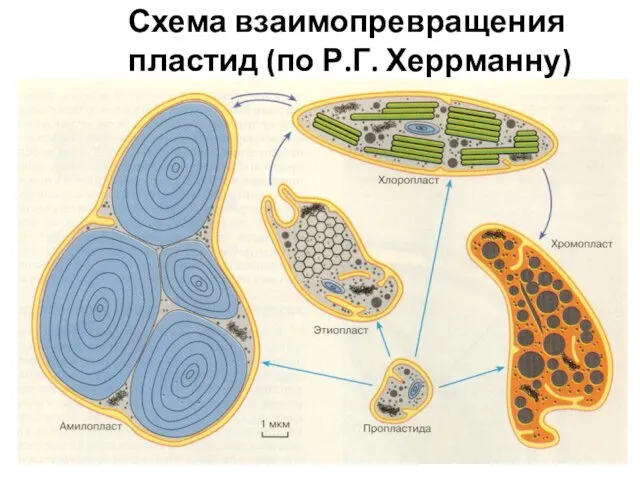
- 14. Схема взаимопревращения пластид (по Р.Г. Херрманну)
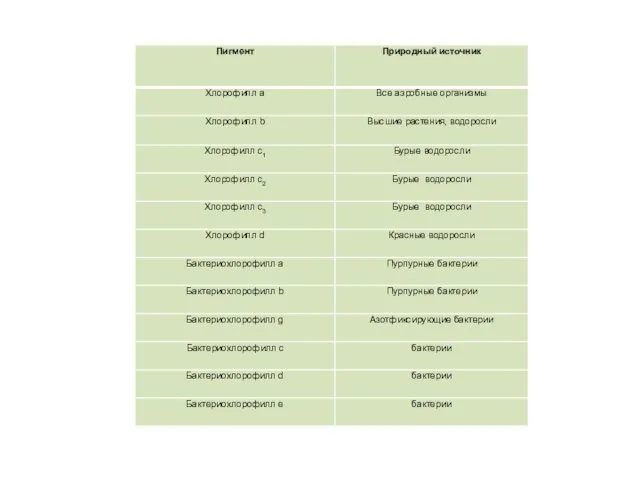
- 16. Основные классы фотосинтетических пигментов Хлорофиллы Каротиноиды Фикобилины
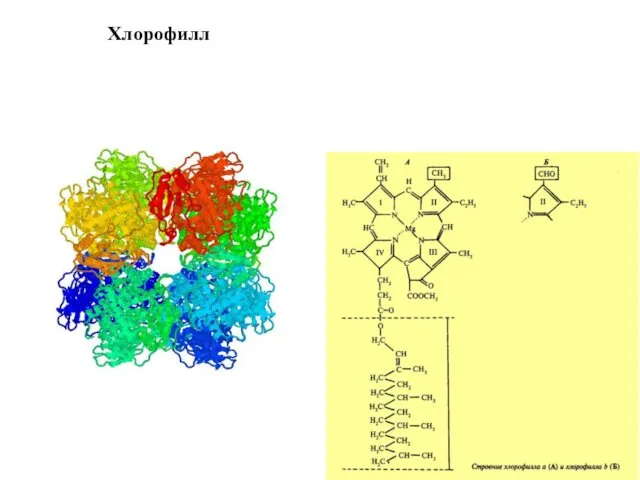
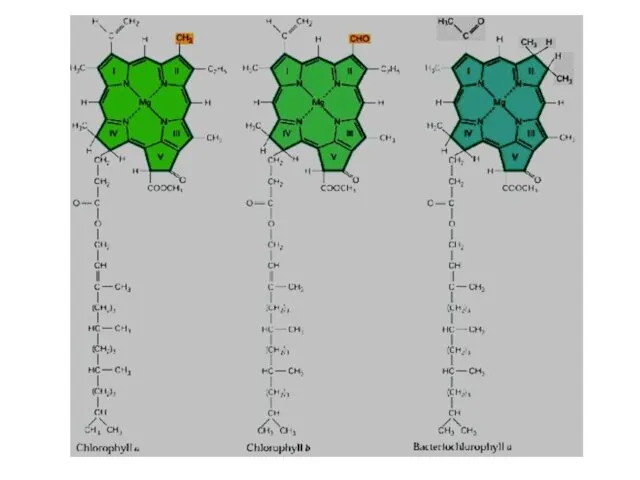
- 17. Хлорофилл
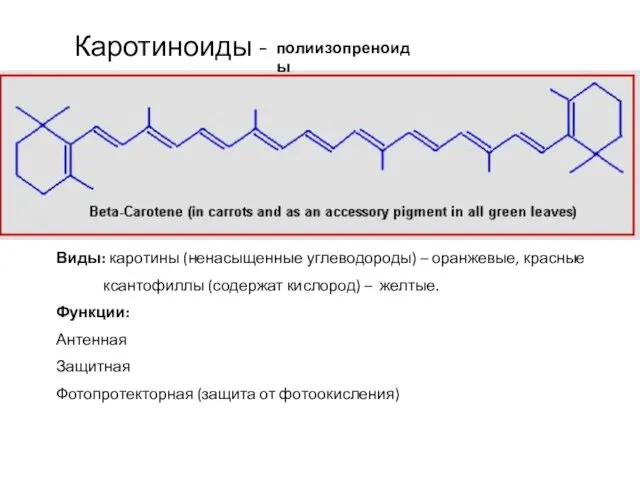
- 20. Каротиноиды - полиизопреноиды Виды: каротины (ненасыщенные углеводороды) – оранжевые, красные ксантофиллы (содержат кислород) – желтые. Функции:
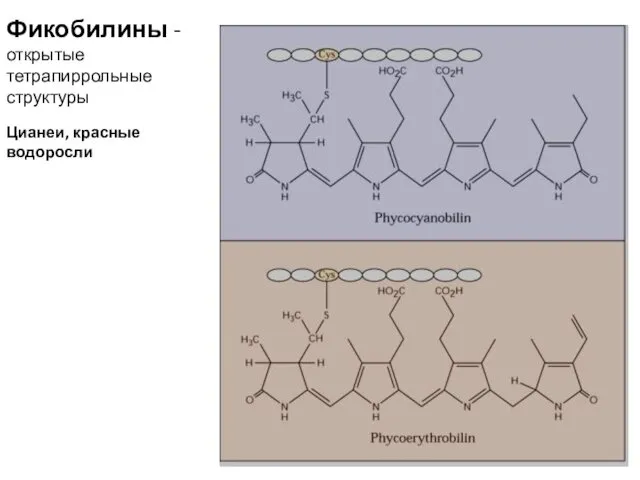
- 21. Фикобилины - открытые тетрапиррольные структуры Цианеи, красные водоросли
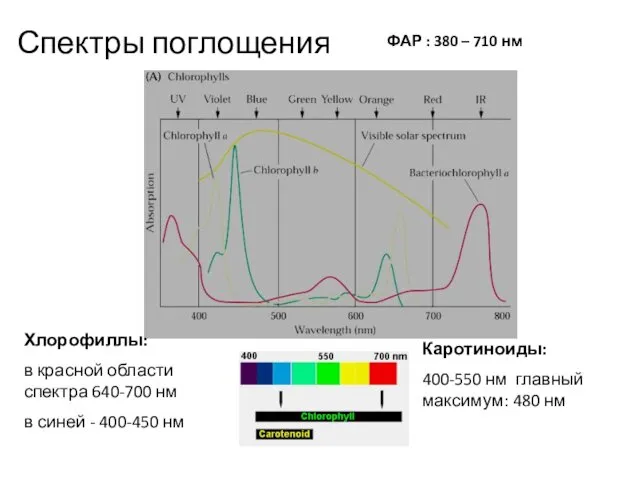
- 22. Спектры поглощения ФАР : 380 – 710 нм Каротиноиды: 400-550 нм главный максимум: 480 нм Хлорофиллы:
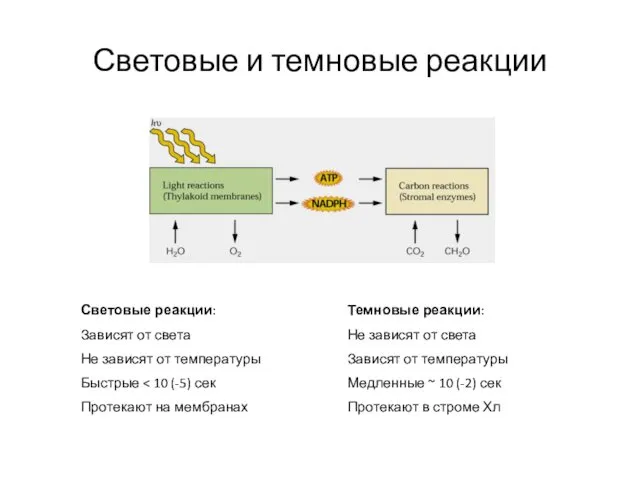
- 23. Световые и темновые реакции Световые реакции: Зависят от света Не зависят от температуры Быстрые Протекают на
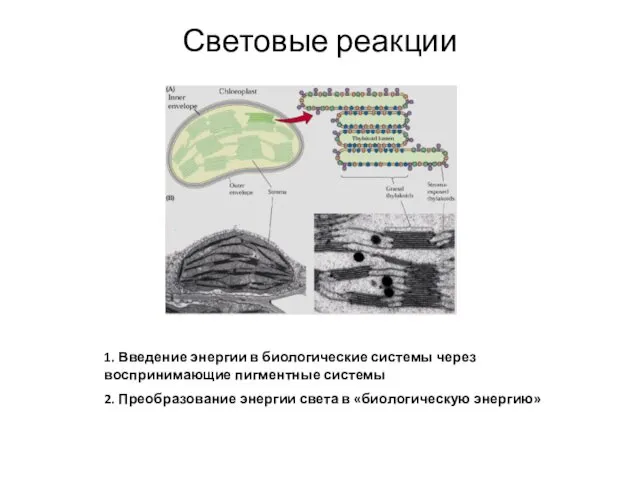
- 24. Световые реакции 1. Введение энергии в биологические системы через воспринимающие пигментные системы 2. Преобразование энергии света
- 25. Хлорофилл способен к окислительно-восстановительным превращениям «реакция Красновского» 1 – флуоресценция 2 – миграция энергии 3 –
- 26. Фотосистема (ФС): антенный комплекс (светособирающий комплекс); фотохимический реакционный центр – хлорофилл-белковый комплекс (димер Хл а 680
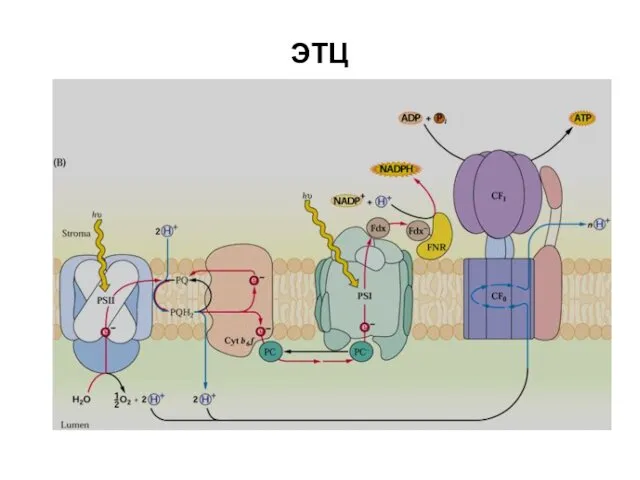
- 28. ЭТЦ
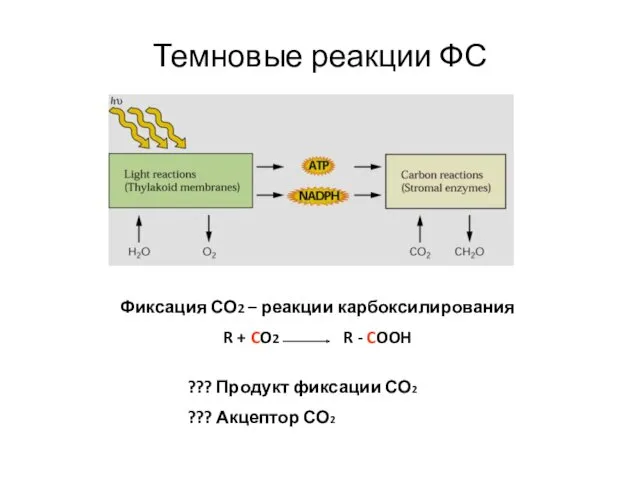
- 32. Темновые реакции ФС Фиксация СО2 – реакции карбоксилирования R + CO2 R - COOH ??? Продукт
- 33. Лоуренсовская лаборатория (Калифорния, США) 1946 – 1956 Мелвин Кальвин Объект: Chlorella Методы: С(14), P(32), Двумерная хроматография
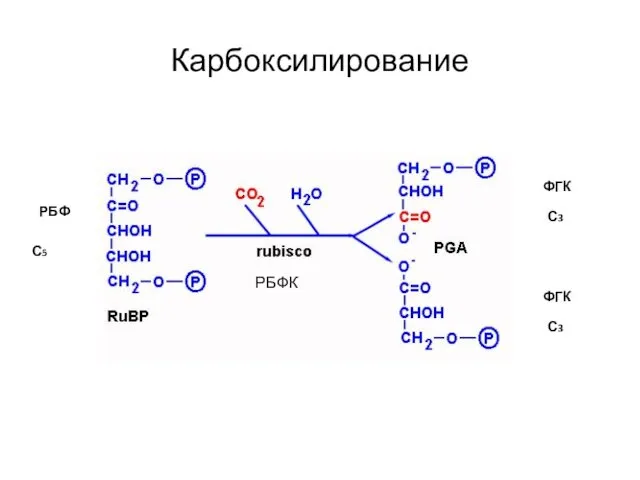
- 34. Карбоксилирование ФГК РБФ ФГК С5 С3 С3 РБФК
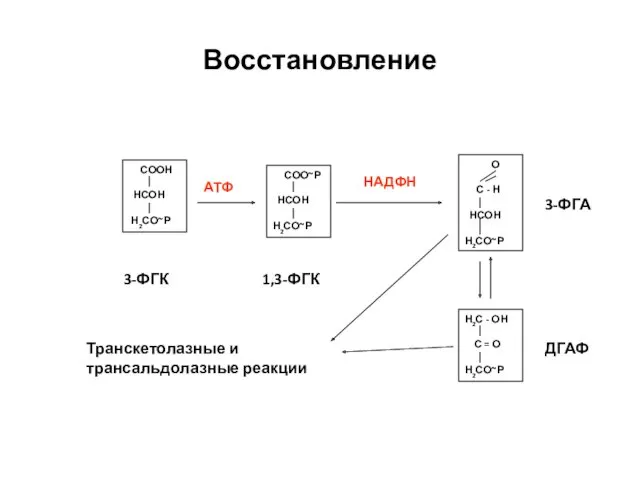
- 35. Восстановление СООН НСОН Н2СО~Р СОО~Р НСОН Н2СО~Р О С - Н НСОН Н2СО~Р АТФ НАДФН Н2С
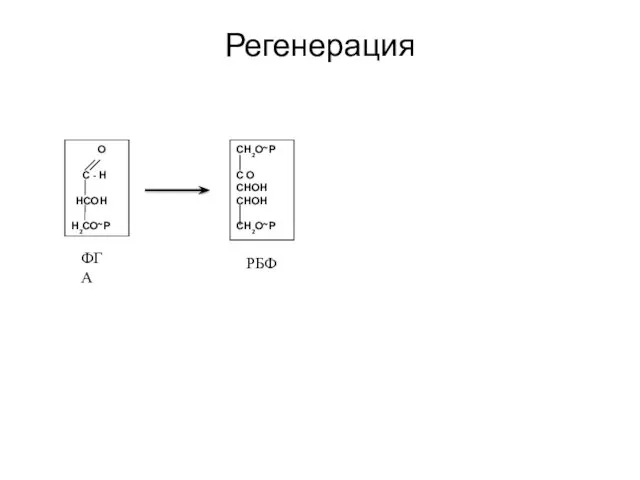
- 36. Регенерация О С - Н НСОН Н2СО~Р ФГА СН2О~Р С О СНОН СНОН СН2О~Р РБФ
- 38. РБФК (Рубиско) Optimum pH = 7,8 – 8,0 (рН стромы на свету) Субстраты: СО2 и РБФ
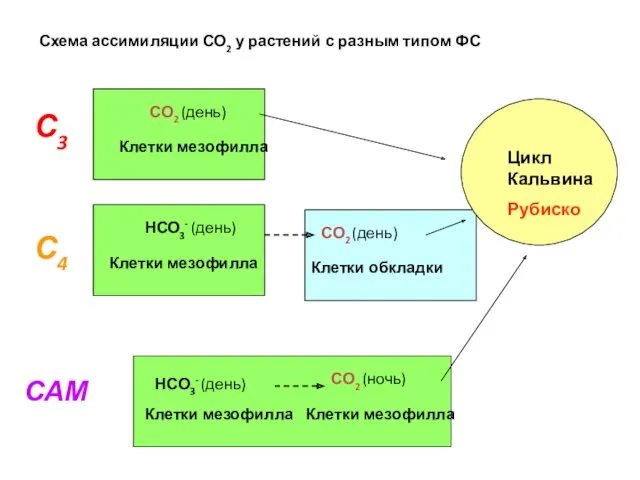
- 39. Цикл Хэтча – Слэка - Карпилова Незговорова Л.А. 1956 – 1957 Карпилов Ю.С. (кукуруза) 1960 Тарчевский
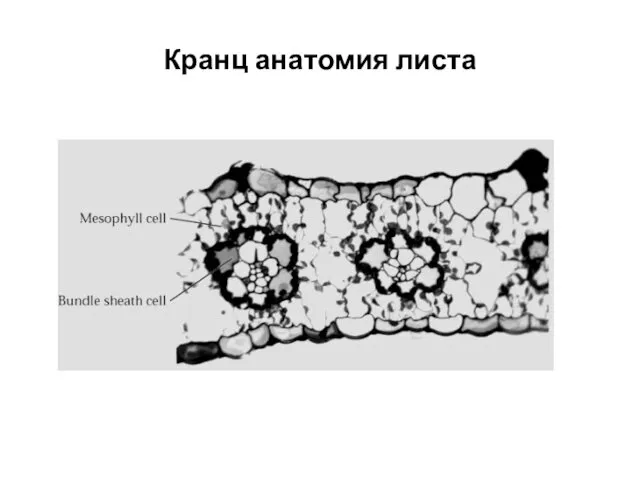
- 40. Кранц анатомия листа
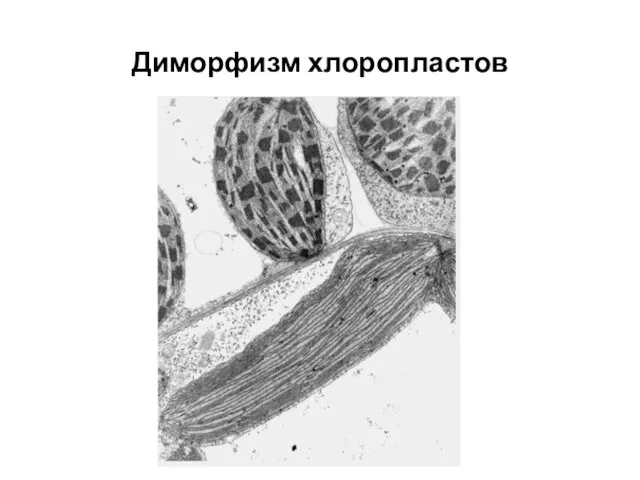
- 41. Диморфизм хлоропластов
- 42. С4 растения различаются по способам декарбоксилирования Карбоксилирование у всех одинаково: в цитозоле клеток мезофилла ФЕПК -
- 43. ФЕПК Локализована в цитозоле кл. мезофилла Субстрат НСО3 Оптимум рН = 8 Не ингибируется О2 Аллостерическая
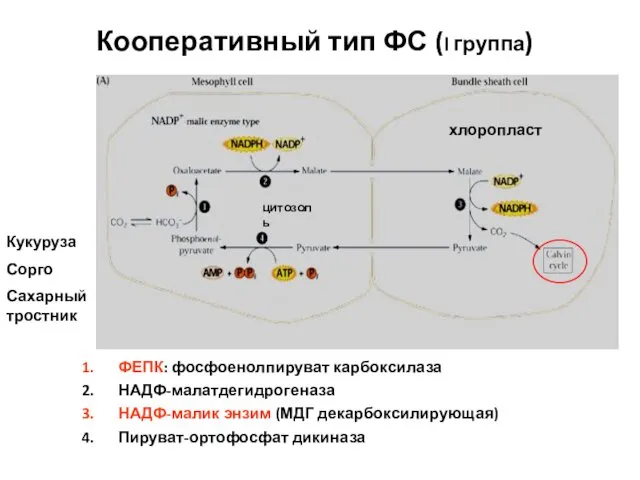
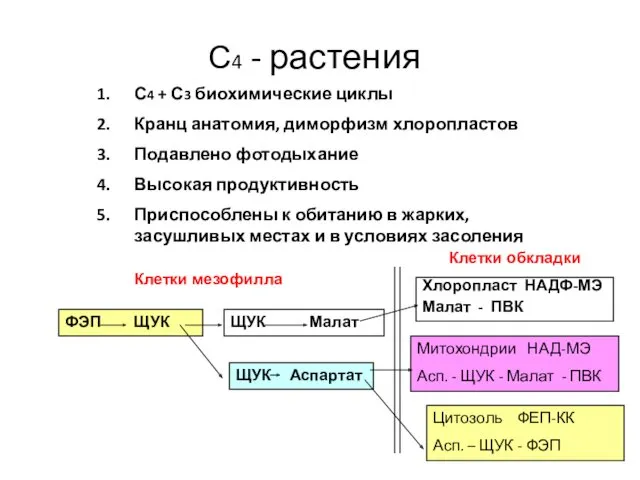
- 44. Кооперативный тип ФС (I группа) ФЕПК: фосфоенолпируват карбоксилаза НАДФ-малатдегидрогеназа НАДФ-малик энзим (МДГ декарбоксилирующая) Пируват-ортофосфат дикиназа Кукуруза
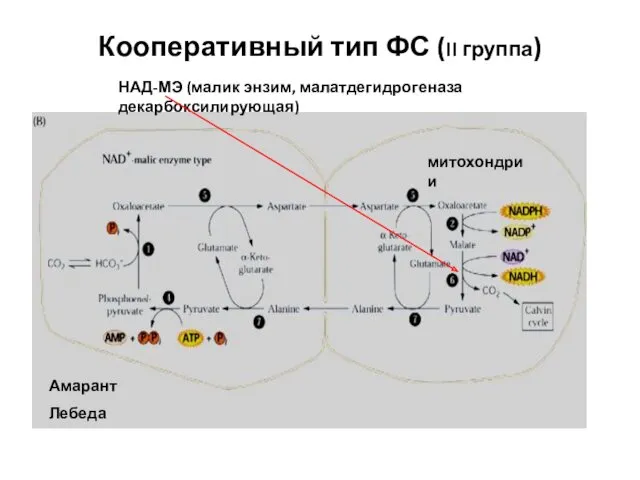
- 45. Кооперативный тип ФС (II группа) Амарант Лебеда митохондрии НАД-МЭ (малик энзим, малатдегидрогеназа декарбоксилирующая)
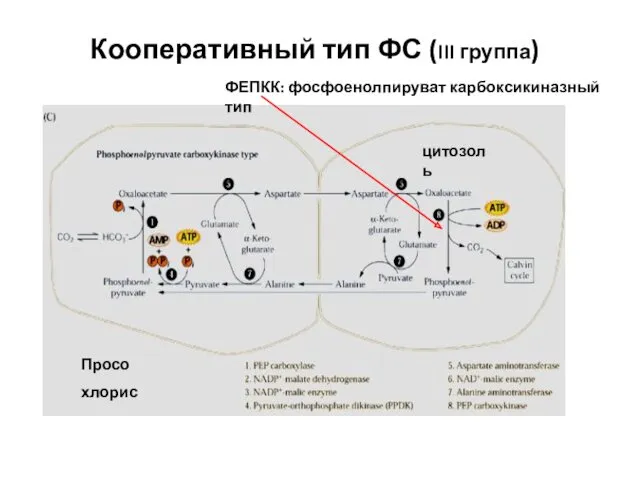
- 46. Кооперативный тип ФС (III группа) Просо хлорис ФЕПКК: фосфоенолпируват карбоксикиназный тип цитозоль
- 47. Кооперативный тип фотосинтеза ! Морфологические особенности ! Биохимические особенности Фермент декарбоксилирования НАДФ-МЭ НАД-МЭ ФЕП-КК Продукт фиксации
- 48. С4 - растения С4 + С3 биохимические циклы Кранц анатомия, диморфизм хлоропластов Подавлено фотодыхание Высокая продуктивность
- 49. Злаки: 3 типа кранц анатомии, 3 энзиматические группы Маревые: 4 типа кранц анатомии, 3 энзиматические группы
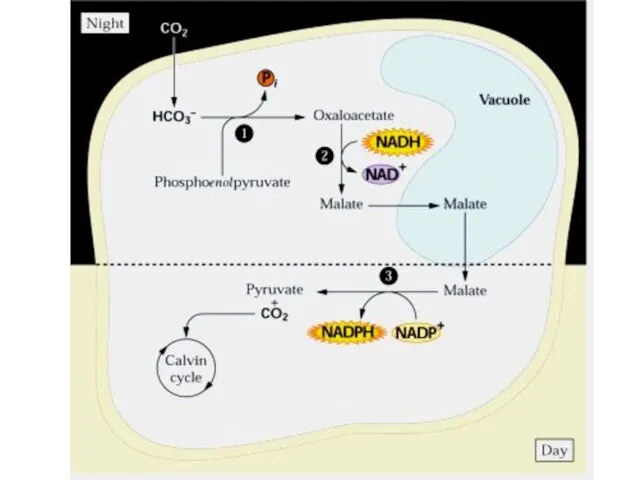
- 50. САМ (Сrassulaceae Acid Metabolism) особый тип фотосинтеза Характерен для суккулентов (каланхоэ, очитки, толстянковые, агавовые, бромелиевые, орхидные,
- 52. САМ С3 С4 СО2 (день) НСО3- (день) СО2 (ночь) Клетки мезофилла Клетки мезофилла Клетки обкладки Цикл
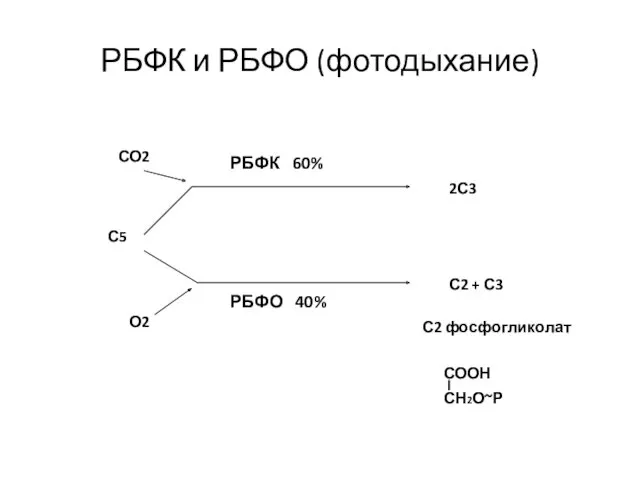
- 53. РБФК и РБФО (фотодыхание) С5 СО2 О2 2С3 С2 + С3 РБФК 60% РБФО 40% С2
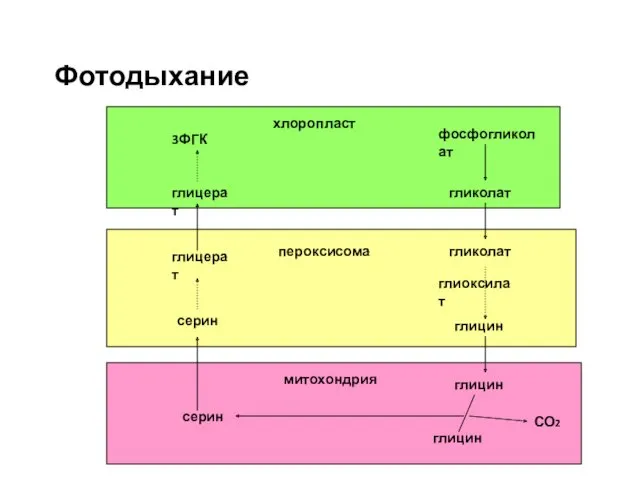
- 54. Фотодыхание фосфогликолат гликолат глиоксилат гликолат глицин глицин глицин серин СО2 серин глицерат глицерат 3ФГК хлоропласт пероксисома
- 55. Зависимость интенсивности ФС от факторов среды Интенсивность света Концентрация СО2 Температура
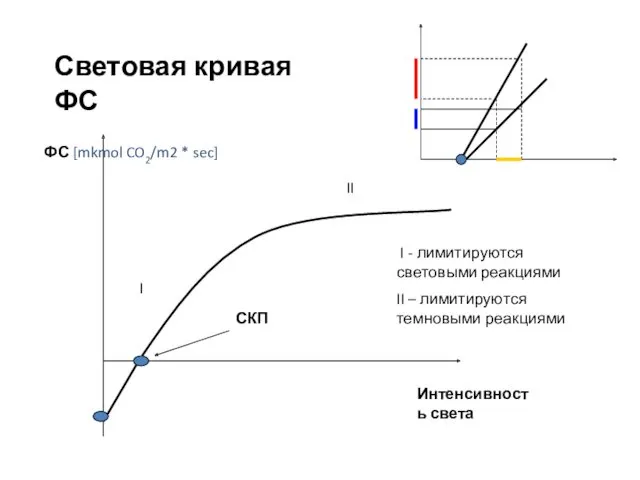
- 56. Световая кривая ФС Интенсивность света II I СКП I - лимитируются световыми реакциями II – лимитируются
- 58. Скачать презентацию

























 Либеральные реформы 60—70-х гг. XIX в
Либеральные реформы 60—70-х гг. XIX в Планеты Меркурий, Венера, Марс
Планеты Меркурий, Венера, Марс ПАО Распадская, единый производственно-территориальный комплекс по добыче и обогащению угля
ПАО Распадская, единый производственно-территориальный комплекс по добыче и обогащению угля Современное изобразительное искусство
Современное изобразительное искусство Производство сложных минеральных удобрений. Осветление АКВ, кристаллизация ТГНК, аммонизация АФР
Производство сложных минеральных удобрений. Осветление АКВ, кристаллизация ТГНК, аммонизация АФР Осушительная мелиорация
Осушительная мелиорация Сварочный термический цикл. Напряжения и деформации при сварке
Сварочный термический цикл. Напряжения и деформации при сварке Предложение по формату концепций развлекательной части для командообразующего мероприятия
Предложение по формату концепций развлекательной части для командообразующего мероприятия Pobeda
Pobeda Презентация к уроку полимеры
Презентация к уроку полимеры Блокированный дом на 2 семьи
Блокированный дом на 2 семьи Закономерности, принципы и методы управления персоналом
Закономерности, принципы и методы управления персоналом Асимметричность информации и отношения принципал-агент
Асимметричность информации и отношения принципал-агент Сергей Есенин (1895-1925)
Сергей Есенин (1895-1925) Дети с ОНР.
Дети с ОНР. Проект Огород на подоконнике
Проект Огород на подоконнике Дослідження складу шламів гальванічних виробництв та розробка методу утилізації їх у виробництві склоподібних виробів
Дослідження складу шламів гальванічних виробництв та розробка методу утилізації їх у виробництві склоподібних виробів Презентация по лексической теме Почта
Презентация по лексической теме Почта Братские могилы, обелиски и воинские захоронения времён ВОВ на территории с.п. Дубовецкий сельсовет Липецкой области
Братские могилы, обелиски и воинские захоронения времён ВОВ на территории с.п. Дубовецкий сельсовет Липецкой области Инновации водного транспорта
Инновации водного транспорта Презентация Автоматизация звука Л в слогах
Презентация Автоматизация звука Л в слогах Дифракция. Виды волн
Дифракция. Виды волн Мультимедийная презентация-игра В царстве Снежной королевы к логопедическому занятию Развитие фонетико-фонематических процессов на материале слов различной звукослоговой структуры.
Мультимедийная презентация-игра В царстве Снежной королевы к логопедическому занятию Развитие фонетико-фонематических процессов на материале слов различной звукослоговой структуры. ШАБЛОН ДЛЯ ПРЕЗ
ШАБЛОН ДЛЯ ПРЕЗ Admissions statistics on undergraduate programs
Admissions statistics on undergraduate programs Цифровая трансформация строительных организаций
Цифровая трансформация строительных организаций Синдром поражения плевры
Синдром поражения плевры Презентация ко дню космонавтики
Презентация ко дню космонавтики