Слайд 2

Амины
Производные аммиака, в молекулах которых атомы водорода замещены на углеводородный радикал.
В
зависимости от количества радикалов, связанных с атомом азота, различают амины
первичные вторичные третичные
Слайд 3

Физические свойства
Метиламины – газы, хорошо растворимые в воде.
Другие амины – жидкости
с неприятным запахом (аммиачный запах).
Высшие амины – твердые вещества, без запаха, нерастворимы в воде.
Амины являются очень токсичными веществами. Опасно как вдыхание их паров, так и контакт с кожей.
Алифатические амины поражают нервную систему, вызывают нарушения проницаемости стенок кровеносных сосудов и клеточных мембран, функций печени и развитие дистрофии.
Ароматические амины вызывают образование метгемоглобина, угнетающего центральную нервную систему.
Слайд 4

Химические свойства
Основные свойства. Образование солей.
Не поделённая электронная пара на атоме азота
определяет основные свойства аминов.
Слайд 5

1. Основные свойства. Образование солей
Алифатические радикалы увеличивают основные свойства аминов, ароматические
радикалы их уменьшают:
Слайд 6
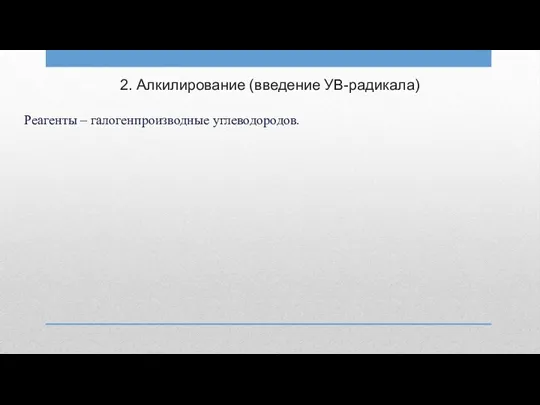
2. Алкилирование (введение УВ-радикала)
Реагенты – галогенпроизводные углеводородов.
Слайд 7
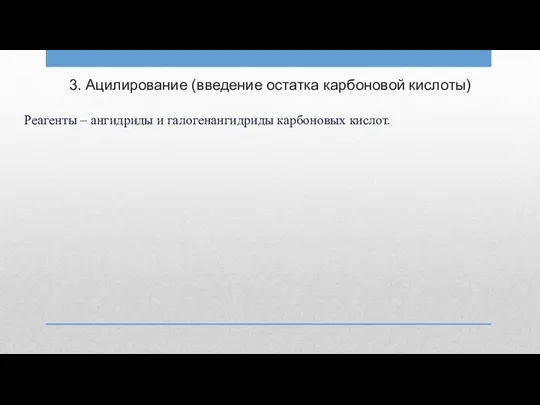
3. Ацилирование (введение остатка карбоновой кислоты)
Реагенты – ангидриды и галогенангидриды карбоновых
кислот.
Слайд 8

4. Взаимодействие с азотистой кислотой HNO2
Позволяет различить первичные, вторичные и третичные
амины.
а) Первичные амины образуют первичные спирты:
Слайд 9

4. Взаимодействие с азотистой кислотой HNO2
б) Вторичные амины образуют нитрозамины:
в) Третичные
амины без нагрева не взаимодействуют.
Слайд 10
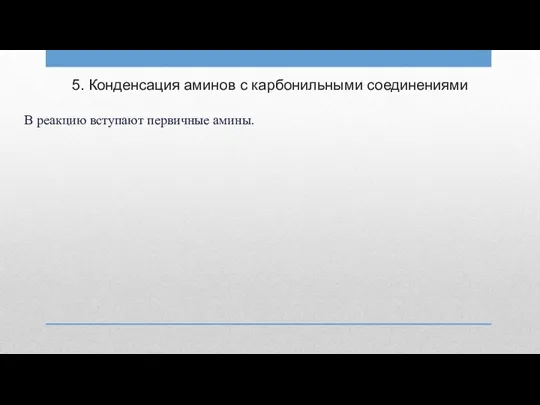
5. Конденсация аминов с карбонильными соединениями
В реакцию вступают первичные амины.
Слайд 11
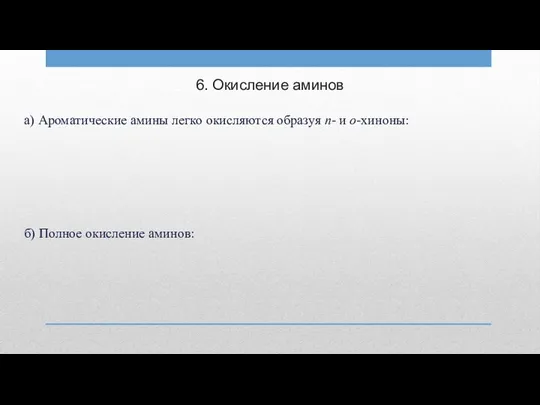
6. Окисление аминов
а) Ароматические амины легко окисляются образуя п- и о-хиноны:
б)
Полное окисление аминов:
Слайд 12

Получение аминов
Восстановление нитросоединений (реакция Зинина)
* Способ используют для получения ароматических аминов.
Слайд 13

Получение аминов
Аминирование спиртов – взаимодействие паров спирта с аммиаком (Т=300ºС)
*
Образуется смесь аминов (первичных, вторичных и третичных с преобладанием первичных). Смесь разделяют перегонкой.












 Организация глобальных сетей
Организация глобальных сетей Северный полюс. Кто первый?
Северный полюс. Кто первый? родительское собрание (презентация)
родительское собрание (презентация) Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Особенности и проблемы информирования в СМИ о воздушно-спортивном эквилибре
Особенности и проблемы информирования в СМИ о воздушно-спортивном эквилибре Документация на строительство скважины. Лекция 19
Документация на строительство скважины. Лекция 19 Классификация грузовых автомобилей. Урок № 3.1
Классификация грузовых автомобилей. Урок № 3.1 Ветер. Общие закономерности
Ветер. Общие закономерности Массивы в Java
Массивы в Java Как помочь детям стать внимательнее
Как помочь детям стать внимательнее Перспективы развития микропроцессоров
Перспективы развития микропроцессоров Инженерные коммуникации в доме
Инженерные коммуникации в доме Родительское собрание для будущих первоклассников.
Родительское собрание для будущих первоклассников. презентация Пустыни Африки
презентация Пустыни Африки метод проектной деятельности в доу
метод проектной деятельности в доу Основы рационального питания.
Основы рационального питания. Методы воспитания. Классификация методов воспитания по Гришину
Методы воспитания. Классификация методов воспитания по Гришину Компания Лего
Компания Лего Набір ювелірних каблучок Сонячний вітер
Набір ювелірних каблучок Сонячний вітер تابع الفصل الثالث برنامج العروض التقديمية
تابع الفصل الثالث برنامج العروض التقديمية Компьютерная графика для строителей
Компьютерная графика для строителей Лазеры. (Лекция 7б)
Лазеры. (Лекция 7б) Презентация урока по математике 6 класс по теме: Случайные события. Вероятность случайного события
Презентация урока по математике 6 класс по теме: Случайные события. Вероятность случайного события Презентация к созданию электронного портфолио
Презентация к созданию электронного портфолио Житие преподобного Сергия Радонежского (в стихах)
Житие преподобного Сергия Радонежского (в стихах) Числовые последовательности
Числовые последовательности Документы для внутренней и внешней общественности
Документы для внутренней и внешней общественности Исследовательская работа Картофель - второй хлеб
Исследовательская работа Картофель - второй хлеб