Содержание
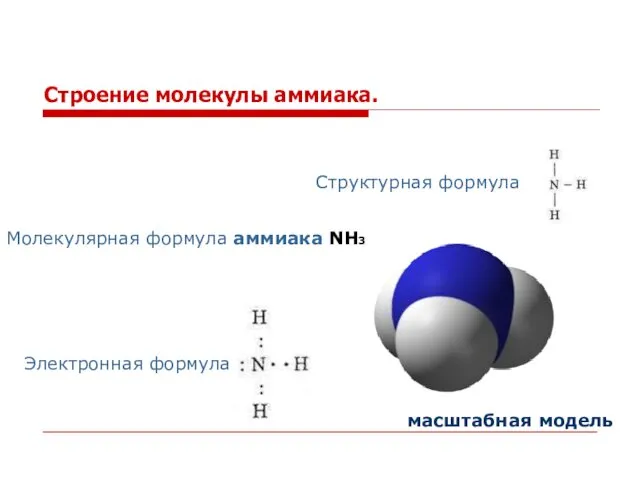
- 2. Строение молекулы аммиака. Молекулярная формула аммиака NH3 Электронная формула Структурная формула масштабная модель
- 3. Атом азота связан с атомами водорода ковалентной полярной связью. Общие электронные пары частично смещены к атому
- 4. Получение аммиака Аммиак можно получить нагреванием смеси соли ‑ хлорида аммония и гидроксида кальция. При нагревании
- 5. Газ, бесцветный, с резким характерным запахом нашатыря, легче воздуха, очень хорошо растворим в воде не горит
- 6. Химические свойства аммиака: Из простых веществ аммиак реагирует с кислородом. Аммиак на воздухе не горит! Но
- 7. Из сложных веществ аммиак реагирует При 20 градусах один объем воды поглощает до Аммиак - чемпион
- 8. с кислотами: Из сложных веществ аммиак реагирует Взаимодействие аммиака с концентрированными кислотами Аммиак NH3 взаимодействует с
- 9. Соли аммония Твердые, бесцветные, кристаллические, хорошо растворимые в воде вещества, при нагревании разлагаются. NH4Cl NH4 NO3
- 10. Химические свойства Соли аммония реагируют с солями: NH4Cl + Ag NO3 = AgCl ↓ + NH4NO3
- 11. Качественная реакция Соли аммония разлагаются щелочами: NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
- 13. Скачать презентацию









 Добро и зло. Понятие греха, раскаяния и воздаянияв курсе ОРКСЭ Диск
Добро и зло. Понятие греха, раскаяния и воздаянияв курсе ОРКСЭ Диск Талант-шоу Time of changes
Талант-шоу Time of changes Использование ИКТ в работе учителя-логопеда
Использование ИКТ в работе учителя-логопеда Публичная презентация результатов педагогической деятельности учителя химии ГБОУ СОШ № 8 ОЦ Гербик Марины Александровны
Публичная презентация результатов педагогической деятельности учителя химии ГБОУ СОШ № 8 ОЦ Гербик Марины Александровны Зачетка №2: Новые коллекции матрасов
Зачетка №2: Новые коллекции матрасов Листовая штамповка. Обтяжка
Листовая штамповка. Обтяжка Московский технологический университет. Центр дистанционного обучения. Развитие информационного общества
Московский технологический университет. Центр дистанционного обучения. Развитие информационного общества Молодёжный центр им. А.П. Чехова Ленинского района города Новосибирска. Итоги реализации программы развития
Молодёжный центр им. А.П. Чехова Ленинского района города Новосибирска. Итоги реализации программы развития Бысровозводимые дома и их разновидности
Бысровозводимые дома и их разновидности Фоторезисторы. Классификация, назначение (функция) и области применения. Параметры и их расчетные формулы
Фоторезисторы. Классификация, назначение (функция) и области применения. Параметры и их расчетные формулы Об интеграции математики и естественно- научных дисциплин в контексте концепции математического образования.
Об интеграции математики и естественно- научных дисциплин в контексте концепции математического образования. Дорога и я. Правила дорожного движения для младших школьников
Дорога и я. Правила дорожного движения для младших школьников Экономика производителя
Экономика производителя Нейропсихологические синдромы поражения конвекситальной коры височной области мозга
Нейропсихологические синдромы поражения конвекситальной коры височной области мозга Искусство Древнего мира
Искусство Древнего мира Течения
Течения Презентация по теме Осложнения ЖКБ.
Презентация по теме Осложнения ЖКБ. Химия - это просто! Живые модели.
Химия - это просто! Живые модели. 9 д
9 д Проектирование технического и организационного обеспечения ИС. Лекция 9
Проектирование технического и организационного обеспечения ИС. Лекция 9 Сценарий выпускного вечера
Сценарий выпускного вечера Буддизм
Буддизм Project Kick-Off. Tube Bender Upgrade
Project Kick-Off. Tube Bender Upgrade Проектная деятельность в 1 классе
Проектная деятельность в 1 классе Конспект урока по ОРКСЭ Диск
Конспект урока по ОРКСЭ Диск Педагогический проект по ознакомлению дошкольников с их правами
Педагогический проект по ознакомлению дошкольников с их правами Компьютер или книга - что лучше
Компьютер или книга - что лучше London
London