Содержание
- 2. Содержание Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические
- 3. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
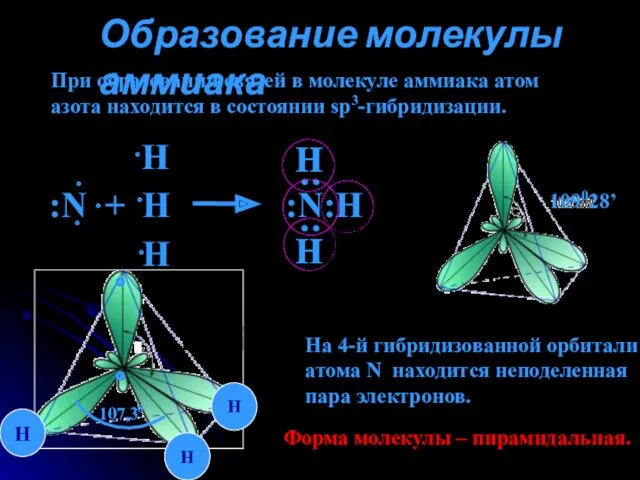
- 4. Образование молекулы аммиака При образовании связей в молекуле аммиака атом азота находится в состоянии sp3-гибридизации. 109028’
- 5. Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, молекула имеет пирамидальную форму,
- 6. Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении
- 7. Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Реакция проводится при нагревании, под давлением, в
- 8. Химические свойства аммиака NH3 – низшая степень окисления азота. -3 1. Аммиак - восстановитель Реакция горения
- 9. II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 +
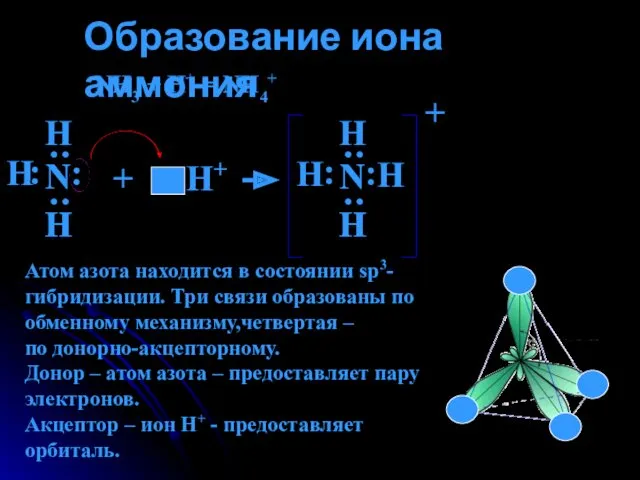
- 10. Образование иона аммония NH3 + H+ = NH4+ Н : : Н Н : : Н
- 11. Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония
- 12. Разложение солей аммония при нагревании Соли летучих кислот: NH4ClCl = Cl = NH3 + HCl (NH4)2CO3
- 14. Скачать презентацию









 Праздники народов России. 4 класс
Праздники народов России. 4 класс Александр Александрович Фадеев 1901 - 1956
Александр Александрович Фадеев 1901 - 1956 Школьный этикет. Правила поведения на уроке.
Школьный этикет. Правила поведения на уроке. Рождественская звезда . Рождение Иисуса
Рождественская звезда . Рождение Иисуса TCU (traffic control unit)
TCU (traffic control unit) Именные химические реакции в органической химии
Именные химические реакции в органической химии Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Ярослав Гашек Камень жизни
Ярослав Гашек Камень жизни Научные принципы, параметры технологии и технологическое оборудование для прямой переработки кусковой сидеритовой руды в сталь
Научные принципы, параметры технологии и технологическое оборудование для прямой переработки кусковой сидеритовой руды в сталь Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы
Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы Экономика и экология
Экономика и экология Презентация Игровые технологии в детском саду Игровые технологии в ДОУ
Презентация Игровые технологии в детском саду Игровые технологии в ДОУ Кадры предприятия. (Тема 9)
Кадры предприятия. (Тема 9) Моральное стимулирование труда персонала
Моральное стимулирование труда персонала 20190306_larina_n.p
20190306_larina_n.p Характеристика элементов III A группы. Бор и алюминий
Характеристика элементов III A группы. Бор и алюминий Использование информационно-коммуникационной технологии Игры для Тигры для коррекции общего недоразвития речи в дошкольном возрасте.
Использование информационно-коммуникационной технологии Игры для Тигры для коррекции общего недоразвития речи в дошкольном возрасте. Данные в экономике, их визуализация и предварительная обработка. Визуализация качественных признаков в Microsoft Excel
Данные в экономике, их визуализация и предварительная обработка. Визуализация качественных признаков в Microsoft Excel Бихевиоризм
Бихевиоризм Презентация по ПДД
Презентация по ПДД Пробный ЕГЭ. Вариант 1
Пробный ЕГЭ. Вариант 1 Нуклеиновые кислоты
Нуклеиновые кислоты Презентация по химии Спирты 10 класс
Презентация по химии Спирты 10 класс Секреты ораторского искусства
Секреты ораторского искусства Оперативное управление коммутационными аппаратами
Оперативное управление коммутационными аппаратами Готов ли Ваш ребенок к школе?
Готов ли Ваш ребенок к школе? Внеурочная деятельность в младшей школе как важное условие реализации деятельности ФГОС нового поколения
Внеурочная деятельность в младшей школе как важное условие реализации деятельности ФГОС нового поколения  Расставание с прошлым, дорога в светлое будущее
Расставание с прошлым, дорога в светлое будущее