Содержание
- 2. Строение атома Химические свойства Круговорот в природе Получение Фосфор в природе Фосфор в организме Белый фосфор
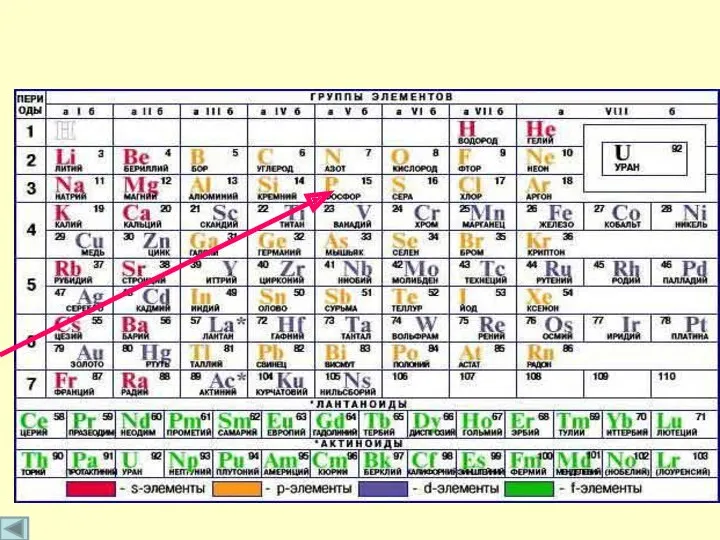
- 3. Положение фосфора в ПСХЭ
- 4. В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте
- 5. Р заряд ядра= +15 31P Электронная конфигурация: Р Р* (стационарное) (возбужденное) 1s2 2s2 2p6 3s1 3p3
- 6. Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
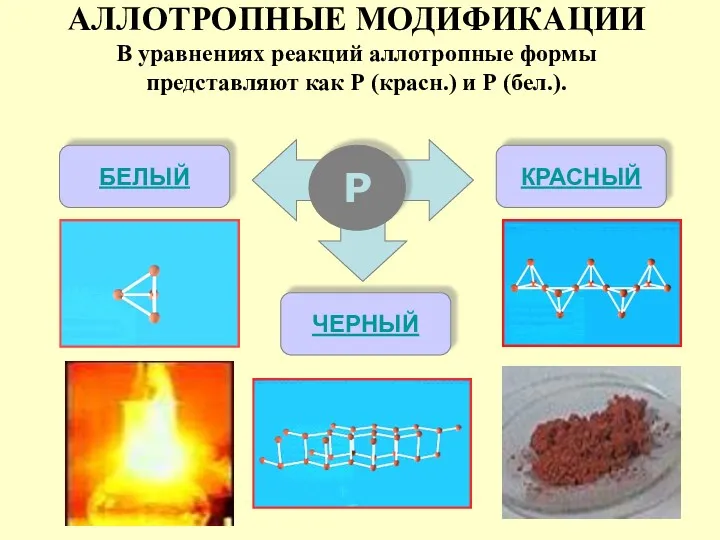
- 7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.). Р БЕЛЫЙ
- 8. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
- 9. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
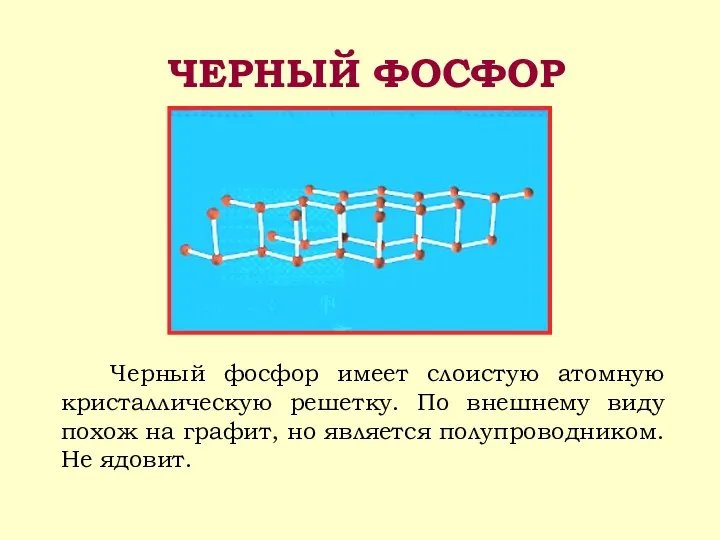
- 10. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
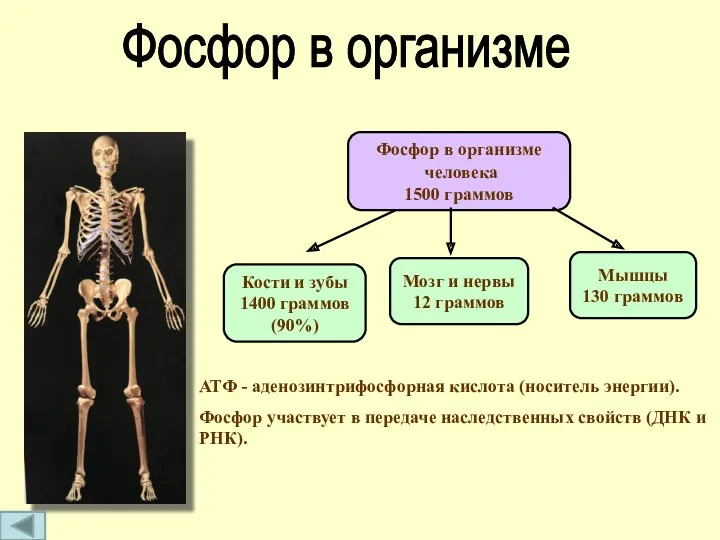
- 11. Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мышцы 130 граммов Мозг
- 12. Из апатитов и фосфоритов в электрической печи: Са3(РО4)2+5С+3SiO2 3CaSiO3+2P+5CO P+5 +5e P 2 C0 -2e C+2
- 13. Химические свойства фосфора Р0 Р-3 Р+5 окислитель восстановитель I. Фосфор – окислитель: При реакции с активными
- 14. При взаимодействии со щелочами образуется фосфин PH3: 2Р + 2NaOH + H2O = Na2HPO3 + PH3
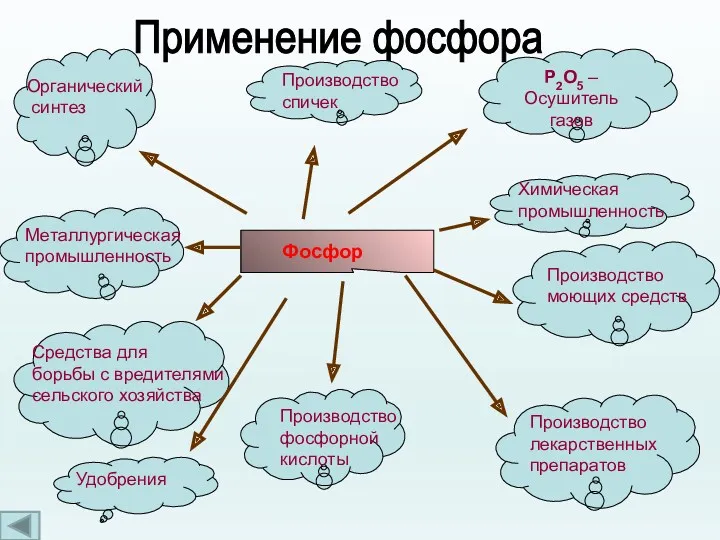
- 16. Применение фосфора Фосфор Производство спичек Р2О5 – Осушитель газов Органический синтез Химическая промышленность Металлургическая промышленность Средства
- 17. Фосфин РН3. Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула
- 19. Скачать презентацию










 IOS (Basic Input Output System) – базовая система ввода/вывода
IOS (Basic Input Output System) – базовая система ввода/вывода Уголовная ответственность несовершеннолетних
Уголовная ответственность несовершеннолетних Презентация проекта Создание книги Краткой энциклопедии правил поведения на улице для детей и взрослых
Презентация проекта Создание книги Краткой энциклопедии правил поведения на улице для детей и взрослых Железнодорожный транспорт. Организация работ по ремонту аккумуляторной батареи НК-125 при ТР-1
Железнодорожный транспорт. Организация работ по ремонту аккумуляторной батареи НК-125 при ТР-1 Визуальная диагностика дерматитов (контактно-аллергический, атопический, токсикодермический)
Визуальная диагностика дерматитов (контактно-аллергический, атопический, токсикодермический) Захар Федорович Дорофеев
Захар Федорович Дорофеев Уполномоченные по охране труда профсоюза – представители работников
Уполномоченные по охране труда профсоюза – представители работников Алкены. 10 класс
Алкены. 10 класс Человек и мир камня
Человек и мир камня Технологическое производство и методы получение белково-витаминных концентратов
Технологическое производство и методы получение белково-витаминных концентратов Персональный компьютер
Персональный компьютер Презентация к занятию по колористике Своя игра
Презентация к занятию по колористике Своя игра Динамические структуры данных
Динамические структуры данных Передача видео
Передача видео Классификация запасов и ресурсов. Методы подсчета запасов нефти и газа. Содержание отчета по подсчету запасов
Классификация запасов и ресурсов. Методы подсчета запасов нефти и газа. Содержание отчета по подсчету запасов Канфесійныя адносіны ў канцы ХVІІІ – першай палове ХІХ ст
Канфесійныя адносіны ў канцы ХVІІІ – першай палове ХІХ ст Презентация к уроку Природные источники углеводородов
Презентация к уроку Природные источники углеводородов Особливості роботи машинних сільськогосподарських агрегатів (лекция № 1)
Особливості роботи машинних сільськогосподарських агрегатів (лекция № 1) Поколения эвм
Поколения эвм Emerge BPO Introduction
Emerge BPO Introduction ТЕСТЫ ПО ГЕОГРАФИИ ДЛЯ 8 КЛАССА ПО ТЕМЕ ВНУТРЕННИЕ ВОДЫ РОССИИ
ТЕСТЫ ПО ГЕОГРАФИИ ДЛЯ 8 КЛАССА ПО ТЕМЕ ВНУТРЕННИЕ ВОДЫ РОССИИ Компания Prouve
Компания Prouve Сальвадор Дали
Сальвадор Дали Результаты выращивания форели в условиях КФХ Горное
Результаты выращивания форели в условиях КФХ Горное Молекулярная динамика. Вчера, сегодня, завтра
Молекулярная динамика. Вчера, сегодня, завтра Инструменты нанотехнологий. Сканирующая зондовая микроскопия
Инструменты нанотехнологий. Сканирующая зондовая микроскопия Фотоотчет с утренника, посвященного Международному Женскому Дню
Фотоотчет с утренника, посвященного Международному Женскому Дню Презентация
Презентация