Содержание
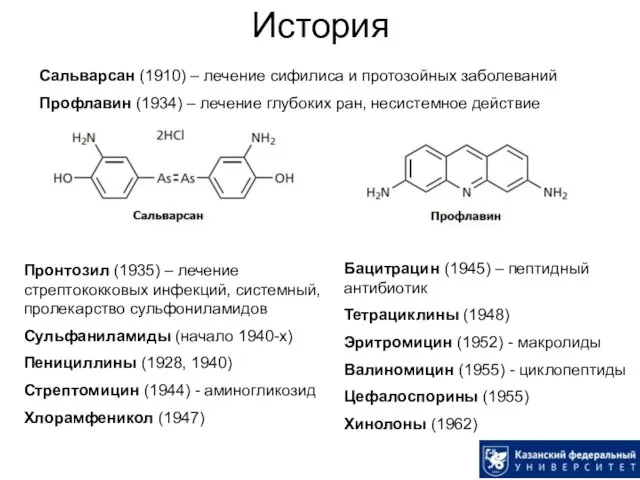
- 2. История Сальварсан (1910) – лечение сифилиса и протозойных заболеваний Профлавин (1934) – лечение глубоких ран, несистемное
- 3. Бактериальная клетка Основа селективности: бактерии – прокариоты, клетки животных - эукариоты Ключевые различия: У бактериальной клетки
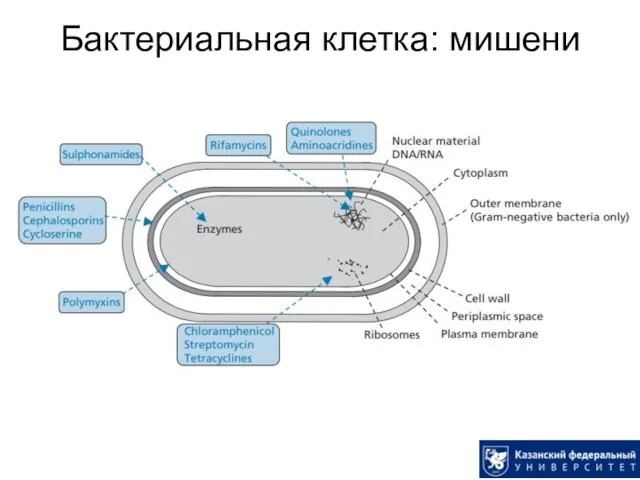
- 4. Бактериальная клетка: мишени
- 5. Ключевые механизмы действия антибактериальных лекарств Ингибирование клеточного метаболизма (антиметаболиты). Пример: сульфаниламиды. Ингибирование синтеза бактериальной клеточной стенки.
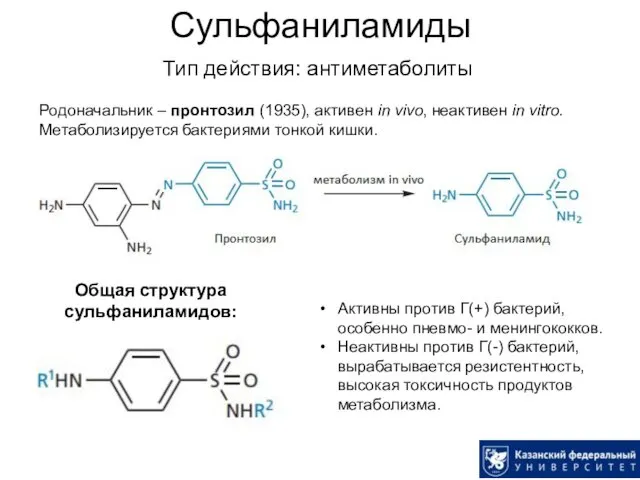
- 6. Сульфаниламиды Тип действия: антиметаболиты Родоначальник – пронтозил (1935), активен in vivo, неактивен in vitro. Метаболизируется бактериями
- 7. SAR-зависимости Пара-аминогруппа необходима для активности и должна быть незамещенной (R1 = H). R1 может быть ацильным
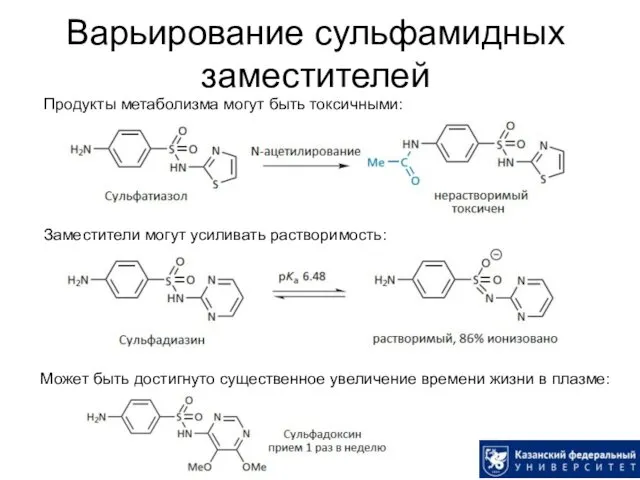
- 8. Варьирование сульфамидных заместителей Продукты метаболизма могут быть токсичными: Заместители могут усиливать растворимость: Может быть достигнуто существенное
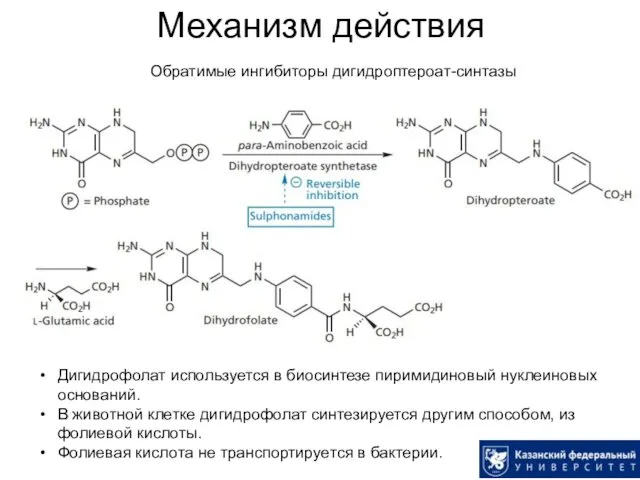
- 9. Механизм действия Обратимые ингибиторы дигидроптероат-синтазы Дигидрофолат используется в биосинтезе пиримидиновый нуклеиновых оснований. В животной клетке дигидрофолат
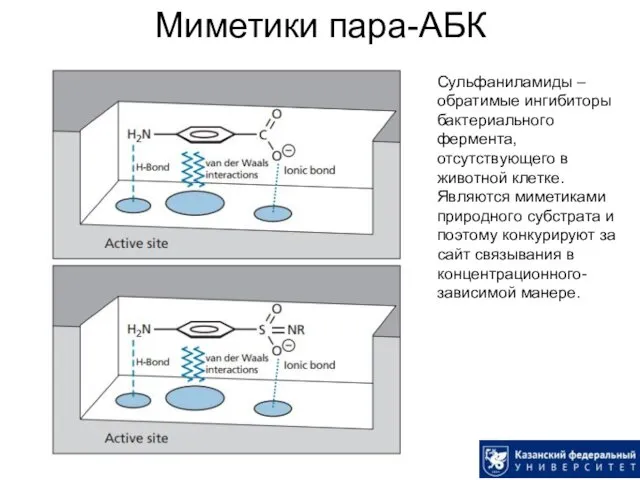
- 10. Миметики пара-АБК Сульфаниламиды – обратимые ингибиторы бактериального фермента, отсутствующего в животной клетке. Являются миметиками природного субстрата
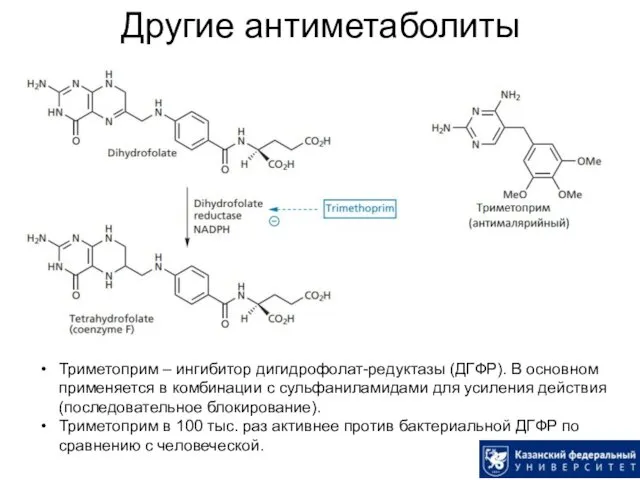
- 11. Другие антиметаболиты Триметоприм – ингибитор дигидрофолат-редуктазы (ДГФР). В основном применяется в комбинации с сульфаниламидами для усиления
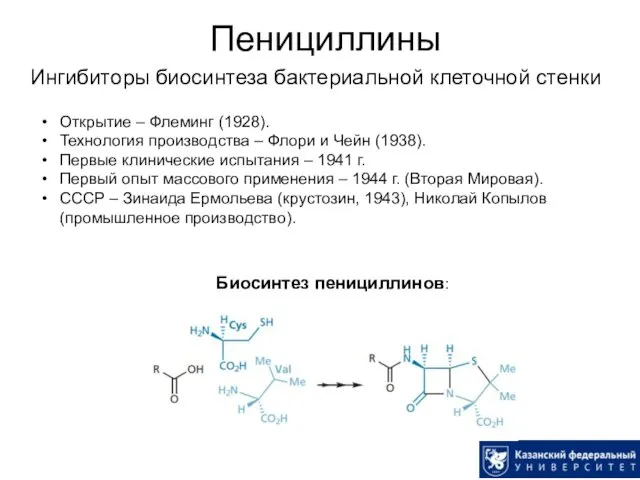
- 12. Пенициллины Ингибиторы биосинтеза бактериальной клеточной стенки Открытие – Флеминг (1928). Технология производства – Флори и Чейн
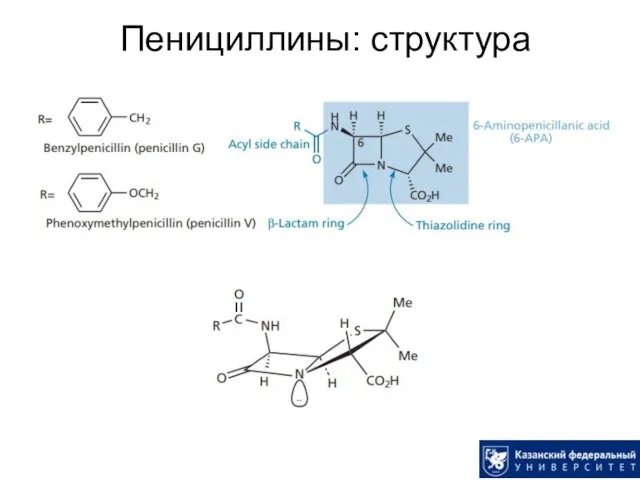
- 13. Пенициллины: структура
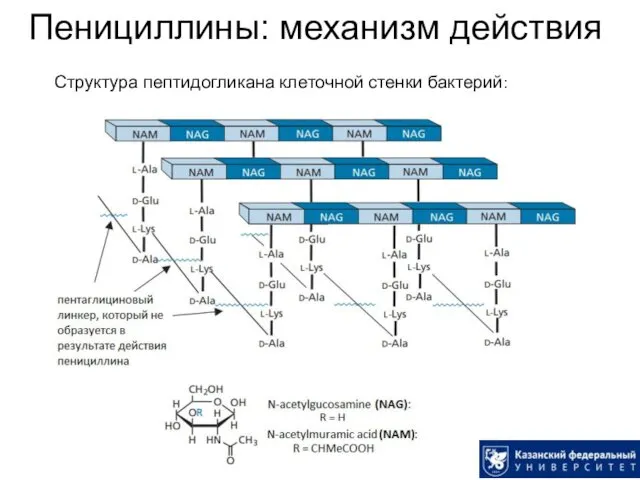
- 14. Пенициллины: механизм действия Структура пептидогликана клеточной стенки бактерий:
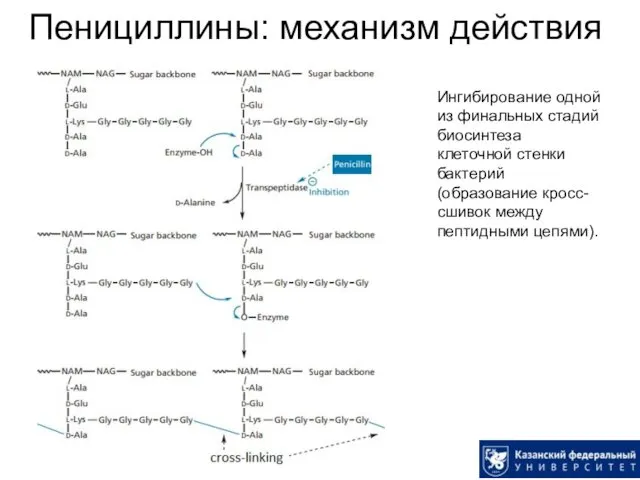
- 15. Пенициллины: механизм действия Ингибирование одной из финальных стадий биосинтеза клеточной стенки бактерий (образование кросс-сшивок между пептидными
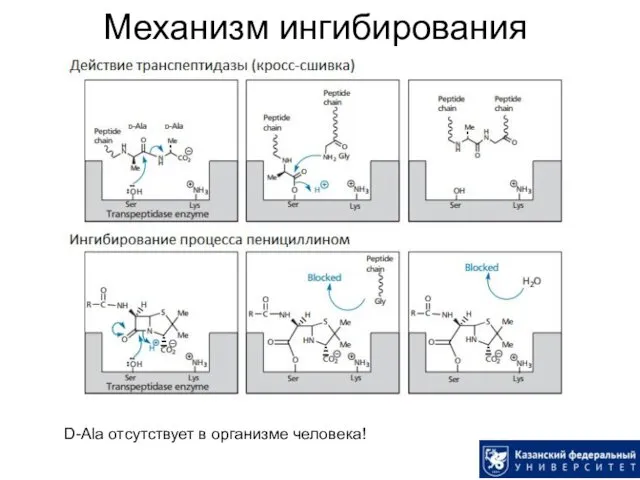
- 16. Механизм ингибирования D-Ala отсутствует в организме человека!
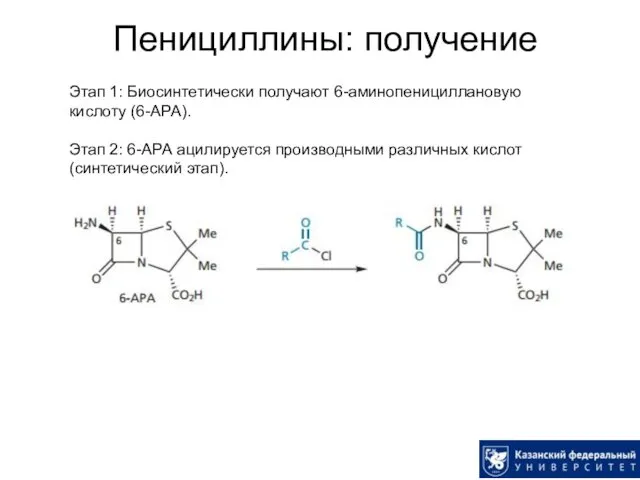
- 17. Пенициллины: получение Этап 1: Биосинтетически получают 6-аминопенициллановую кислоту (6-АРА). Этап 2: 6-АРА ацилируется производными различных кислот
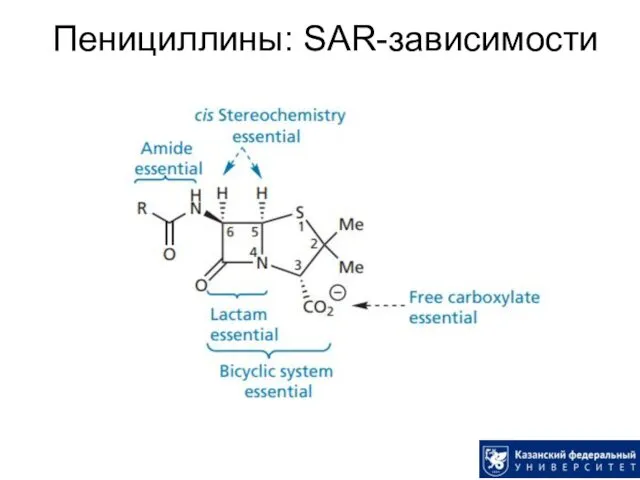
- 18. Пенициллины: SAR-зависимости
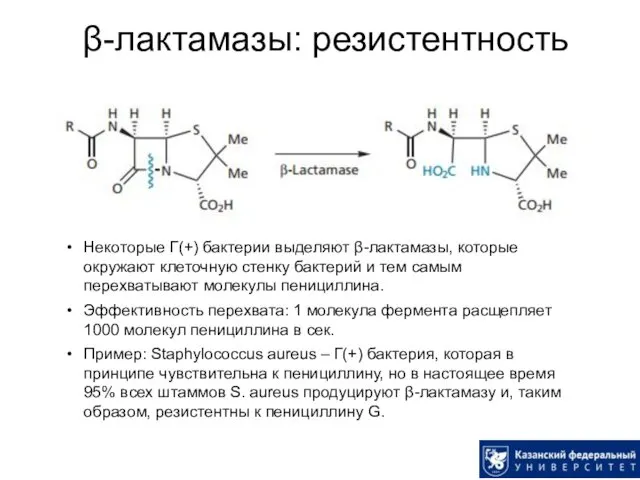
- 19. β-лактамазы: резистентность Некоторые Г(+) бактерии выделяют β-лактамазы, которые окружают клеточную стенку бактерий и тем самым перехватывают
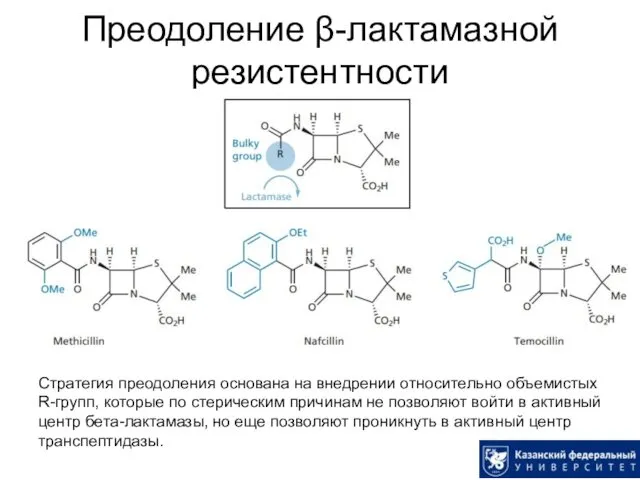
- 20. Преодоление β-лактамазной резистентности Стратегия преодоления основана на внедрении относительно объемистых R-групп, которые по стерическим причинам не
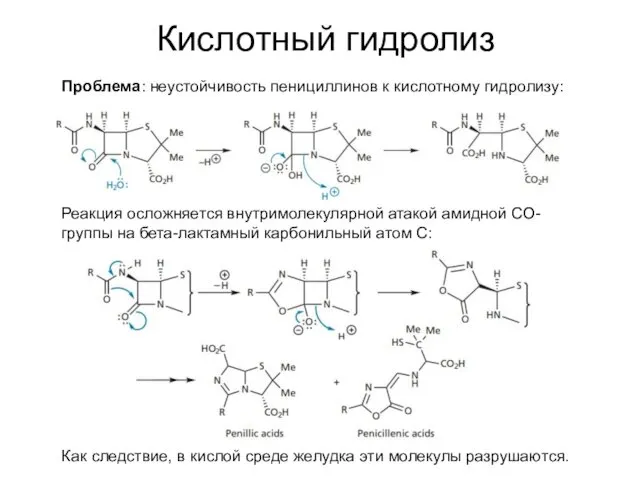
- 21. Кислотный гидролиз Проблема: неустойчивость пенициллинов к кислотному гидролизу: Как следствие, в кислой среде желудка эти молекулы
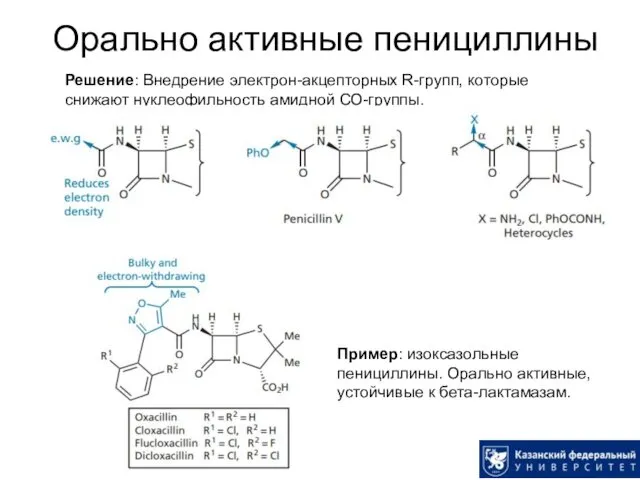
- 22. Орально активные пенициллины Решение: Внедрение электрон-акцепторных R-групп, которые снижают нуклеофильность амидной СО-группы. Пример: изоксазольные пенициллины. Орально
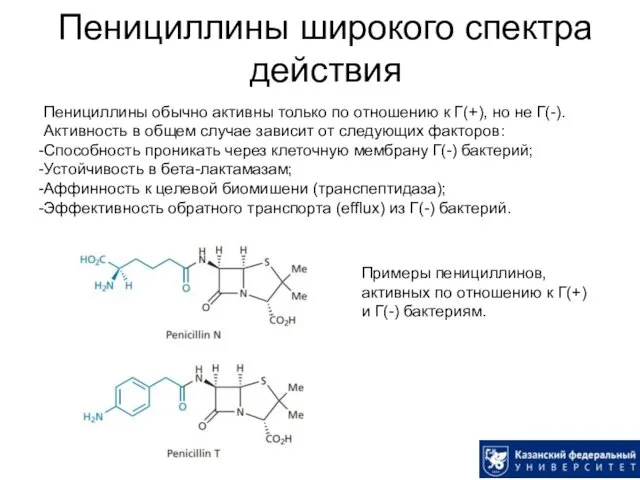
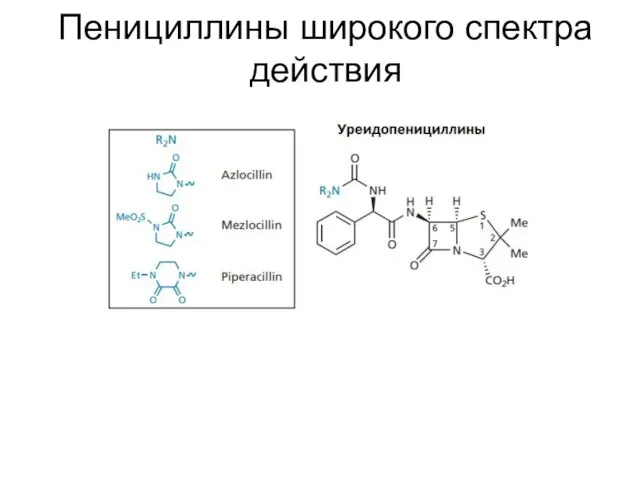
- 23. Пенициллины широкого спектра действия Пенициллины обычно активны только по отношению к Г(+), но не Г(-). Активность
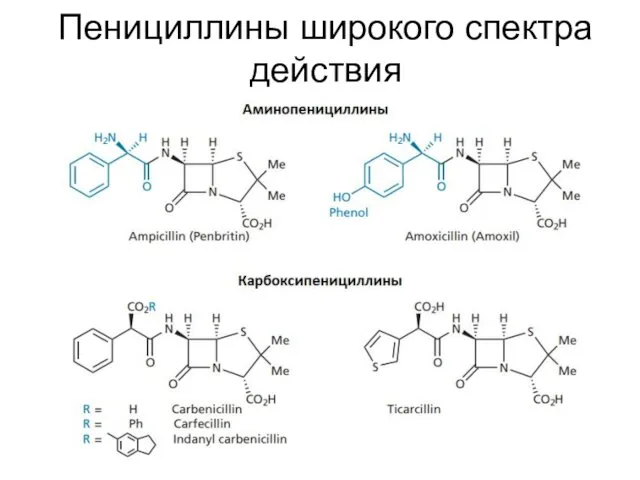
- 24. Пенициллины широкого спектра действия
- 25. Пенициллины широкого спектра действия
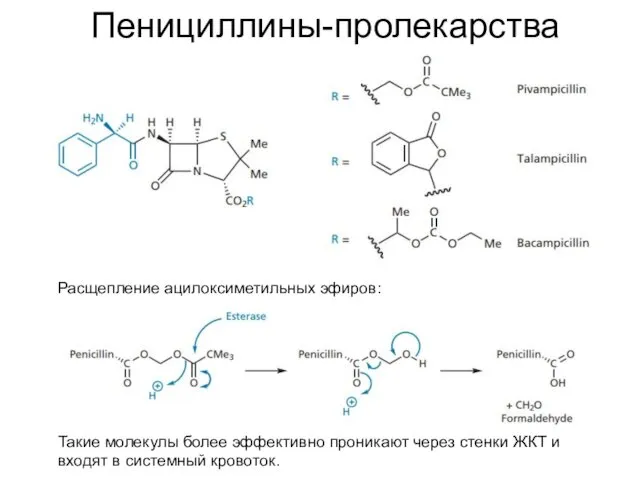
- 26. Пенициллины-пролекарства Расщепление ацилоксиметильных эфиров: Такие молекулы более эффективно проникают через стенки ЖКТ и входят в системный
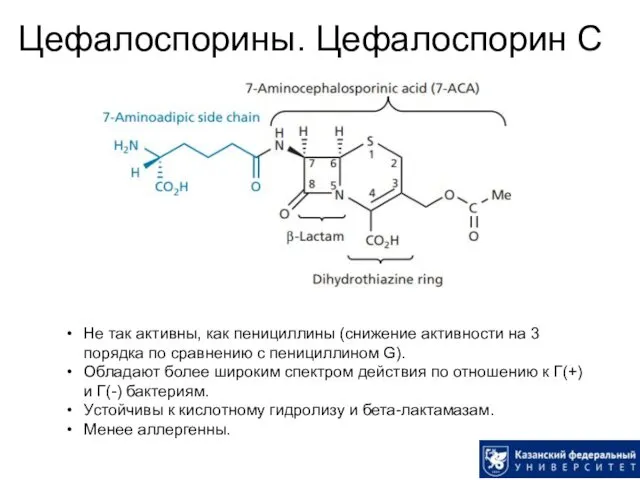
- 27. Цефалоспорины. Цефалоспорин С Не так активны, как пенициллины (снижение активности на 3 порядка по сравнению с
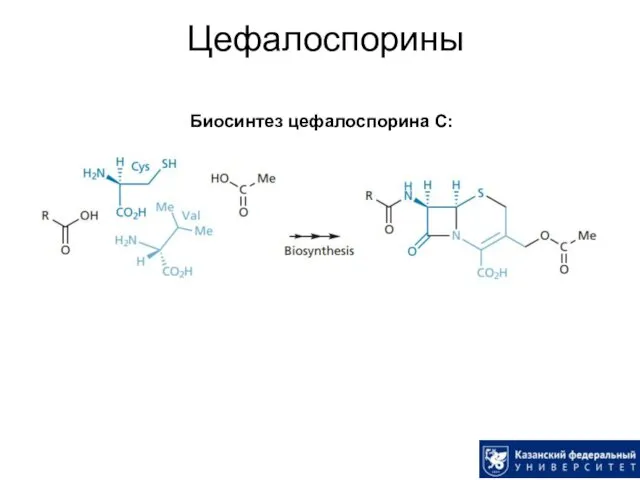
- 28. Цефалоспорины Биосинтез цефалоспорина С:
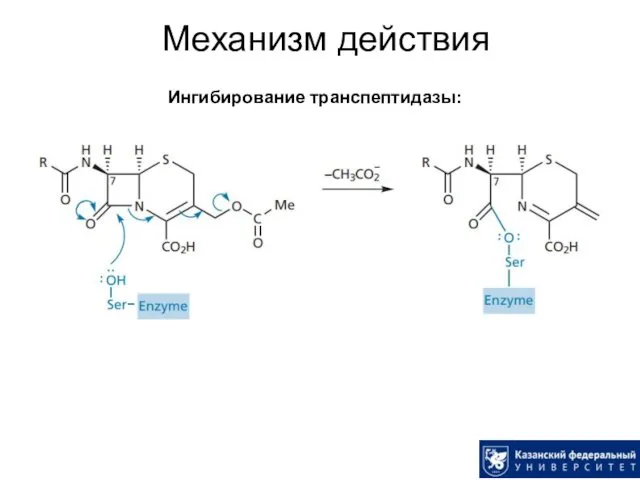
- 29. Механизм действия Ингибирование транспептидазы:
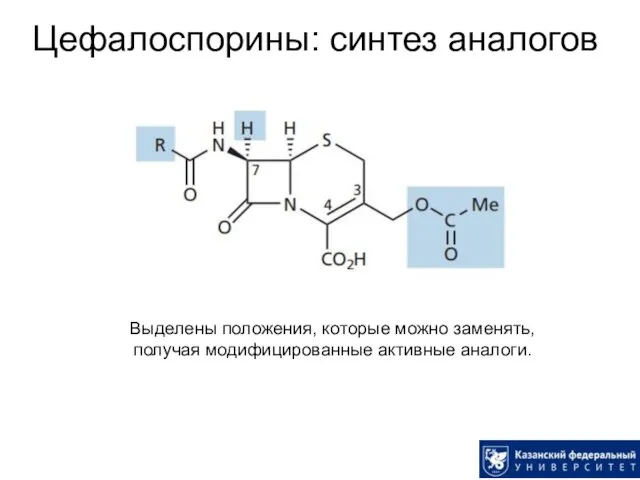
- 30. Цефалоспорины: синтез аналогов Выделены положения, которые можно заменять, получая модифицированные активные аналоги.
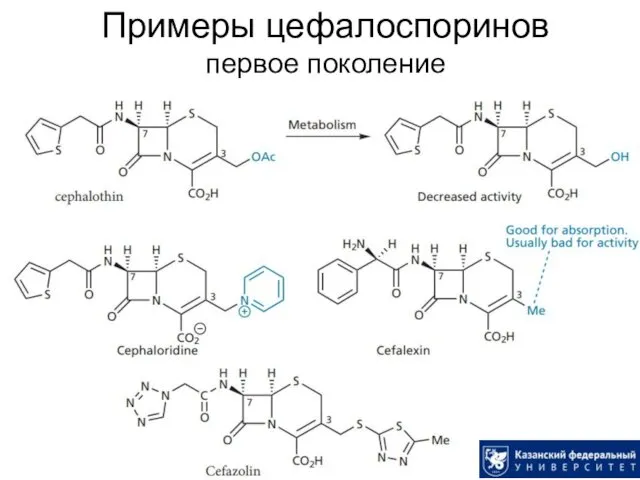
- 31. Примеры цефалоспоринов первое поколение
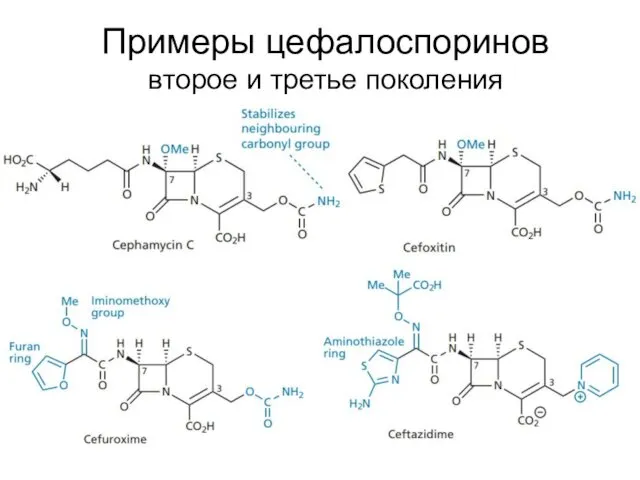
- 32. Примеры цефалоспоринов второе и третье поколения
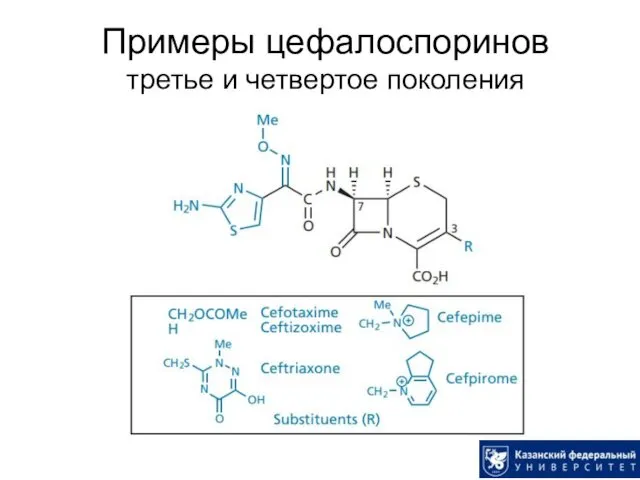
- 33. Примеры цефалоспоринов третье и четвертое поколения
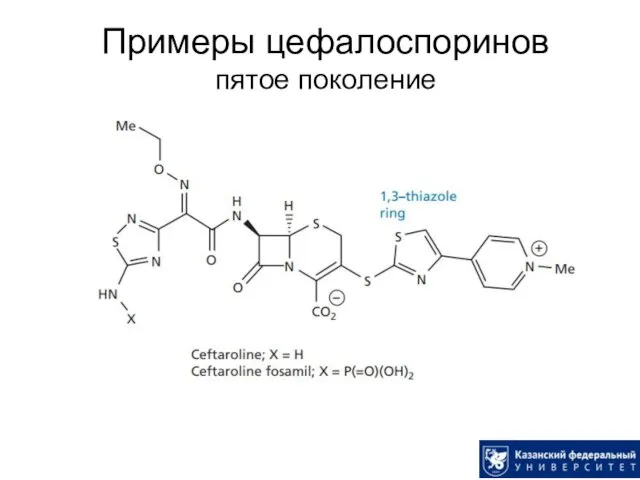
- 34. Примеры цефалоспоринов пятое поколение
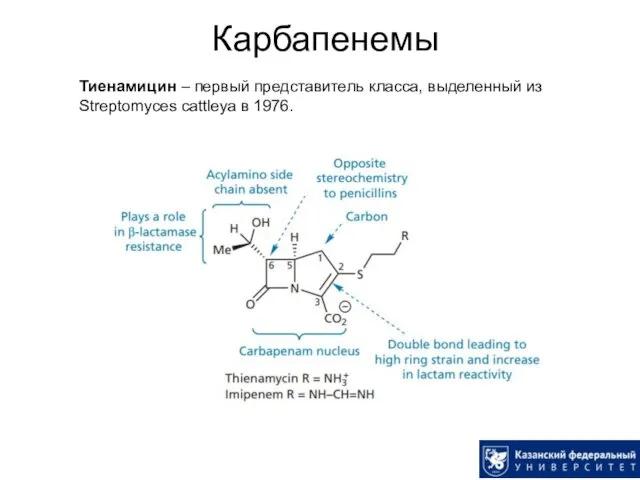
- 35. Карбапенемы Тиенамицин – первый представитель класса, выделенный из Streptomyces cattleya в 1976.
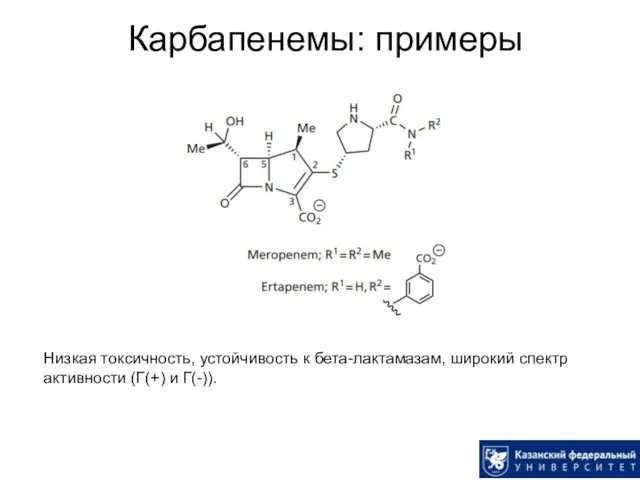
- 36. Карбапенемы: примеры Низкая токсичность, устойчивость к бета-лактамазам, широкий спектр активности (Г(+) и Г(-)).
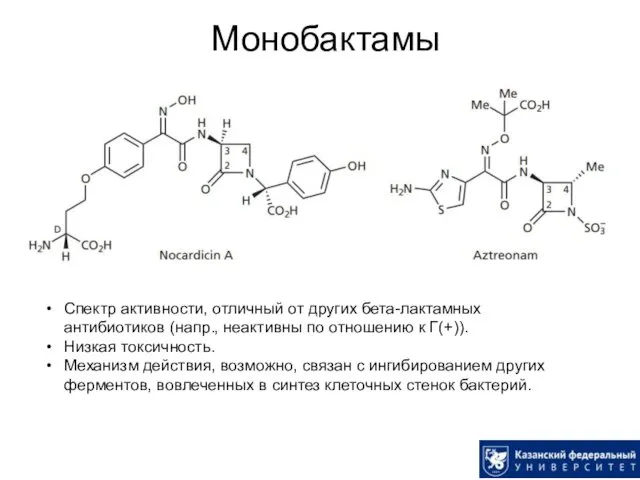
- 37. Монобактамы Спектр активности, отличный от других бета-лактамных антибиотиков (напр., неактивны по отношению к Г(+)). Низкая токсичность.
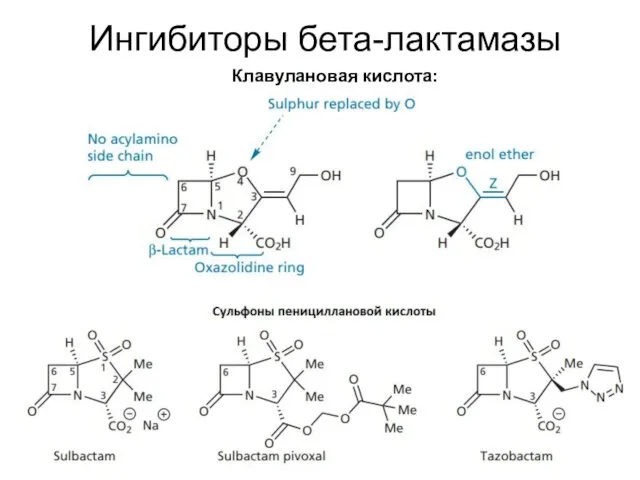
- 38. Ингибиторы бета-лактамазы Клавулановая кислота:
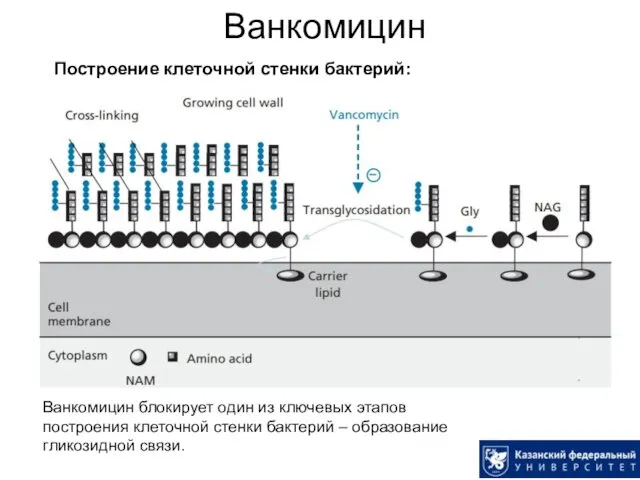
- 39. Ванкомицин Построение клеточной стенки бактерий: Ванкомицин блокирует один из ключевых этапов построения клеточной стенки бактерий –
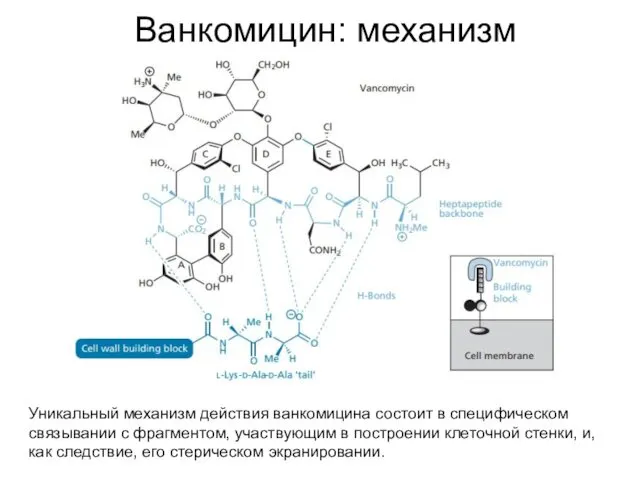
- 40. Ванкомицин: механизм Уникальный механизм действия ванкомицина состоит в специфическом связывании с фрагментом, участвующим в построении клеточной
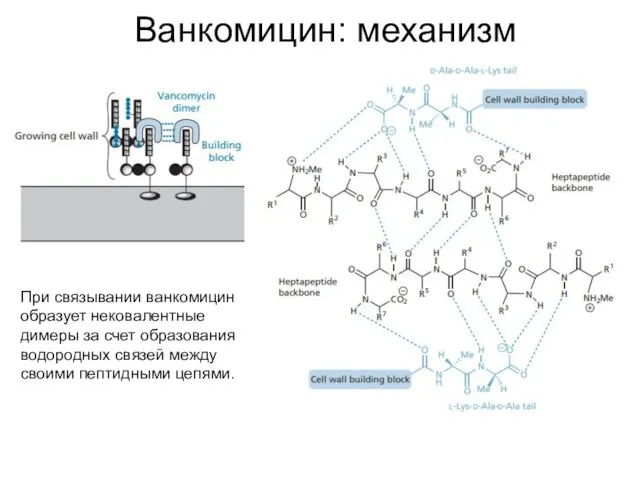
- 41. Ванкомицин: механизм При связывании ванкомицин образует нековалентные димеры за счет образования водородных связей между своими пептидными
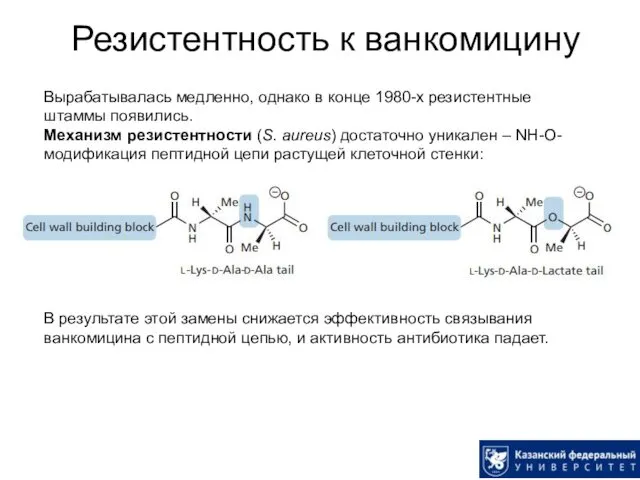
- 42. Резистентность к ванкомицину Вырабатывалась медленно, однако в конце 1980-х резистентные штаммы появились. Механизм резистентности (S. aureus)
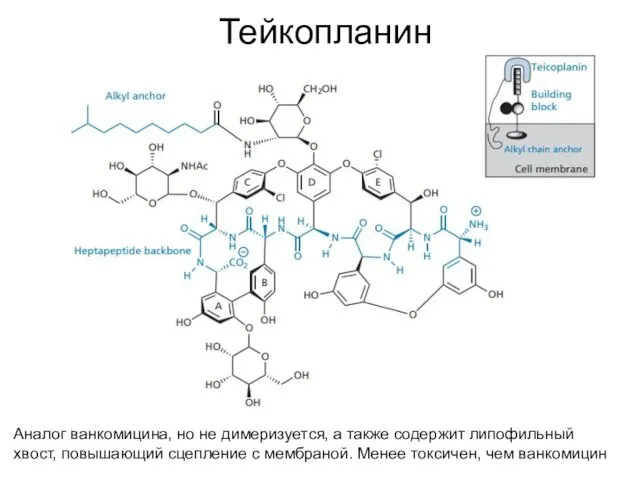
- 43. Тейкопланин Аналог ванкомицина, но не димеризуется, а также содержит липофильный хвост, повышающий сцепление с мембраной. Менее
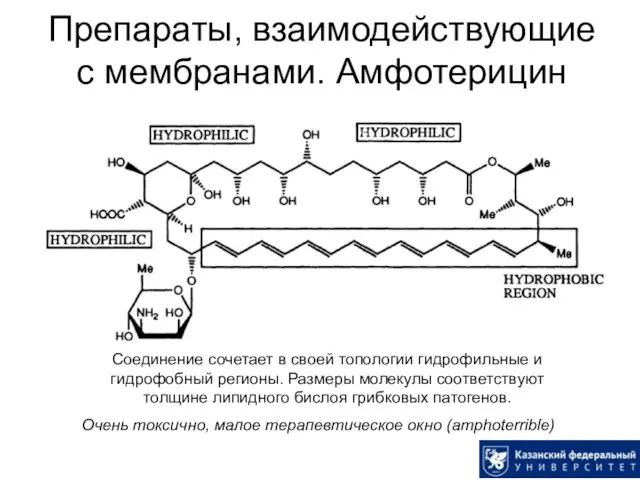
- 44. Препараты, взаимодействующие с мембранами. Амфотерицин Соединение сочетает в своей топологии гидрофильные и гидрофобный регионы. Размеры молекулы
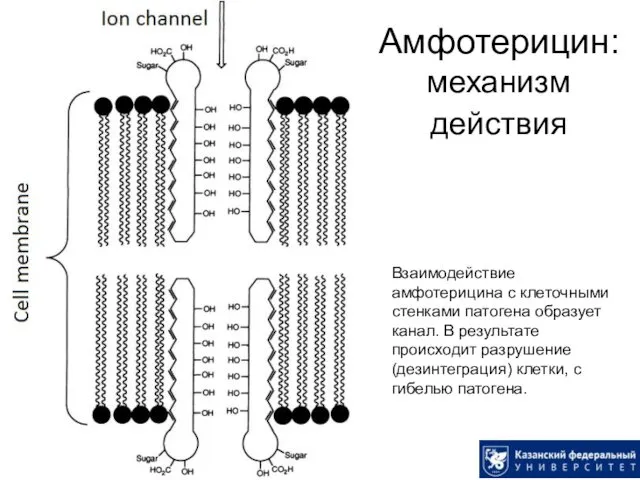
- 45. Амфотерицин: механизм действия Взаимодействие амфотерицина с клеточными стенками патогена образует канал. В результате происходит разрушение (дезинтеграция)
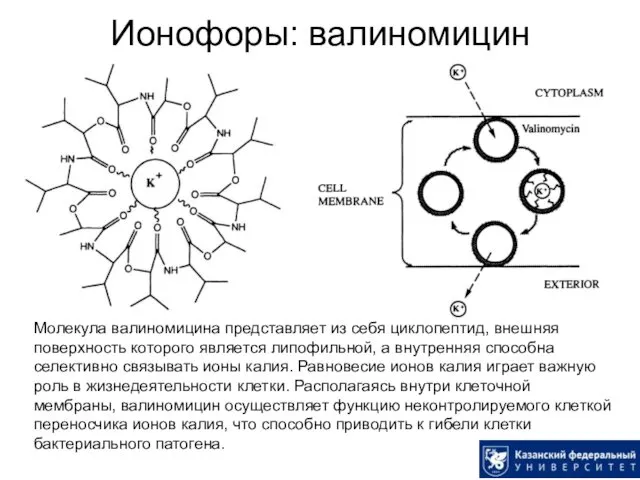
- 46. Ионофоры: валиномицин Молекула валиномицина представляет из себя циклопептид, внешняя поверхность которого является липофильной, а внутренняя способна
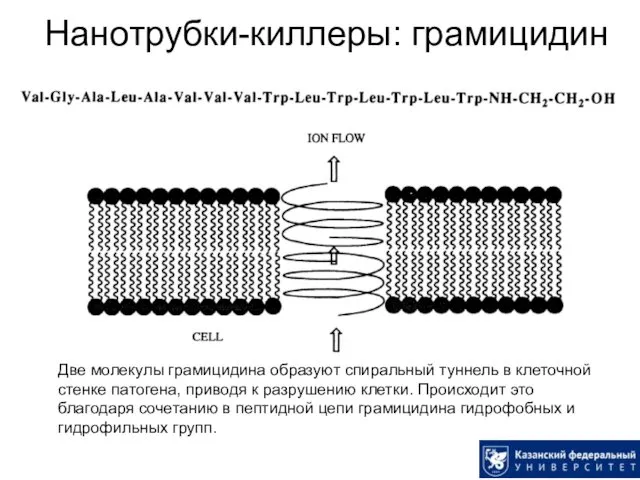
- 47. Нанотрубки-киллеры: грамицидин Две молекулы грамицидина образуют спиральный туннель в клеточной стенке патогена, приводя к разрушению клетки.
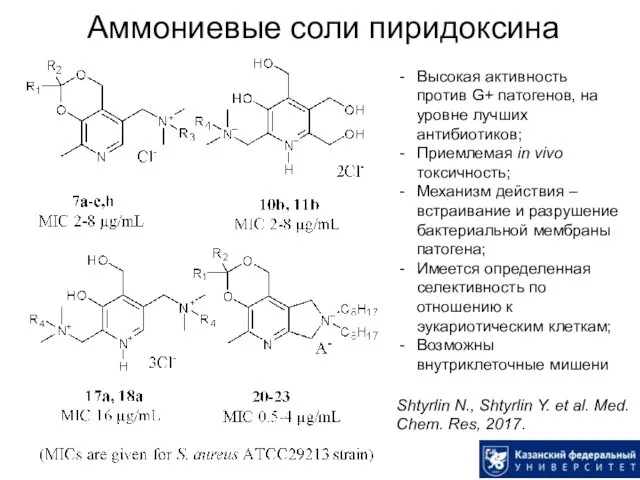
- 48. Аммониевые соли пиридоксина Shtyrlin N., Shtyrlin Y. et al. Med. Chem. Res, 2017. Высокая активность против
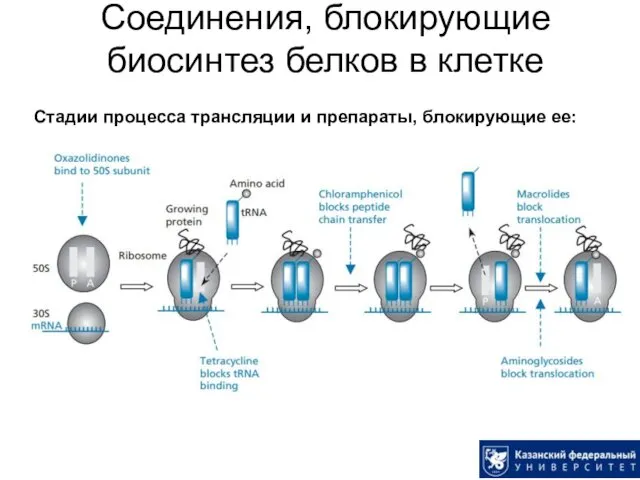
- 49. Соединения, блокирующие биосинтез белков в клетке Стадии процесса трансляции и препараты, блокирующие ее:
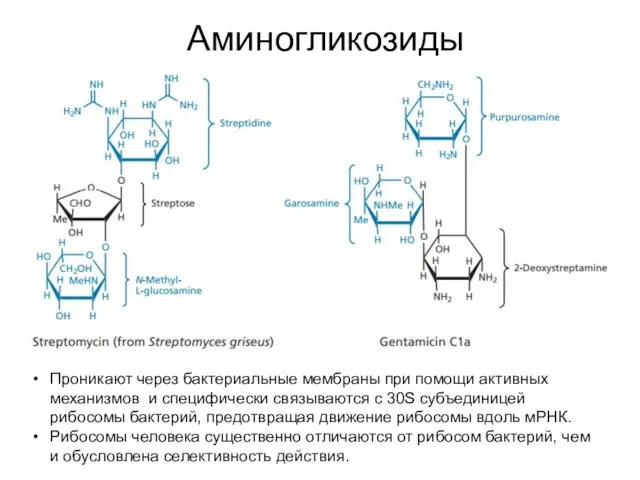
- 50. Аминогликозиды Проникают через бактериальные мембраны при помощи активных механизмов и специфически связываются с 30S субъединицей рибосомы
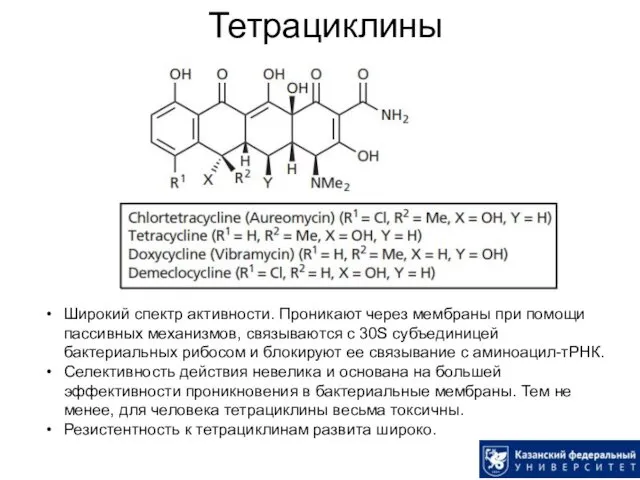
- 51. Тетрациклины Широкий спектр активности. Проникают через мембраны при помощи пассивных механизмов, связываются с 30S субъединицей бактериальных
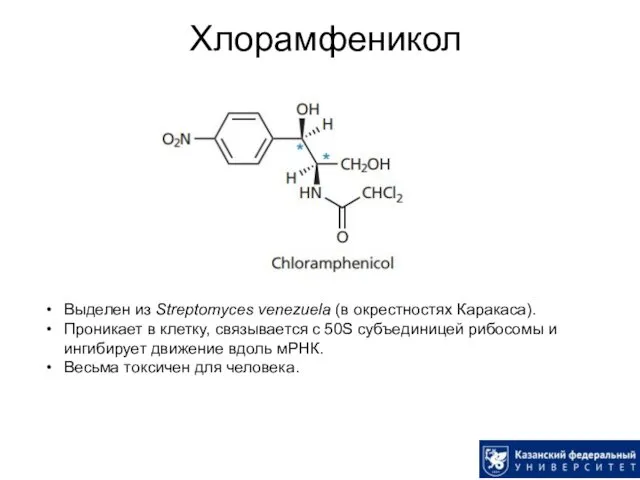
- 52. Хлорамфеникол Выделен из Streptomyces venezuela (в окрестностях Каракаса). Проникает в клетку, связывается с 50S субъединицей рибосомы
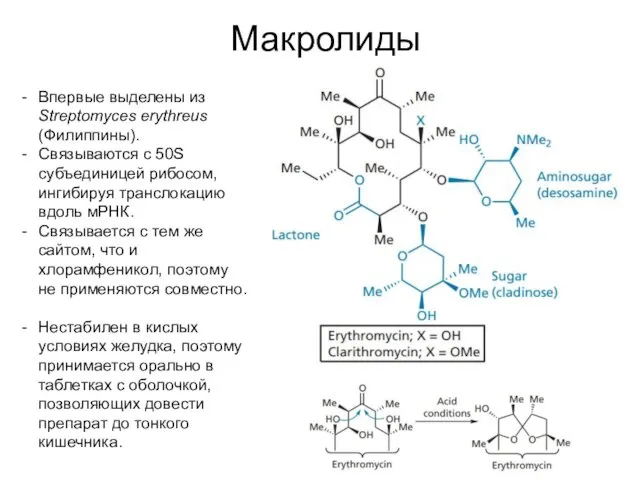
- 53. Макролиды Впервые выделены из Streptomyces erythreus (Филиппины). Связываются с 50S субъединицей рибосом, ингибируя транслокацию вдоль мРНК.
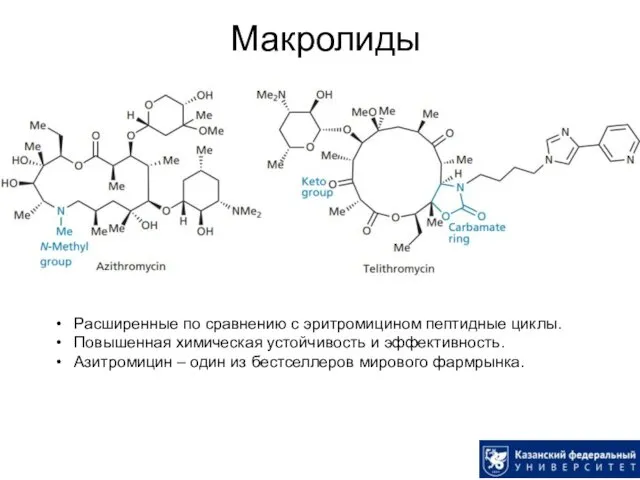
- 54. Макролиды Расширенные по сравнению с эритромицином пептидные циклы. Повышенная химическая устойчивость и эффективность. Азитромицин – один
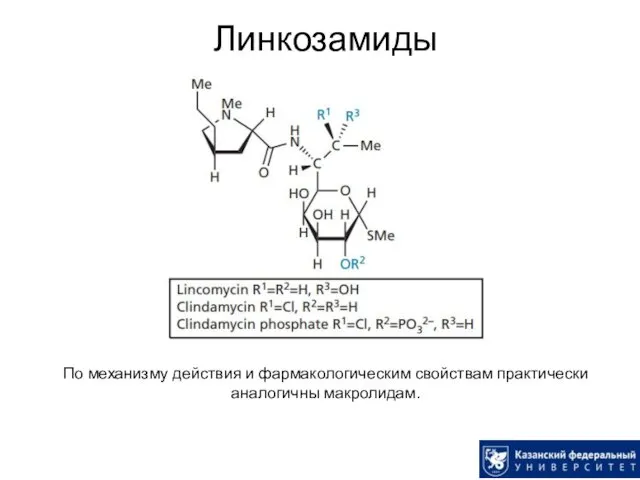
- 55. Линкозамиды По механизму действия и фармакологическим свойствам практически аналогичны макролидам.
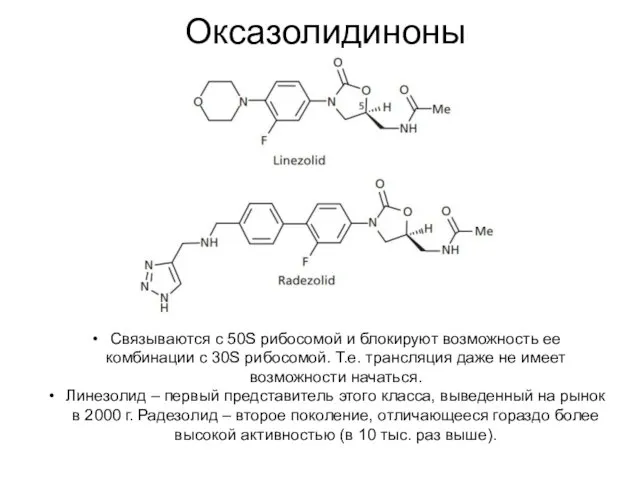
- 56. Оксазолидиноны Связываются с 50S рибосомой и блокируют возможность ее комбинации с 30S рибосомой. Т.е. трансляция даже
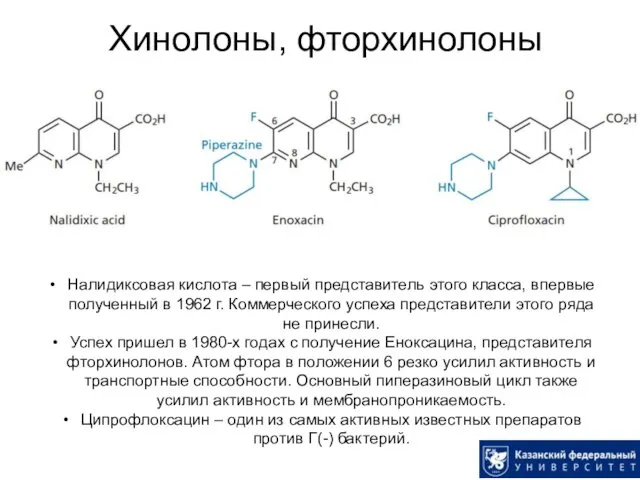
- 57. Хинолоны, фторхинолоны Налидиксовая кислота – первый представитель этого класса, впервые полученный в 1962 г. Коммерческого успеха
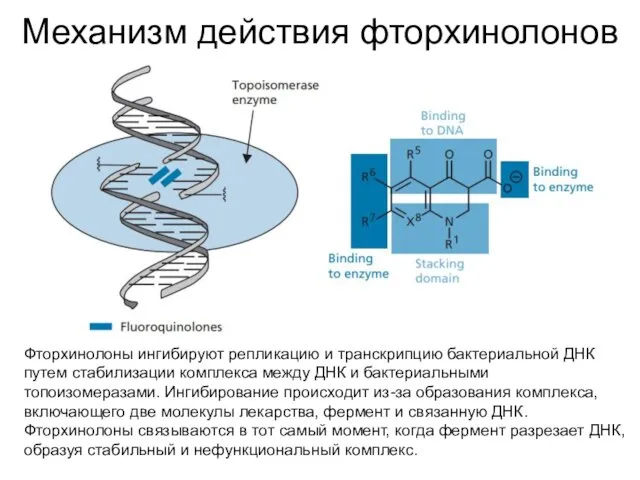
- 58. Механизм действия фторхинолонов Фторхинолоны ингибируют репликацию и транскрипцию бактериальной ДНК путем стабилизации комплекса между ДНК и
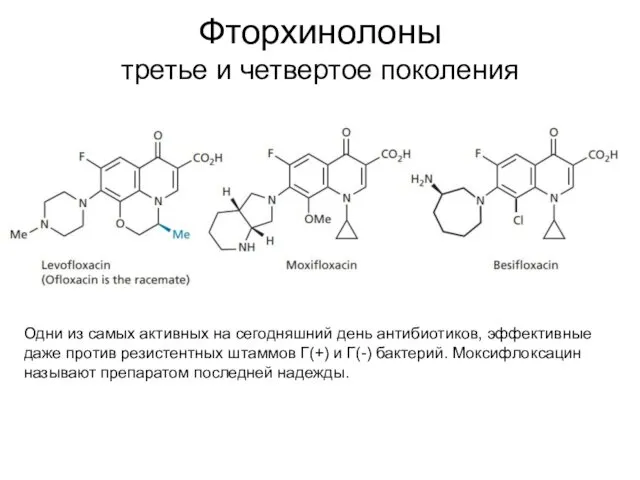
- 59. Фторхинолоны третье и четвертое поколения Одни из самых активных на сегодняшний день антибиотиков, эффективные даже против
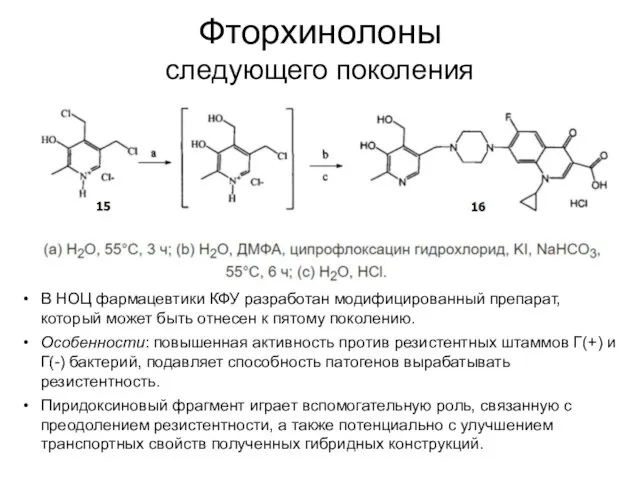
- 60. Фторхинолоны следующего поколения В НОЦ фармацевтики КФУ разработан модифицированный препарат, который может быть отнесен к пятому
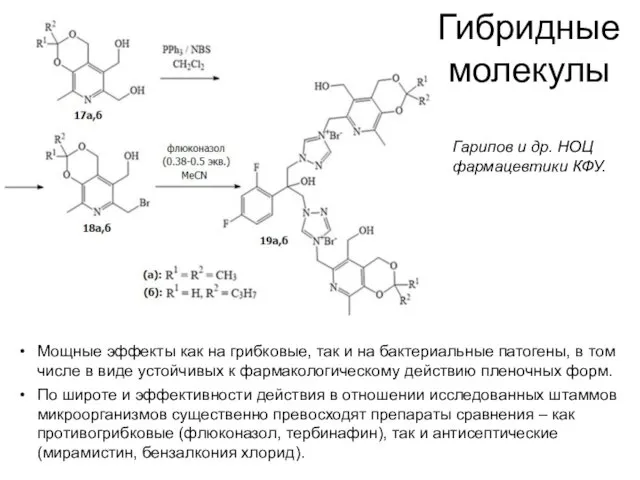
- 61. Гибридные молекулы Мощные эффекты как на грибковые, так и на бактериальные патогены, в том числе в
- 63. Скачать презентацию



 Машины для измельчения материалов
Машины для измельчения материалов Аттестация педагогов.Нормативно-правовое обеспечение Диск
Аттестация педагогов.Нормативно-правовое обеспечение Диск Артикуляционная гимнастика. Звук С. Презентация
Артикуляционная гимнастика. Звук С. Презентация Правовые основы брака и семьи
Правовые основы брака и семьи Шарль де Голль
Шарль де Голль Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік
Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік Проект “Кто твой герой?”
Проект “Кто твой герой?” Интеллектуальная игра Звездный час
Интеллектуальная игра Звездный час Научно - исследовательская работа Чудо - шоколад
Научно - исследовательская работа Чудо - шоколад Релейная защита и автоматизация электроэнергетических систем
Релейная защита и автоматизация электроэнергетических систем INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06
INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06 Школьные годы чудесные. Советы новоиспечённым педагогам
Школьные годы чудесные. Советы новоиспечённым педагогам Композиция. Пропорции. Клетка
Композиция. Пропорции. Клетка Рак ободочной кишки
Рак ободочной кишки Как правильно подготовить ребёнка к школе
Как правильно подготовить ребёнка к школе Легкие бетоны
Легкие бетоны О вреде использованных батареек для окружающей среды
О вреде использованных батареек для окружающей среды физ.минутки на уроках
физ.минутки на уроках Выход проекта Я и моя Воркута
Выход проекта Я и моя Воркута Презентация Сахароза
Презентация Сахароза Родительское собрание Мой ребёнок - левша
Родительское собрание Мой ребёнок - левша Учимся определять время по часам
Учимся определять время по часам Семейные праздники
Семейные праздники Технологическая прочность сварных соединений
Технологическая прочность сварных соединений Научная конференция на тему Мировые экологические проблемы
Научная конференция на тему Мировые экологические проблемы Теплоснабжение городов и зданий (Тема 6)
Теплоснабжение городов и зданий (Тема 6) I Вселенский Собор в Никее
I Вселенский Собор в Никее Роль женщины в современном мире
Роль женщины в современном мире