Содержание
- 2. Спектр с латинского «дух, приведение» - распределение значений физической величины (обычно энергии).
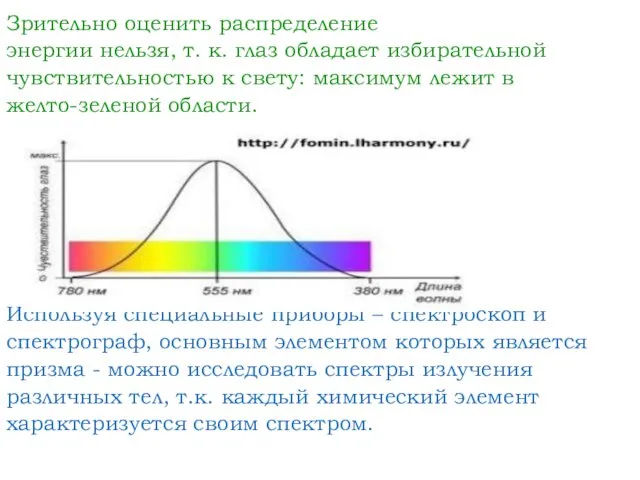
- 3. Зрительно оценить распределение энергии нельзя, т. к. глаз обладает избирательной чувствительностью к свету: максимум лежит в
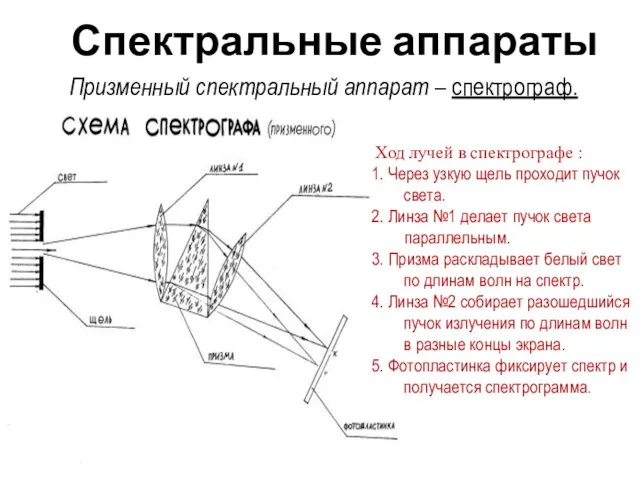
- 4. Спектральные аппараты Ход лучей в спектрографе : 1. Через узкую щель проходит пучок света. 2. Линза
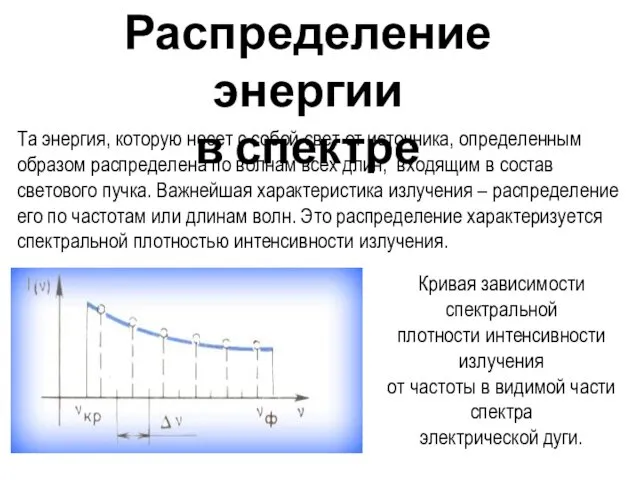
- 5. Распределение энергии в спектре Та энергия, которую несет с собой свет от источника, определенным образом распределена
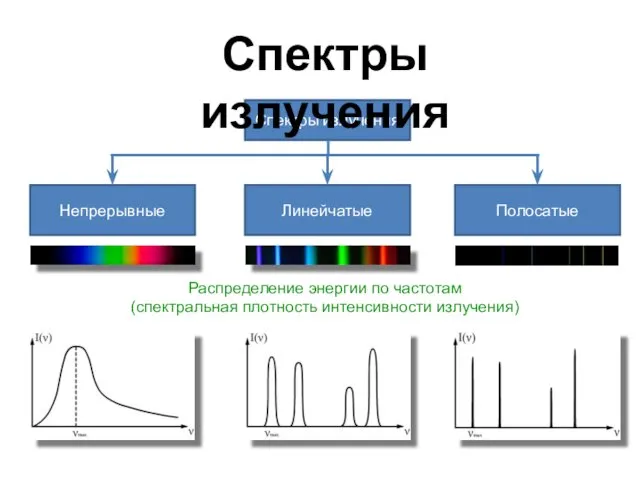
- 6. Распределение энергии по частотам (спектральная плотность интенсивности излучения) Спектры излучения
- 7. Дают тела, находящиеся в твердом, жидком состоянии, а также плотные газы. Чтобы получить, надо нагреть тело
- 8. Дают все вещества в газообразном атомном (но не молекулярном) состоянии (атомы практически не взаимодействуют друг с
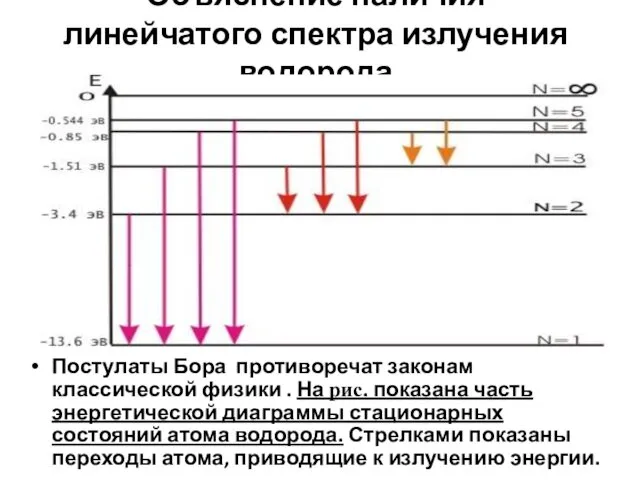
- 9. Объяснение наличия линейчатого спектра излучения водорода Постулаты Бора противоречат законам классической физики . На рис. показана
- 10. Спектр состоит из отдельных полос, разделенных темными промежутками. Каждая полоса представляет собой совокупность большого числа очень
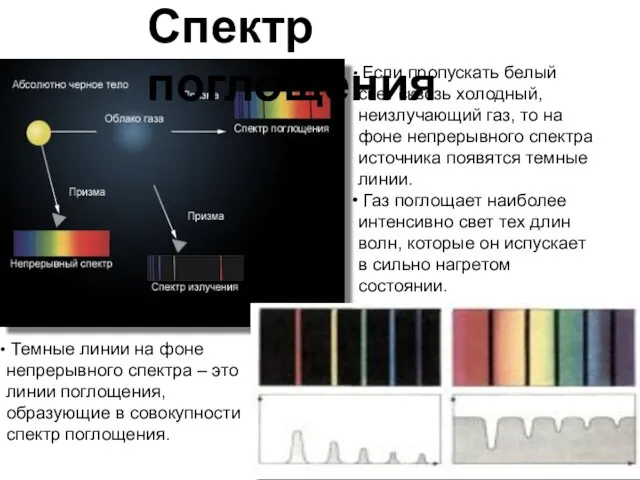
- 11. Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появятся темные
- 12. Густав Роберт Кирхгоф 1824 - 1887 Роберт Вильгельм Бунзен 1811 - 1899 Спектральный анализ – метод
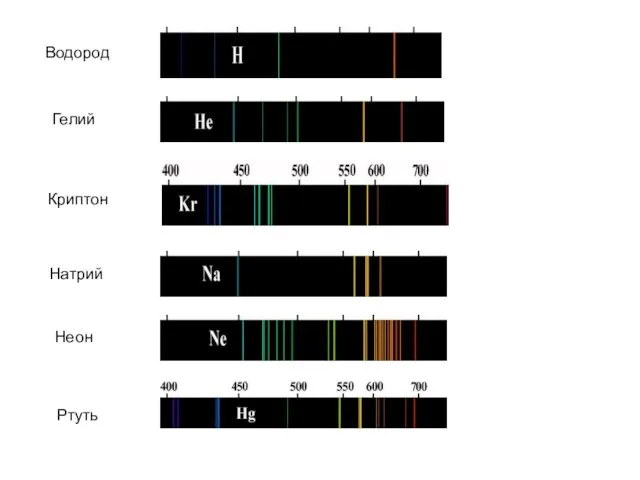
- 13. Водород Гелий Криптон Натрий Неон Ртуть
- 14. Длины волн (или частоты) линейчатого спектра какого-либо вещества зависят только от свойств атомов этого вещества, но
- 15. Открываются новые элементы: рубидий, цезий и др; Узнали химический состав Солнца и звезд; Определяют химический состав
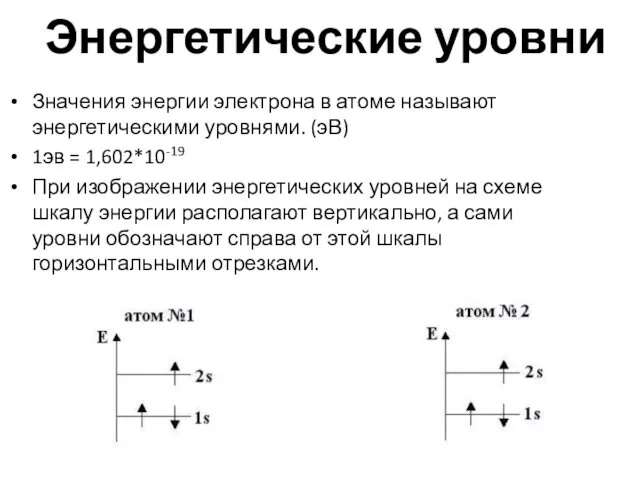
- 16. Энергетические уровни Значения энергии электрона в атоме называют энергетическими уровнями. (эВ) 1эв = 1,602*10-19 При изображении
- 18. Скачать презентацию







 Конспект урока и презентация Почитай родителей
Конспект урока и презентация Почитай родителей Заболевания печени
Заболевания печени Тревожные дети тревожных родителей
Тревожные дети тревожных родителей Ароматерапія – медицина майбутнього
Ароматерапія – медицина майбутнього Становление христианства и развитие больничного дела
Становление христианства и развитие больничного дела Логопедическая работа с учащимися 1 классов.
Логопедическая работа с учащимися 1 классов. Работа ученицы Первая железная дорога
Работа ученицы Первая железная дорога Элементы дизайна
Элементы дизайна Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства
Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства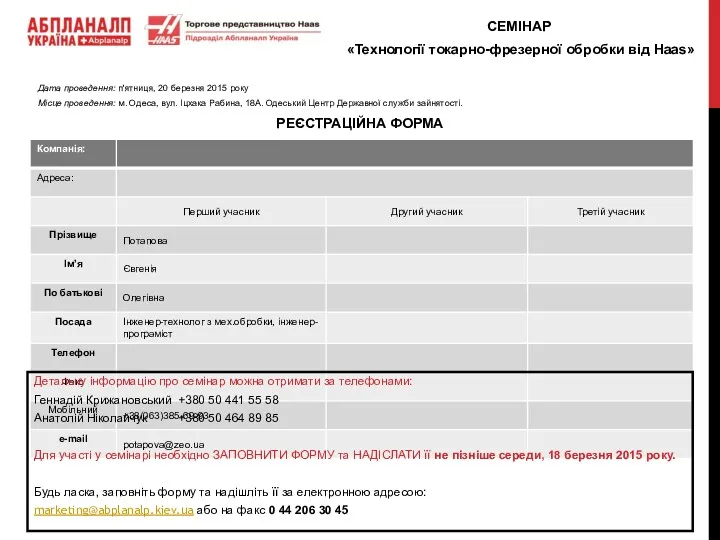 заявка на семинар
заявка на семинар Будь осторожен с огнём!
Будь осторожен с огнём! Culture and International Public Relations
Culture and International Public Relations Комплексные методы управления качеством
Комплексные методы управления качеством Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов
Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов Ряд Фурье и интеграл Фурье
Ряд Фурье и интеграл Фурье Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска
Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска Телефон доверия для детей и подростков, и их родителей
Телефон доверия для детей и подростков, и их родителей Робототехника в нашей жизни
Робототехника в нашей жизни sohrani_moyu_i_svoyu_zhizn
sohrani_moyu_i_svoyu_zhizn Выводы логики высказываний (2)
Выводы логики высказываний (2) Составляющие и функции операционной системы Linux
Составляющие и функции операционной системы Linux золотая хохлома
золотая хохлома Перекрытия и полы малоэтажных зданий
Перекрытия и полы малоэтажных зданий Поздравление с Днем рождения
Поздравление с Днем рождения Единицы времени 2. Календарь. 2 класс
Единицы времени 2. Календарь. 2 класс Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара)
Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара) Термообработка деревянного реквизита
Термообработка деревянного реквизита Характеристики позиционных систем счисления
Характеристики позиционных систем счисления