Содержание
- 2. ВОПРОСЫ И ЗАДАНИЯ
- 3. ВОПРОСЫ И ЗАДАНИЯ
- 4. ВОПРОСЫ И ЗАДАНИЯ
- 5. ВОПРОСЫ И ЗАДАНИЯ
- 6. АТОМЫ. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
- 7. ОСНОВНЫЕ ПОНЯТИЯ ОСНОВНЫЕ ПОНЯТИЯ
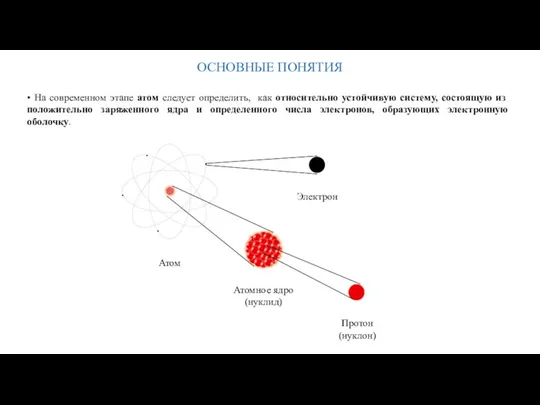
- 8. ОСНОВНЫЕ ПОНЯТИЯ • На современном этапе атом следует определить, как относительно устойчивую систему, состоящую из положительно
- 9. ОСНОВНЫЕ ПОНЯТИЯ • Атомное ядро состоит из положительно заряженных протонов и «нуль-зарядных» нейтронов. Ядро является относительно
- 10. ОСНОВНЫЕ ПОНЯТИЯ • В случае равенства числа протонов и электронов атом оказывается электронейтральным (a), в случае
- 11. ОСНОВНЫЕ ПОНЯТИЯ • Устойчивость атомной системы означает, что атомное ядро и электроны в составе атома обладают
- 12. ОСНОВНЫЕ ПОНЯТИЯ • К настоящему времени достоверно известно 118 видов атомов, отличающихся друг от друга строением,
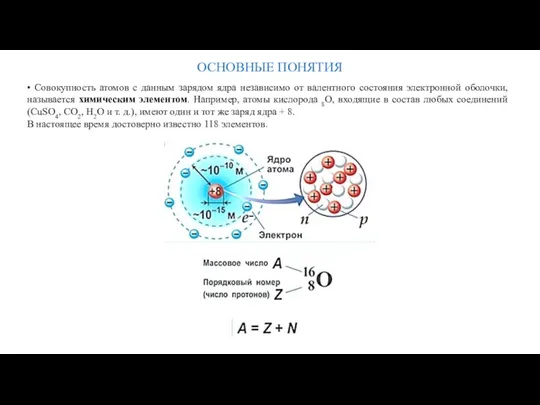
- 13. ОСНОВНЫЕ ПОНЯТИЯ • Совокупность атомов с данным зарядом ядра независимо от валентного состояния электронной оболочки, называется
- 14. ОСНОВНЫЕ ПОНЯТИЯ
- 15. ОСНОВНЫЕ ПОНЯТИЯ • Разновидности атомов одного химического элемента с постоянным количеством протонов, но различным количеством нейтронов
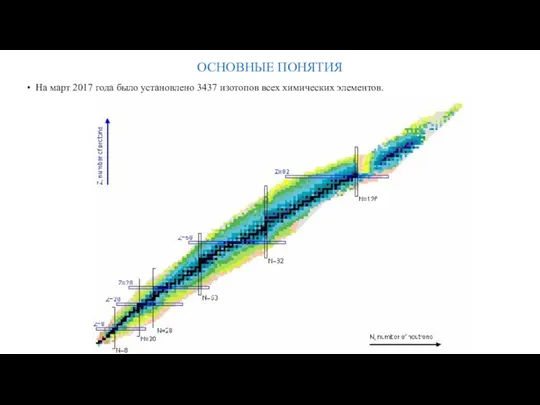
- 16. ОСНОВНЫЕ ПОНЯТИЯ • На март 2017 года было установлено 3437 изотопов всех химических элементов.
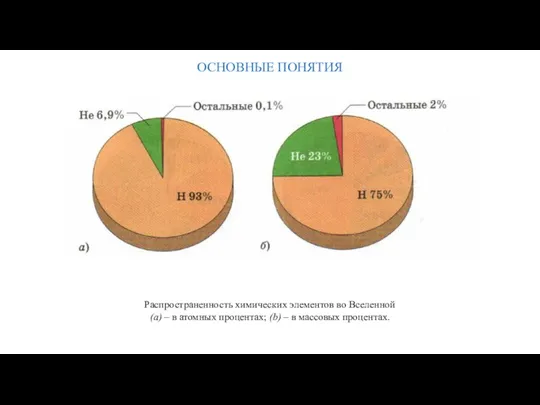
- 17. ОСНОВНЫЕ ПОНЯТИЯ Распространенность химических элементов во Вселенной (а) – в атомных процентах; (b) – в массовых
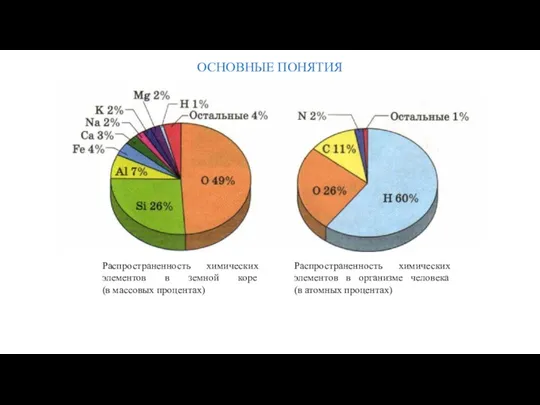
- 18. ОСНОВНЫЕ ПОНЯТИЯ Распространенность химических элементов в земной коре (в массовых процентах) Распространенность химических элементов в организме
- 19. ОСНОВНЫЕ ПОНЯТИЯ • Атомы химических элементов взаимодействуют друг с другом и образуют молекулы. • Молекула —
- 21. Скачать презентацию













 Педагогический Проект Коррекция речевых нарушений у детей старшего дошкольного возраста посредством развития мелкой моторики
Педагогический Проект Коррекция речевых нарушений у детей старшего дошкольного возраста посредством развития мелкой моторики Игровые технологии как средства формирования коммуникативной компетенции учащихся.
Игровые технологии как средства формирования коммуникативной компетенции учащихся. История домонгольской Руси
История домонгольской Руси Презентация первого урока Город, комфортный для жизни
Презентация первого урока Город, комфортный для жизни Что такое семейные реликвии
Что такое семейные реликвии Развитие медицины сегодня, её роль в обществе. Современное состояние медицины в РК
Развитие медицины сегодня, её роль в обществе. Современное состояние медицины в РК Снижение потерь электроэнергии путем компенсации реактивной мощности
Снижение потерь электроэнергии путем компенсации реактивной мощности Линейные вычислительные алгоритмы
Линейные вычислительные алгоритмы Оределяем темперамент ребенкап
Оределяем темперамент ребенкап Подвижные установки для дегазации и азотирования масла
Подвижные установки для дегазации и азотирования масла Програми-архіватори. Операції над архівами (урок 8, 8клас)
Програми-архіватори. Операції над архівами (урок 8, 8клас)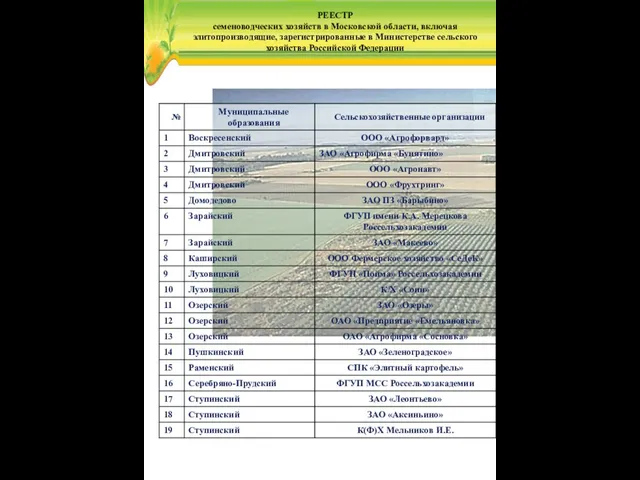 Реестр семеноводческих хозяйств в Московской области, включая элитопроизводящие, зарегистрированные в Министерстве сельского хозяйства
Реестр семеноводческих хозяйств в Московской области, включая элитопроизводящие, зарегистрированные в Министерстве сельского хозяйства Автомобилестроительная корпорация Toyota Motor Corporation
Автомобилестроительная корпорация Toyota Motor Corporation Альтернатива использования мёда в производстве молочных продуктов
Альтернатива использования мёда в производстве молочных продуктов Общество с ограниченной ответственностью Астериас. Промышленная фильтрация. Инжиниринг
Общество с ограниченной ответственностью Астериас. Промышленная фильтрация. Инжиниринг История создания швейной машинки
История создания швейной машинки Оформление реферата по зоопсихологии
Оформление реферата по зоопсихологии Шефская работа. Викторина для мальчиков и девочек.
Шефская работа. Викторина для мальчиков и девочек. Интеллектуальная игра Самый умный
Интеллектуальная игра Самый умный Interaktivnaya_igra_Den_rossiyskoy_nauki
Interaktivnaya_igra_Den_rossiyskoy_nauki ЛОГОПЕДИЧЕСКИЙ АЛЬБОМ
ЛОГОПЕДИЧЕСКИЙ АЛЬБОМ Виды речевой и читательской деятельности
Виды речевой и читательской деятельности Память героям Отечества
Память героям Отечества Туляремия
Туляремия Деятельностный подход в обучении географии
Деятельностный подход в обучении географии Презентация Природные источники углеводородов
Презентация Природные источники углеводородов Работа с молодыми специалистами
Работа с молодыми специалистами Бесік жыры
Бесік жыры