Содержание
- 2. V группа, главная подгруппа N-азот неметалл P- фосфор неметалл As- мышьяк неметалл Sb- сурьма амфотерный металл
- 3. В воздухе он главный газ Окружает всюду нас. Угасает жизнь растений Без него, без удобрений. В
- 4. История открытия азота В 1772 году английский ученый Д. Резерфорд и шведский исследователь К. Шееле обнаружили
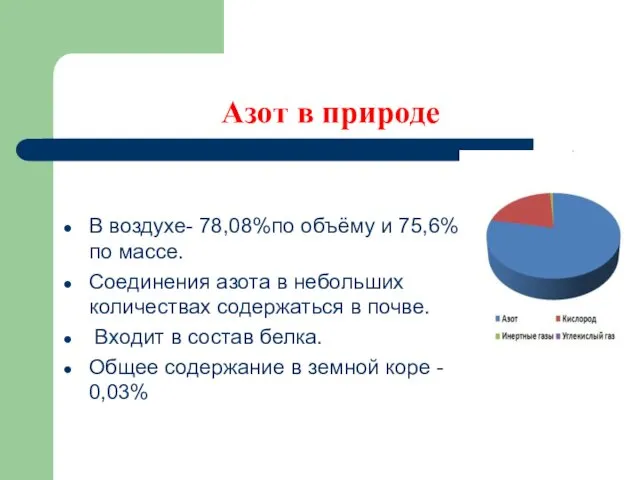
- 5. В воздухе- 78,08%по объёму и 75,6% по массе. Соединения азота в небольших количествах содержаться в почве.
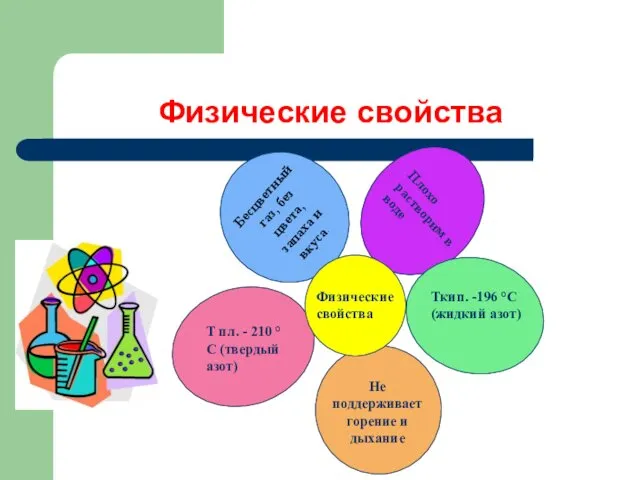
- 6. Физические свойства Физические свойства Бесцветный газ, без цвета, запаха и вкуса. Плохо растворим в воде Ткип.
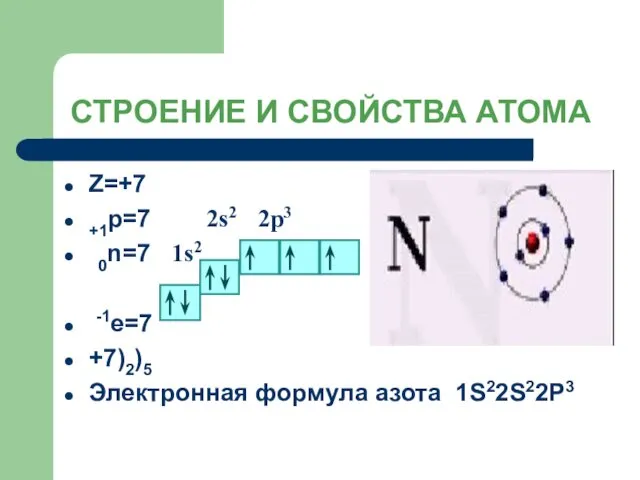
- 7. СТРОЕНИЕ И СВОЙСТВА АТОМА Z=+7 +1p=7 2s2 2p3 0n=7 1s2 -1е=7 +7)2)5 Электронная формула азота 1S22S22P3
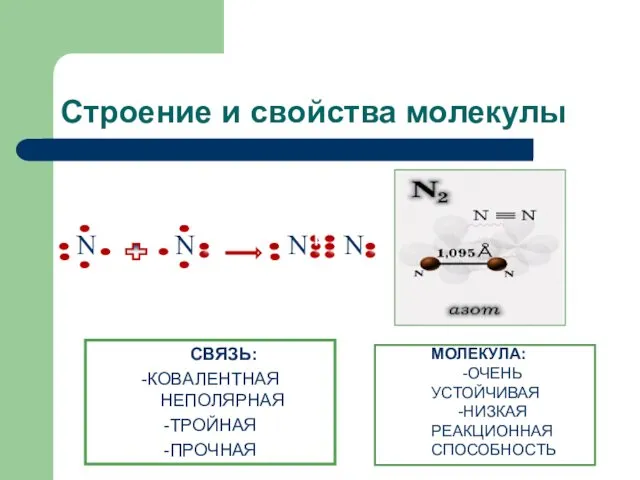
- 8. Строение и свойства молекулы СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ N
- 9. Паспорт химического элемента химический знак N Порядковый номер 7 неметалл V группа, главная подгруппа (А подгруппа)
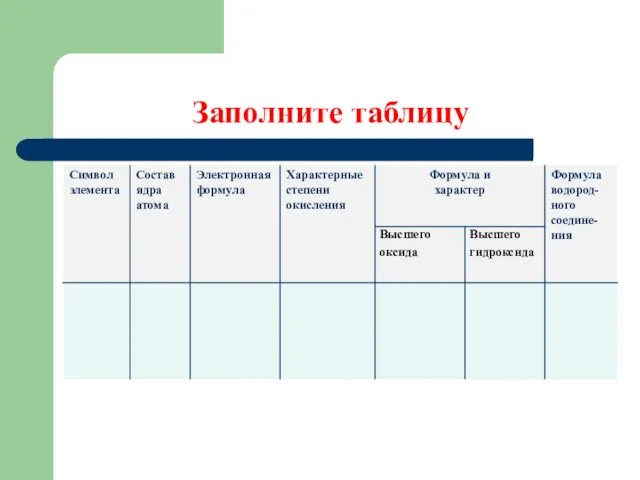
- 10. Заполните таблицу
- 11. Химические свойства Свойства окислителя А) Взаимодействие с металлами. 6Li+N2 = 2Li3N (нитрид лития) - обычные условия
- 12. Химические свойства Свойства восстановителя В) Взаимодействие с кислородом. Успешно такие реакции идут только при весьма жестких
- 13. Азот – жизненно важный элемент Все основные части клеток тканей организма построены из белковых молекул, в
- 14. Вывод При взаимодействии с металлами и водородом азот является окислителем. При взаимодействии с кислородом азот является
- 15. Проверь себя N2+3H2 NH3 +Q Обратимая Соединения Экзотермическая ОВР Каталитическая Гомогенная N2+O2 2NO –Q Обратимая Соединения
- 16. Получение азота А) Промышленный способ (перегонка жидкого воздуха): воздух охлаждают и переводят в жидкое состояние, затем
- 17. Области применения азота Свободный азот применяют во многих отраслях промышленности; в медицине (нашатырный спирт) жидкий азот
- 19. Скачать презентацию











 Пожарная безопасность для дошкольников 5-7 лет
Пожарная безопасность для дошкольников 5-7 лет Химия и фотография
Химия и фотография Примеры планировочных решений производственных участков
Примеры планировочных решений производственных участков Проектирование малогабаритной метеостанции
Проектирование малогабаритной метеостанции публичная презентация общественности и профессиональному сообществу результатов педагогической деятельности
публичная презентация общественности и профессиональному сообществу результатов педагогической деятельности Основы работы с табличным процессором MS Excel
Основы работы с табличным процессором MS Excel Замер статического уровня жидкости в скважине
Замер статического уровня жидкости в скважине Родительское собрание Самостоятельность ребенка
Родительское собрание Самостоятельность ребенка Материал для изготовления мебели. Древесноволокнистая плита (ДВП
Материал для изготовления мебели. Древесноволокнистая плита (ДВП Описание материка Северная Америка
Описание материка Северная Америка Романский и готический стили
Романский и готический стили Нуклеотиды и нуклеиновые кислоты. Строение ДНК и РНК
Нуклеотиды и нуклеиновые кислоты. Строение ДНК и РНК Северо-Восточная Русь в XII – начале XIII веков
Северо-Восточная Русь в XII – начале XIII веков Методы защиты энергооборудования от коррозии
Методы защиты энергооборудования от коррозии Лапароскопия в детской хирургии
Лапароскопия в детской хирургии Транспорт и мировое хозяйство. 10 класс
Транспорт и мировое хозяйство. 10 класс Құю өндірісінің технологиясы
Құю өндірісінің технологиясы Современные строительные материалы
Современные строительные материалы Пародонт тіндерінің анатомиялық гистологиялық ерекшеліктері, құрылымы, қызметі
Пародонт тіндерінің анатомиялық гистологиялық ерекшеліктері, құрылымы, қызметі Вітаю вас з днем народження мамо! Фотоальбом
Вітаю вас з днем народження мамо! Фотоальбом 20230816_sera_himiya_9_klass
20230816_sera_himiya_9_klass Свиной цепень
Свиной цепень Образовательная область Коммуникация
Образовательная область Коммуникация Углы, связанные с окружностью
Углы, связанные с окружностью Цветущая ветка вишни
Цветущая ветка вишни Твердотельная электроника. Полевые транзисторы
Твердотельная электроника. Полевые транзисторы Эксперимент с произношением
Эксперимент с произношением Транспорт. Виды транспорта
Транспорт. Виды транспорта