Содержание
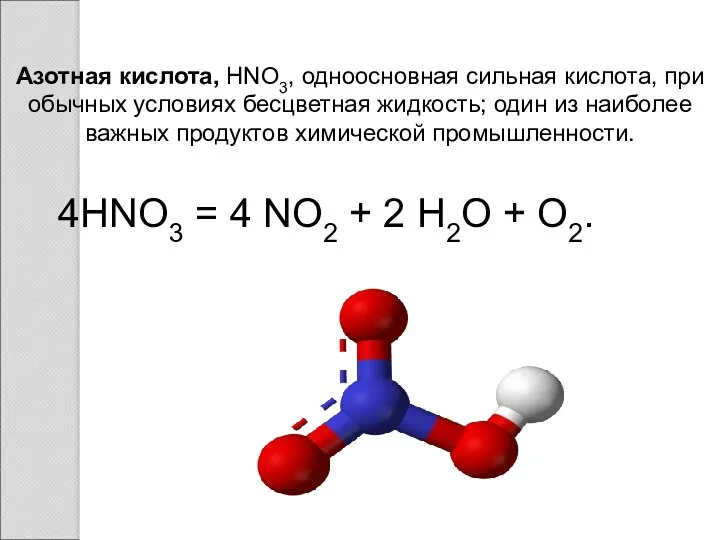
- 2. Азотная кислота, HNO3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов
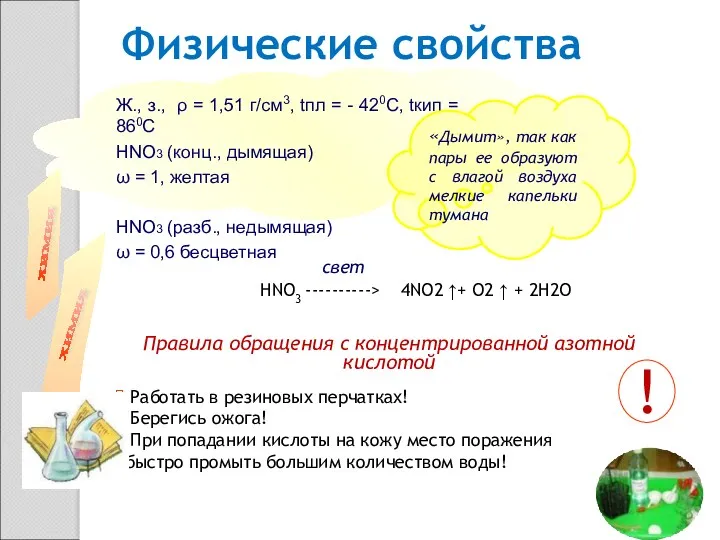
- 3. Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С НNO3 (конц., дымящая)
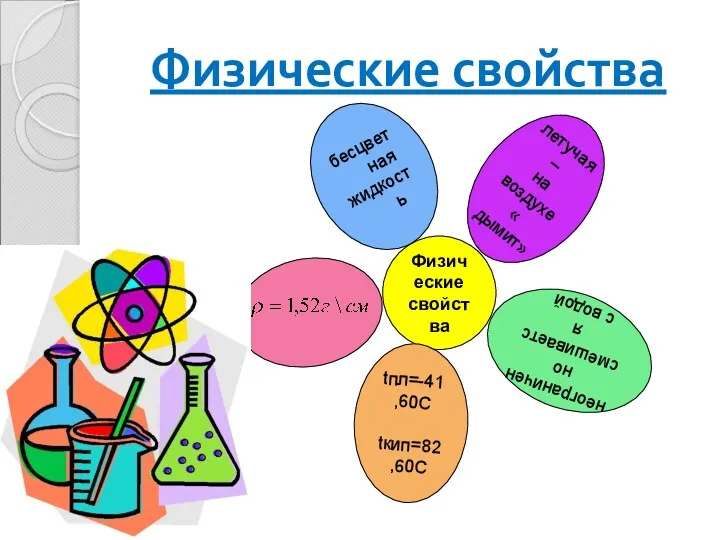
- 4. Физические свойства Физические свойства бесцветная жидкость летучая – на воздухе « дымит» неограниченно смешивается с водой
- 5. Азотная кислота- бесцветная жидкость с едким запахом. Очень гигроскопична, «дымит» на воздухе, так как пары ее
- 6. Нахождение в природе Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля
- 7. Химические свойства В HNO3 валентность азота равна 4, степень окисления +5. Разбавленная азотная кислота проявляет все
- 8. Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения: 4HNO3 = 4 NO2
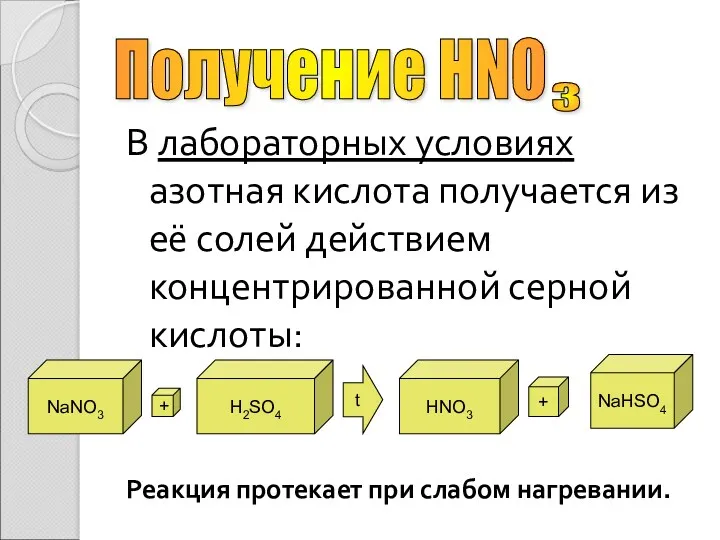
- 9. В лабораторных условиях азотная кислота получается из её солей действием концентрированной серной кислоты: Реакция протекает при
- 10. Промышленный способ В промышленности азотная кислота получается каталитическим окислением аммиака, который, в свою очередь, образуется как
- 11. 1) 4NH3 + 5O2 -> 4NO + 6H2O + Q 2) 2 NO + O2 ->
- 13. Скачать презентацию





 Жүйке жүйесінің гигиенасы
Жүйке жүйесінің гигиенасы Презентация Безопасность на дорогах
Презентация Безопасность на дорогах Уголок природы для детей среднего возраста 4-5 лет
Уголок природы для детей среднего возраста 4-5 лет Исследовательский проект Мой прадедушка – участник Великой Отечественной войны
Исследовательский проект Мой прадедушка – участник Великой Отечественной войны Презентация к материалу Программа формирования нравственного поведения младшего школьника
Презентация к материалу Программа формирования нравственного поведения младшего школьника Электрошокер. Виды электрошокеров
Электрошокер. Виды электрошокеров Птицы - наши соседи по планете
Птицы - наши соседи по планете Презентация к межпредметному проекту Энергетика России на тему:Природный газ
Презентация к межпредметному проекту Энергетика России на тему:Природный газ Электронное портфолио инструктора по физкультуре
Электронное портфолио инструктора по физкультуре Влияние комнатных растений на нашу жизнь
Влияние комнатных растений на нашу жизнь Program uruchomieniowy DEBUG
Program uruchomieniowy DEBUG Чрезвычайные ситуации, связанные с химическими факторами. Аварии на химически опасных объектах
Чрезвычайные ситуации, связанные с химическими факторами. Аварии на химически опасных объектах Разработка нефтяных месторождений. Часть 3
Разработка нефтяных месторождений. Часть 3 Возрастные периоды детства: дети грудного возраста
Возрастные периоды детства: дети грудного возраста Реки России
Реки России Культурьное наследие прототюрков
Культурьное наследие прототюрков Черные дыры. Проектно-исследовательская работа
Черные дыры. Проектно-исследовательская работа Программа Бит.качество
Программа Бит.качество Игра что где Когда
Игра что где Когда Катушка зажигания
Катушка зажигания SMART. Учимся ставить цели правильно!
SMART. Учимся ставить цели правильно! Презентация к классному часу Хорошую речь хорошо и слушать
Презентация к классному часу Хорошую речь хорошо и слушать Презентация Мальчики и девочки два разных мира
Презентация Мальчики и девочки два разных мира Подготовка к ЕГЭ по обществознанию
Подготовка к ЕГЭ по обществознанию презентация Блокада Ленинграда
презентация Блокада Ленинграда Компания Строй Прогресс Сервис. Строительство домов под ключ
Компания Строй Прогресс Сервис. Строительство домов под ключ Основные сведения о насосах
Основные сведения о насосах Зимующие и перелетные птицы
Зимующие и перелетные птицы