Содержание
- 2. Актуализировать знания учащихся о природных полимерах на примере белков. Познакомить с составом, строением, свойствами и функциями
- 3. БЕЛКИ «Во всех растениях и животных присутствует некое вещество, которое без сомнения является наиболее важным из
- 4. Белки – азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
- 5. Белки наряду с углеводами и жирами являются основной составной частью нашей пищи.
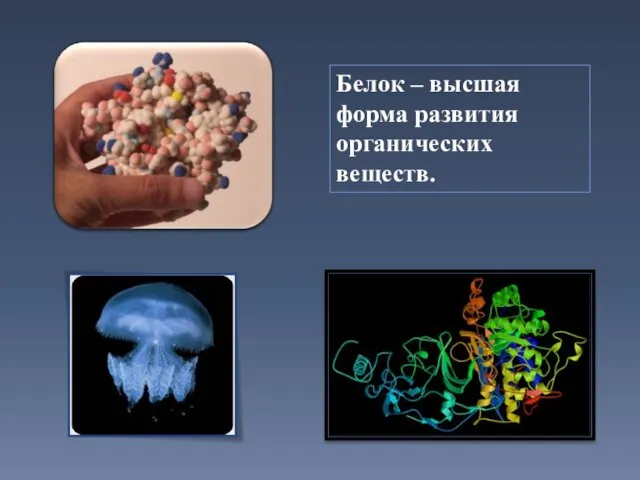
- 6. Белок – высшая форма развития органических веществ.
- 7. Название белки получили от яичного белка. В древнем Риме яичный белок применялся как лечебное средство. Подлинная
- 8. Итальянец Якопо Бартоломео Беккари в 1728 г. впервые выделил белок (в виде клейковины) из пшеничной муки.
- 9. 1747 год - французский физиолог Франсуа Кене впервые применил термин «белковый» к жидкостям живого организма. Франсуа
- 10. 1751 год – термин белковый (albumineise) вошел в «Энциклопедию» Д.Дидро и Ж.Аламбера Жан Д’Аламбер (1717-1783 гг).
- 11. Антуан Франсуа де Фуркруа - французский химик, основоположник изучения белков. Антуан Франсуа де Фуркруа (1755 г.
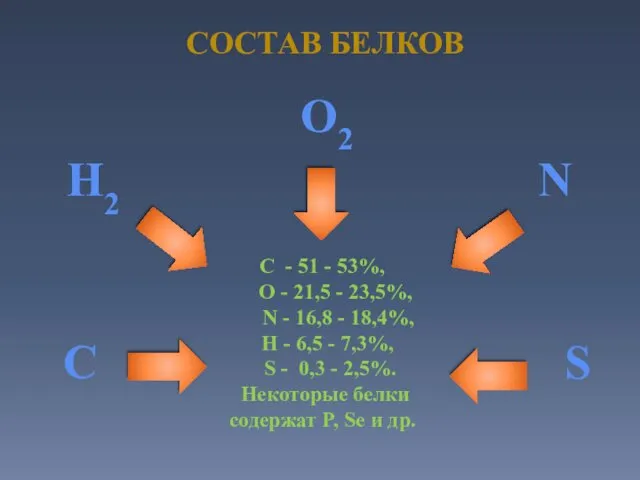
- 12. СОСТАВ БЕЛКОВ O2 N C H2 S C - 51 - 53%, O - 21,5 -
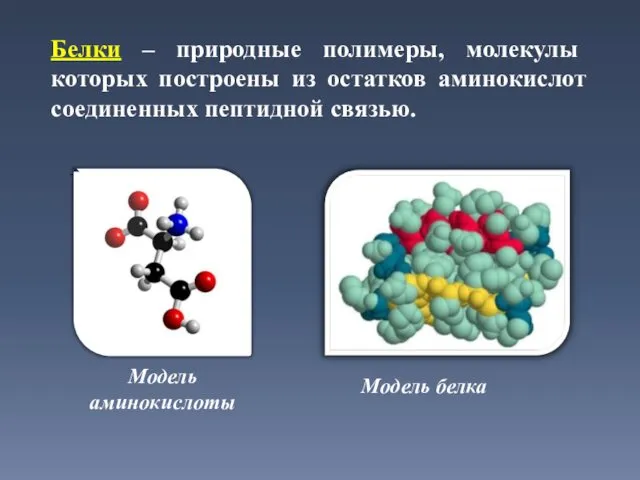
- 13. Белки – природные полимеры, молекулы которых построены из остатков аминокислот соединенных пептидной связью. Модель белка Модель
- 14. СТРОЕНИЕ НЕКОТОРЫХ АМИНОКИСЛОТ, ВЫДЕЛЕННЫХ ИЗ БЕЛКОВ
- 15. В 1902 году немецкий химик Фишер Эмиль Герман предложил пептидную теорию строения белка. Фишер Эмиль Герман
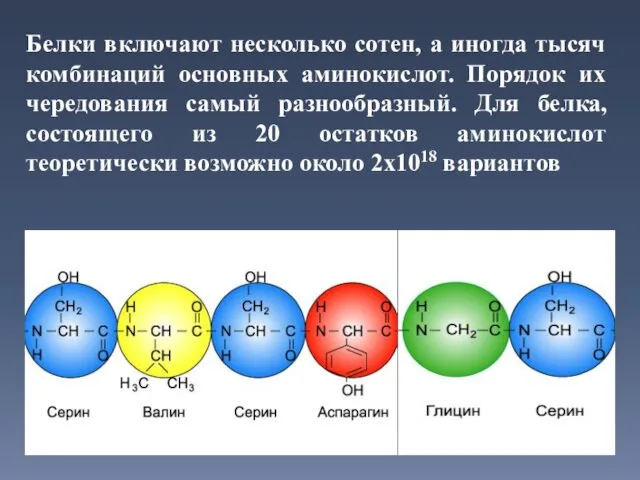
- 16. Белки включают несколько сотен, а иногда тысяч комбинаций основных аминокислот. Порядок их чередования самый разнообразный. Для
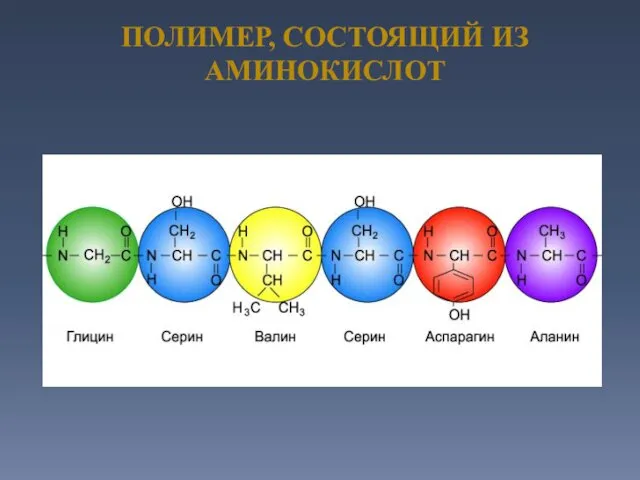
- 17. ПОЛИМЕР, СОСТОЯЩИЙ ИЗ АМИНОКИСЛОТ
- 18. Цепь, состоящую из большого числа соединенных друг с другом аминокислотных остатков называют полипептидной. В ее состав
- 19. КЛАССИФИКАЦИЯ БЕЛКОВ ПО СОСТАВУ Протеины Протеиды Состоят из остатков аминокислот Состоят из остатков аминокислот + небелковые
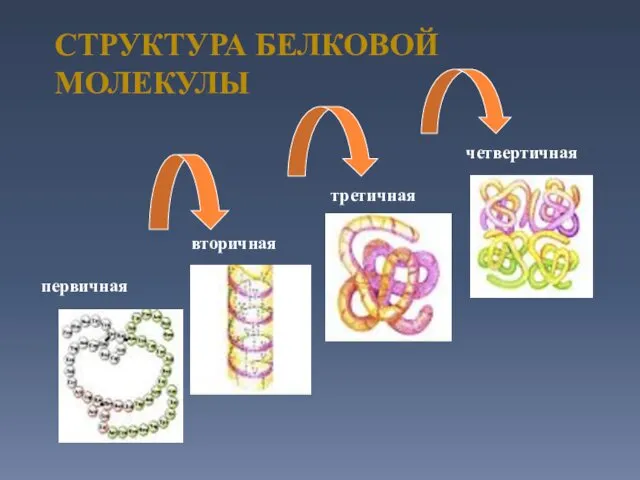
- 20. СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ первичная вторичная третичная четвертичная
- 21. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА Последовательность аминокислотных остатков в полипептидной цепи соединенных между собой пептидными связями. .
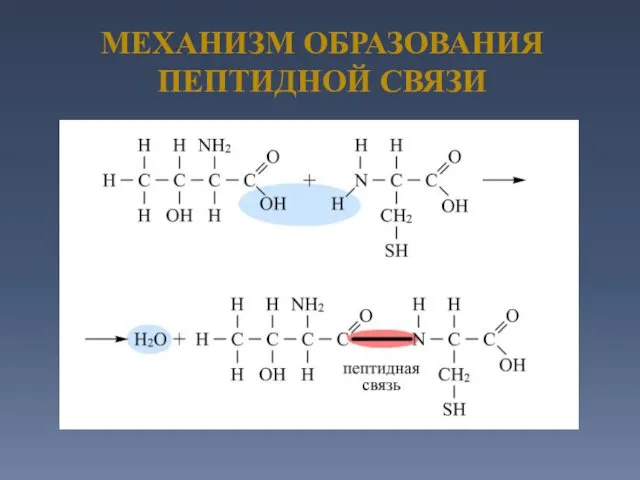
- 22. МЕХАНИЗМ ОБРАЗОВАНИЯ ПЕПТИДНОЙ СВЯЗИ
- 23. В 1888 году русский биохимик Данилевский А.Я. предложил существование в белках пептидных связей. Данилевский А.Я. (1838-1923гг.)
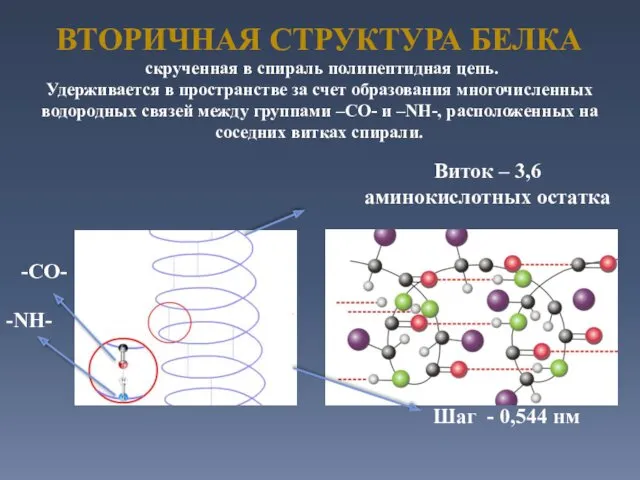
- 24. Виток – 3,6 аминокислотных остатка Шаг - 0,544 нм -CO- -NH- ВТОРИЧНАЯ СТРУКТУРА БЕЛКА скрученная в
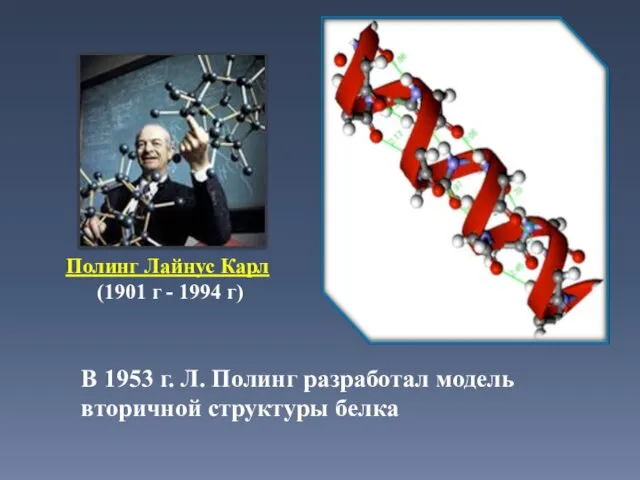
- 25. Полинг Лайнус Карл (1901 г - 1994 г) В 1953 г. Л. Полинг разработал модель вторичной
- 26. Третичная структура Реальная трехмерная конфигурация закрученной в пространстве спирали полипептидной цепи (т. е. спираль, скрученная в
- 27. Дисульфидные мостики (-S-S-) между атомами серы(между двумя остатками цистеина различных участков цепи), сложноэфирные мостики между карбоксильной
- 28. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА Форма взаимодействия между несколькими полипептидными цепями.
- 29. ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ Денатурация белка Гидролиз белка Цветные реакции на белок
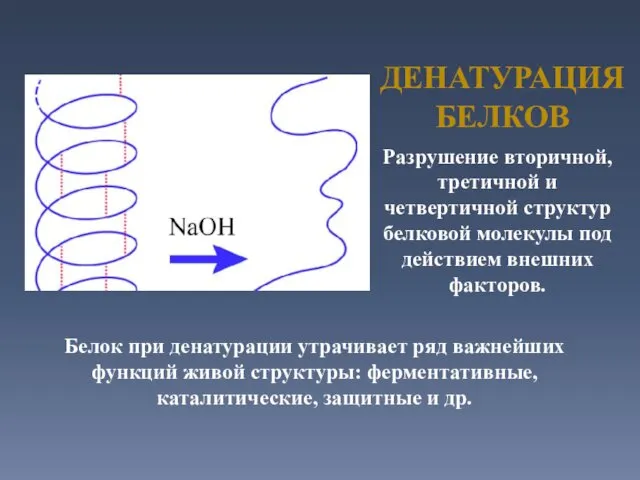
- 30. ДЕНАТУРАЦИЯ БЕЛКОВ Белок при денатурации утрачивает ряд важнейших функций живой структуры: ферментативные, каталитические, защитные и др.
- 31. ДЕНАТУРАЦИЯ БЕЛКОВ Факторы вызывающие денатурацию: температура, механическое воздействие, действие химических веществ и др.
- 32. ОБРАТИМАЯ ДЕНАТУРАЦИЯ БЕЛКА (ВЫСАЛИВАНИЕ)
- 33. НЕОБРАТИМАЯ ДЕНАТУРАЦИЯ БЕЛКА ПРИ НАГРЕВАНИИ
- 34. НЕОБРАТИМАЯ ДЕНАТУРАЦИЯ БЕЛКА ПОД ДЕЙСТВИЕМ КИСЛОТ
- 35. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛОК Биуретовая реакция Ксантопротеиновая реакция Фиолетовое окрашивание солями меди (II) в щелочном растворе
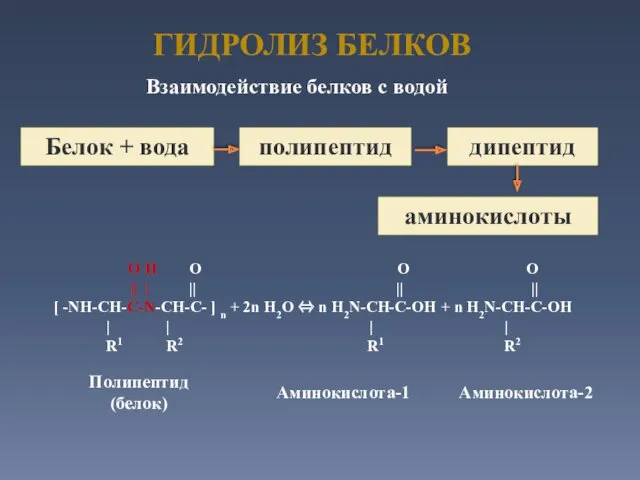
- 36. ГИДРОЛИЗ БЕЛКОВ O H O O O || | || || || [ -NH-CH-C-N-CH-C- ] n
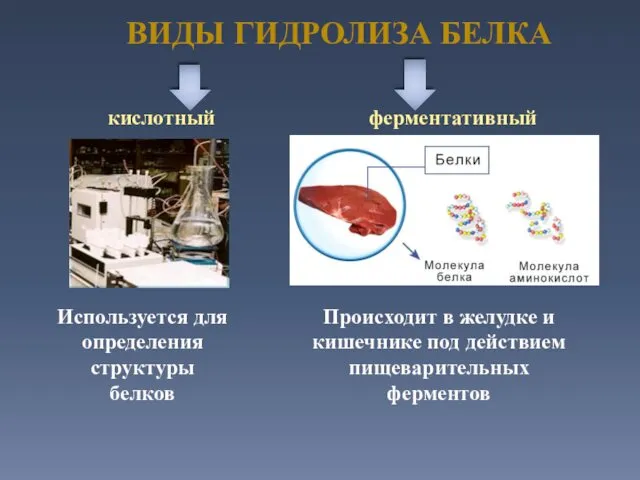
- 37. ВИДЫ ГИДРОЛИЗА БЕЛКА кислотный ферментативный Происходит в желудке и кишечнике под действием пищеварительных ферментов Используется для
- 38. Учеными полностью определена структура некоторых белков: гормона инсулина, антибиотика грамицидина, миоглобина, гемоглобина и т. д.
- 39. В 1962 г. М.Ф. Перуц и Д.К. Кендырю были удостоены Нобелевской премии за исследования в области
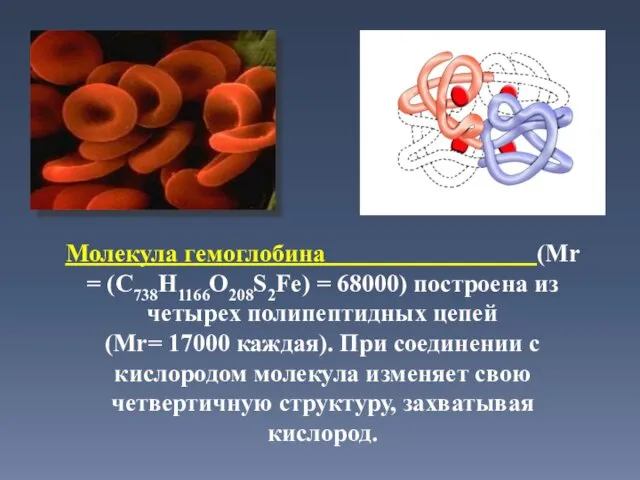
- 40. Молекула гемоглобина (Mr = (C738H1166O208S2Fe) = 68000) построена из четырех полипептидных цепей (Mr= 17000 каждая). При
- 41. В 1954г. Фредерик Сэнгер расшифровал аминокислотную последовательность в инсулине. В 1958г. ученому была присуждена Нобелевская премия
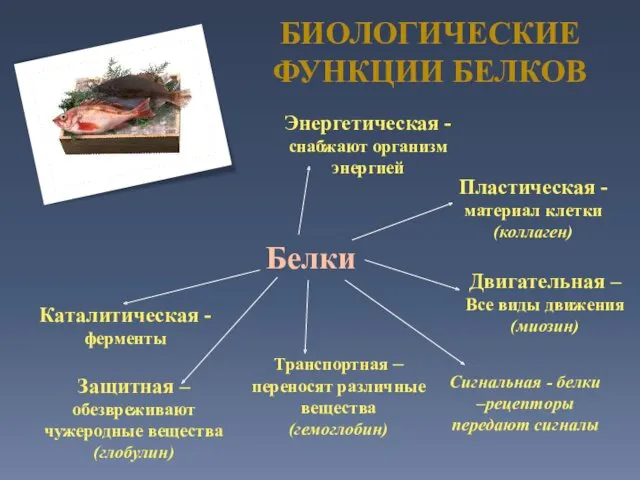
- 42. БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ Белки Каталитическая -ферменты Защитная – обезвреживают чужеродные вещества (глобулин) Транспортная – переносят различные
- 43. При полном расщеплении 1 грамма белка освобождается 17,6 кДж энергии
- 44. БЕЛКИ – важнейшие компоненты пищи животных и человека. Пищевая ценность белков определяется содержанием в них незаменимых
- 45. Менее ценны растительные белки. Они беднее лизином, метионином, триптофаном, труднее перевариваются в желудочно-кишечном тракте. В процессе
- 46. ПОЛНОЦЕННЫЕ И НЕПОЛНОЦЕННЫЕ БЕЛКИ Полноценные белки – это те, в состав которых входят все незаменимые аминокислоты.
- 47. Белки - обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются
- 48. «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их
- 50. Скачать презентацию






























 Resemiotization in Mindhunter
Resemiotization in Mindhunter Эксплуатация систем вентиляции зданий. Требования и мероприятия
Эксплуатация систем вентиляции зданий. Требования и мероприятия вебинар по практике
вебинар по практике Системы автоматического управления и регулирования. Автоматизированное управление ХТС. Лекция 2
Системы автоматического управления и регулирования. Автоматизированное управление ХТС. Лекция 2 Кто хочет стать миллионером. Игра для учеников 7 класса
Кто хочет стать миллионером. Игра для учеников 7 класса Полисахариды. Целлюлоза
Полисахариды. Целлюлоза Процессуальное право: административная юрисдикция, конституционное судопроизводство
Процессуальное право: административная юрисдикция, конституционное судопроизводство Система и структура государственного управления
Система и структура государственного управления СВОП-контракты. Экономическое понимание
СВОП-контракты. Экономическое понимание Жизнь и творчество Василия Макаровича Шукшина
Жизнь и творчество Василия Макаровича Шукшина Презентация Гимнастика для глаз-1 Диск
Презентация Гимнастика для глаз-1 Диск Предел функции
Предел функции План и поисковые маркетинговые исследования: вторичная информация
План и поисковые маркетинговые исследования: вторичная информация Передовые производственные технологии
Передовые производственные технологии Введение во Храм Пресвятой Богородицы. Гимнография
Введение во Храм Пресвятой Богородицы. Гимнография Кружковая работа по театральной деятельности (старший дошкольный возраст)
Кружковая работа по театральной деятельности (старший дошкольный возраст) Презентация Архипо-Осиповский дельфинарий
Презентация Архипо-Осиповский дельфинарий Классный час с презентацией на тему Олимпиада 2014
Классный час с презентацией на тему Олимпиада 2014 Основные элементы письма. Слайды
Основные элементы письма. Слайды Панорама опыта Профессиональная деятельность
Панорама опыта Профессиональная деятельность презентация Наш дружный 10 класс
презентация Наш дружный 10 класс ПРЕЗЕНТАЦІЯ Припинення іпотеки
ПРЕЗЕНТАЦІЯ Припинення іпотеки Острая сердечная недостаточность
Острая сердечная недостаточность Внутренние воды России. Реки
Внутренние воды России. Реки Шероховатость поверхности
Шероховатость поверхности Шаблон Рамка
Шаблон Рамка День Матери
День Матери Детям о Великой Отечественной войне
Детям о Великой Отечественной войне