Содержание
- 2. Положение в периодической таблице. В периодической системе находятся в главной подгруппе II группы. Являются сильными восстановителями,
- 3. Положение в периодической таблице Be Mg Ca Sr Ba Ra Восстановительные свойства усиливаются
- 4. Строение атома +4 ) ) +12 ) ) ) +20 ) ) ) ) +38 )
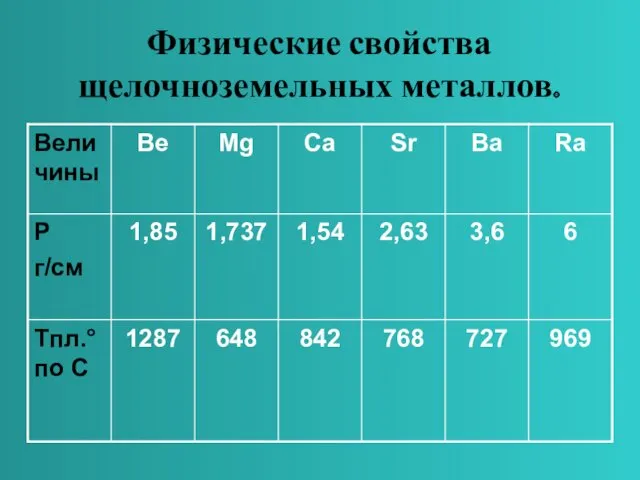
- 5. Физические свойства щелочноземельных металлов Щелочноземельные металлы – серебристо-белые, твёрдые вещества. По сравнению со щелочными металлами обладают
- 6. Физические свойства щелочноземельных металлов.
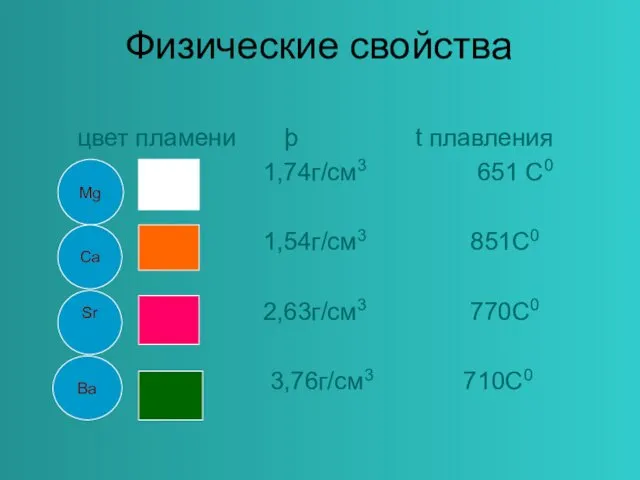
- 7. Физические свойства цвет пламени þ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0
- 8. Нахождение в природе Бериллий: 3BeO • Al2O3 • 6SiO2 – берилл Магний: MgCO3 – магнезит Кальций:
- 9. Химические свойства С простыми веществами(неметаллами) 2Me0 +O2 → 2Me+2O-2 - оксид Me0 +H2 → Me+2H2 -
- 10. * Химические свойства 2. Бериллий с водой не реагирует, магний реагирует медленно, остальные металлы реагируют с
- 11. Соединения щелочноземельных металлов Оксиды щелочноземельных металлов –МеО, имеют основный характер, легко реагируют с оксидами неметаллов с
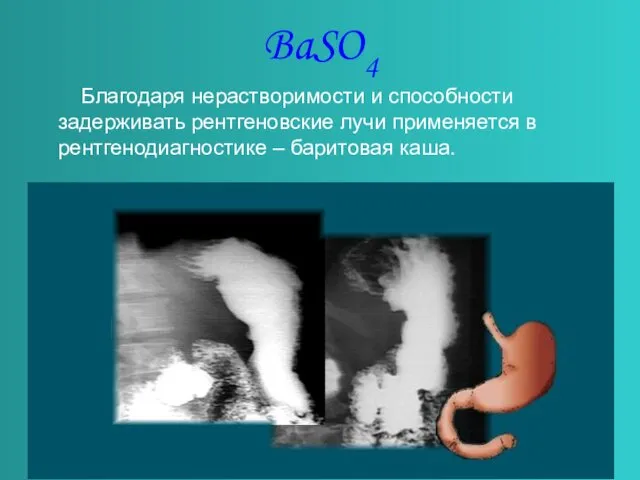
- 12. BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
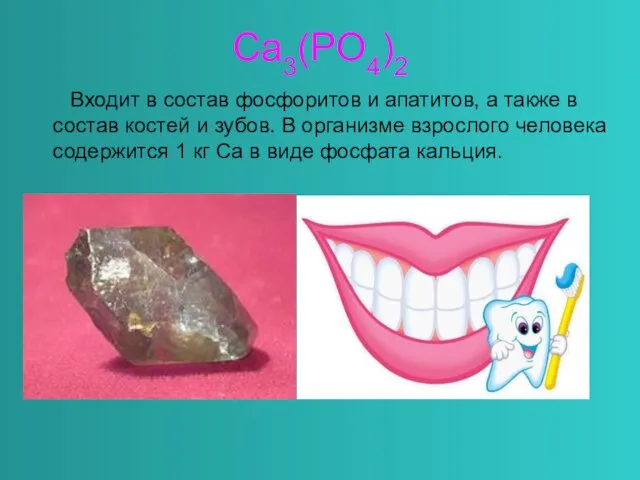
- 13. Ca3(PO4)2 Входит в состав фосфоритов и апатитов, а также в состав костей и зубов. В организме
- 14. CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы –
- 15. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в
- 16. MgCO3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы
- 17. Са(ОН)2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется
- 18. Проверь себя (работа с таблицей Д.И. Менделеева) Сравните атомы элементов, поставив знаки или = вместо *:
- 19. * Дополните схемы взаимодействия щелочных металлов с неметаллами общими формулами и названиями продуктов реакции. Запишите конкретные
- 21. Скачать презентацию














 Макет одноступенчатой зубчатой передачи
Макет одноступенчатой зубчатой передачи Послетестовое консультирование при обследовании на ВИЧ - инфекцию
Послетестовое консультирование при обследовании на ВИЧ - инфекцию Пневмонии. Бронхиальная астма. Хроническая обструктивная болезнь легких. Основные клинические проявления. Диагностика
Пневмонии. Бронхиальная астма. Хроническая обструктивная болезнь легких. Основные клинические проявления. Диагностика Методика работы с отрядом
Методика работы с отрядом Русская художественная культура пореформенной эпохи 2-ой половины ХIХ века. Живопись
Русская художественная культура пореформенной эпохи 2-ой половины ХIХ века. Живопись Бакчада экологик тәрбия
Бакчада экологик тәрбия Работа методом проекта
Работа методом проекта История одного рассказа
История одного рассказа Местное самоуправление в Российской Федерации
Местное самоуправление в Российской Федерации Философия науки. (Лекция 7)
Философия науки. (Лекция 7) ВШЭУ Кафедра: Финансы, денежное обращение и кредит. Подготовка конкурентоспособных работников
ВШЭУ Кафедра: Финансы, денежное обращение и кредит. Подготовка конкурентоспособных работников Алфавит в картинках
Алфавит в картинках Использование возобновляемой энергетики: страны, начавшие переход с истощимых источников энергии на ветроэнергетику
Использование возобновляемой энергетики: страны, начавшие переход с истощимых источников энергии на ветроэнергетику Дифференциальное исчисление. Начала Математического анализа. Лекция 1
Дифференциальное исчисление. Начала Математического анализа. Лекция 1 Автоматизация нагревательных установок. (Тема 12)
Автоматизация нагревательных установок. (Тема 12) Синтезы с образованием связи С(3)-С(4)
Синтезы с образованием связи С(3)-С(4) Сложноподчинённые предложения с придаточными условными
Сложноподчинённые предложения с придаточными условными Русские обычаи. Праздник Ивана Купалы.
Русские обычаи. Праздник Ивана Купалы. Актуальность (проблема) проекта
Актуальность (проблема) проекта Группа 18ИП12. Родительское собрание
Группа 18ИП12. Родительское собрание Использование цифровых лабораторий Архимед в учебном процессе
Использование цифровых лабораторий Архимед в учебном процессе Предмет и методы биомедицинской этики. Этика науки и профессиональная этика. Исторические модели биомедицинской этики
Предмет и методы биомедицинской этики. Этика науки и профессиональная этика. Исторические модели биомедицинской этики Тукайга килэ халык...
Тукайга килэ халык... Презентации к родительским собраниям
Презентации к родительским собраниям Священные книги религий мира. Тора, Библия, Коран
Священные книги религий мира. Тора, Библия, Коран PERTime-tabl
PERTime-tabl Искусство и мораль
Искусство и мораль Судебная система в Российской Федерации
Судебная система в Российской Федерации