Содержание
- 2. Секвенирование путем синтеза с обратным терминированием (Illumina) Метод основан на детекции флюорофора при присоединении каждого нового
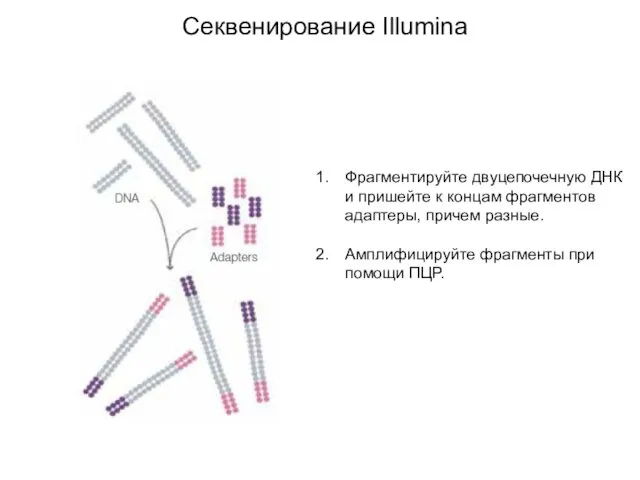
- 3. Секвенирование Illumina Фрагментируйте двуцепочечную ДНК и пришейте к концам фрагментов адаптеры, причем разные. Амплифицируйте фрагменты при
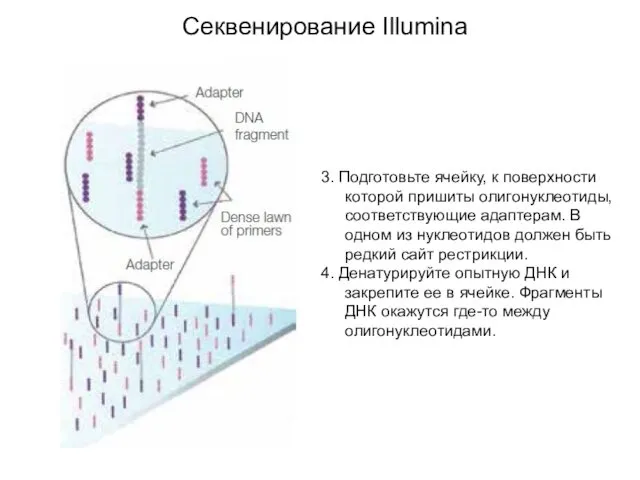
- 4. Секвенирование Illumina 3. Подготовьте ячейку, к поверхности которой пришиты олигонуклеотиды, соответствующие адаптерам. В одном из нуклеотидов
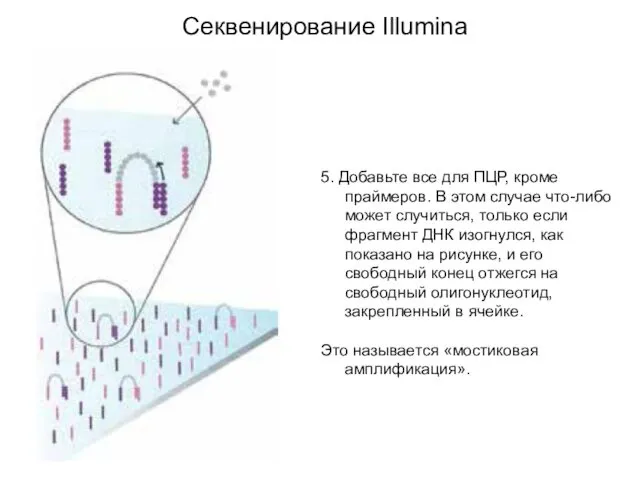
- 5. Секвенирование Illumina 5. Добавьте все для ПЦР, кроме праймеров. В этом случае что-либо может случиться, только
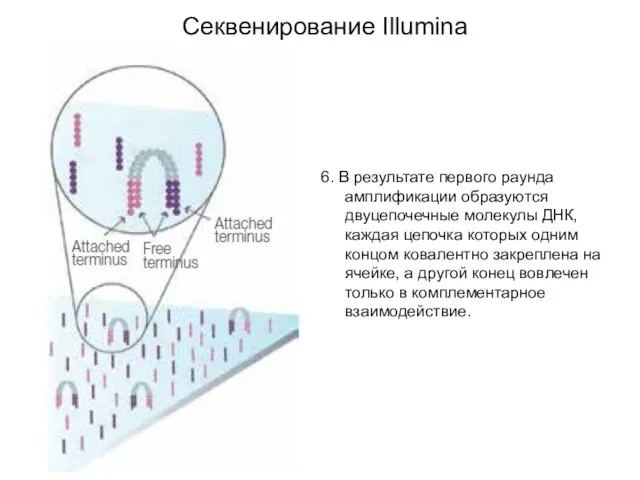
- 6. 6. В результате первого раунда амплификации образуются двуцепочечные молекулы ДНК, каждая цепочка которых одним концом ковалентно
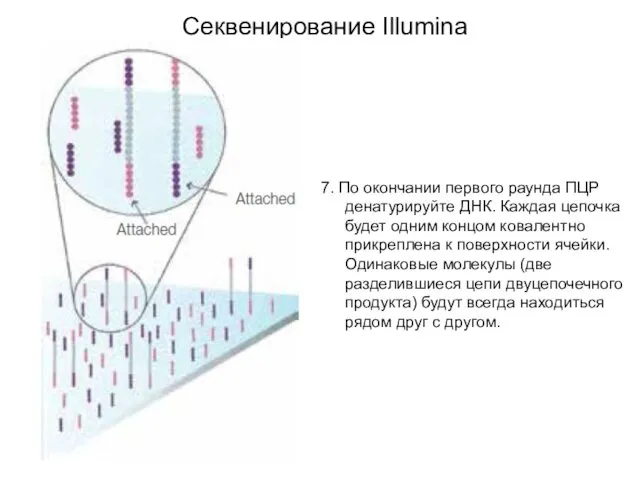
- 7. 7. По окончании первого раунда ПЦР денатурируйте ДНК. Каждая цепочка будет одним концом ковалентно прикреплена к
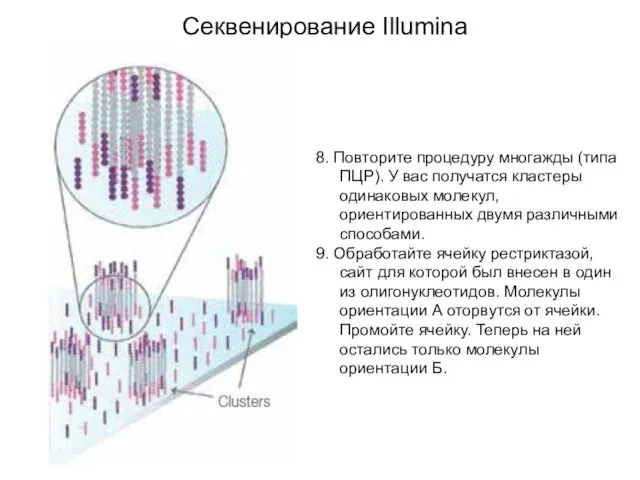
- 8. 8. Повторите процедуру многажды (типа ПЦР). У вас получатся кластеры одинаковых молекул, ориентированных двумя различными способами.
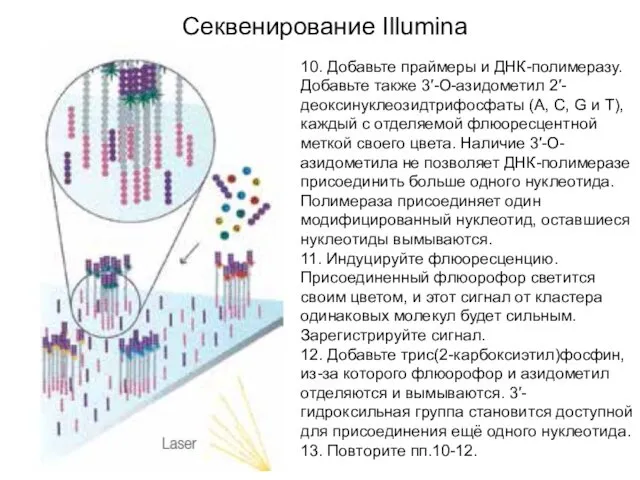
- 9. 10. Добавьте праймеры и ДНК-полимеразу. Добавьте также 3′-O-азидометил 2′-деоксинуклеозидтрифосфаты (A, C, G и T), каждый с
- 10. Необходима точная оценка концентрации библиотеки • qPCR – необходима стадия контроля качества! Амплификация вызывает «перекос» в
- 11. • секвенирование геномов и транскриптомов de novo отправная точка большинства молекулярно-биологических и генетических исследований на немодельных
- 12. Особенности: • диапазон размеров геномов эукариот – от 2.9 миллионов до 150 миллиардов • повторы •
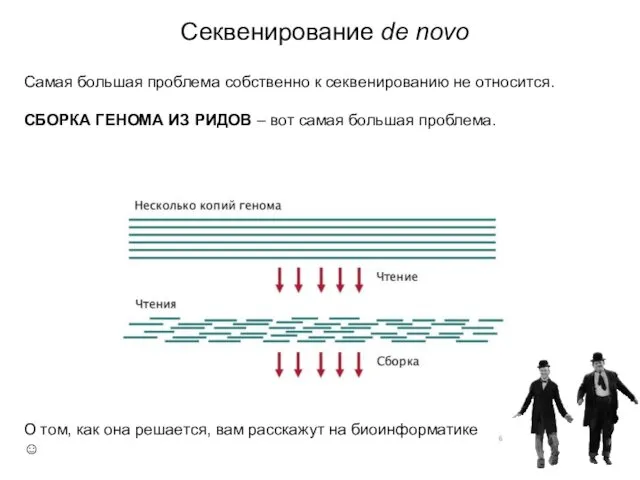
- 13. Секвенирование de novo Самая большая проблема собственно к секвенированию не относится. СБОРКА ГЕНОМА ИЗ РИДОВ –
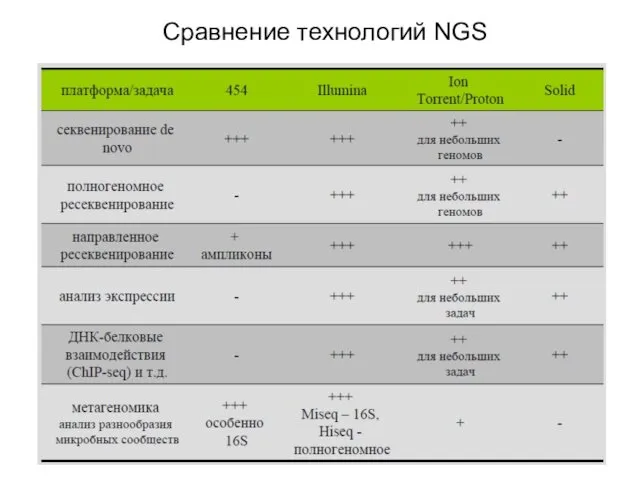
- 14. Сравнение технологий NGS
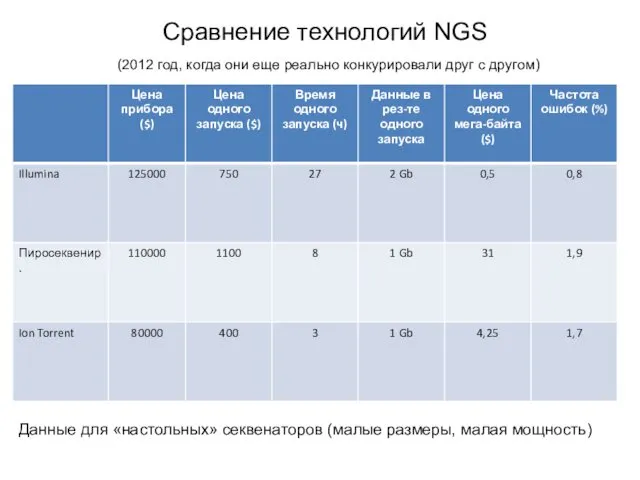
- 15. Сравнение технологий NGS (2012 год, когда они еще реально конкурировали друг с другом) Данные для «настольных»
- 16. Секвенирование третьего поколения (TGS) Технологии TGS начали развиваться совсем недавно. Первые научные работы на эту тему
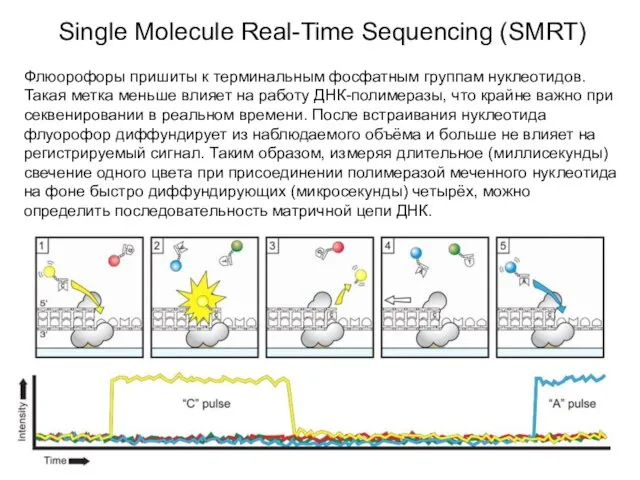
- 17. Single Molecule Real-Time Sequencing (SMRT) Прибор производит компания Pacific Biosystems. Технология основана на жестком закреплении ДНК-полимеразы
- 18. Single Molecule Real-Time Sequencing (SMRT) Флюорофоры пришиты к терминальным фосфатным группам нуклеотидов. Такая метка меньше влияет
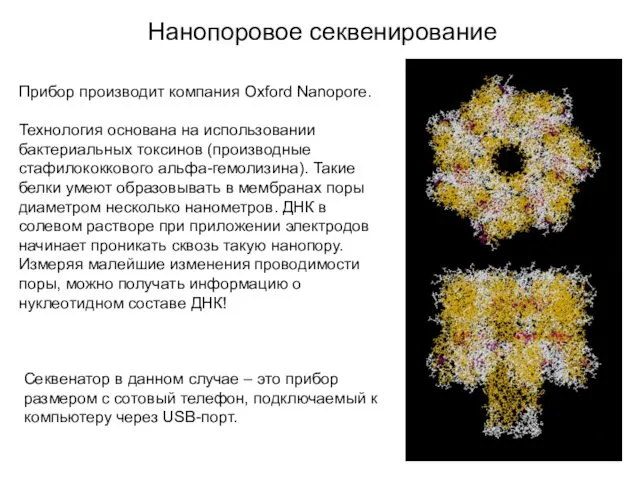
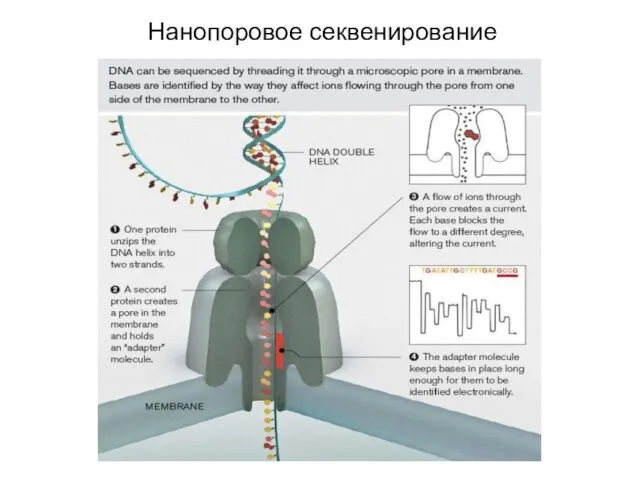
- 19. Нанопоровое секвенирование Прибор производит компания Oxford Nanopore. Технология основана на использовании бактериальных токсинов (производные стафилококкового альфа-гемолизина).
- 20. Нанопоровое секвенирование Секвенатор MinION от Oxford Nanopore стоимостью 1500 долларов!!!!!!11
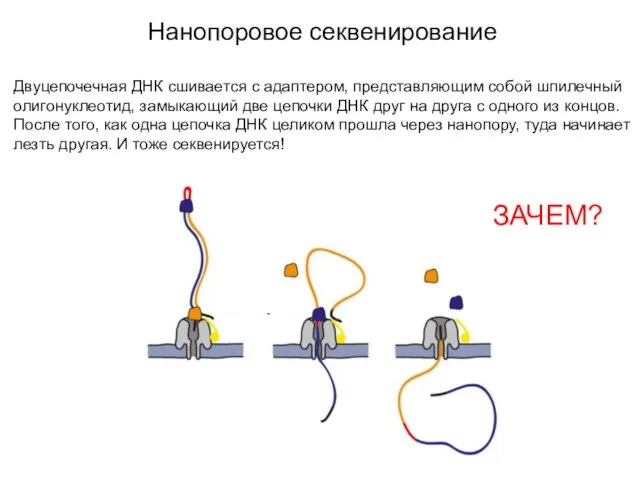
- 21. Нанопоровое секвенирование Двуцепочечная ДНК сшивается с адаптером, представляющим собой шпилечный олигонуклеотид, замыкающий две цепочки ДНК друг
- 22. Нанопоровое секвенирование В каждый момент времени детектируется изменение проводимости от 5-нуклеотидного участка ДНК. В следующий момент
- 23. Нанопоровое секвенирование
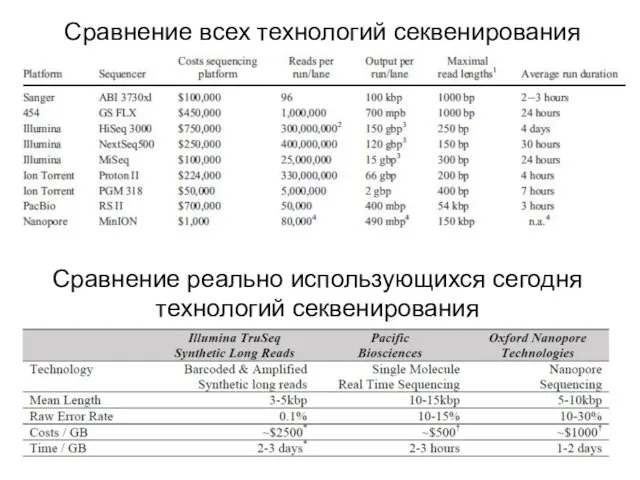
- 24. Сравнение всех технологий секвенирования Сравнение реально использующихся сегодня технологий секвенирования
- 26. Скачать презентацию








 Running production facilities
Running production facilities Перенос слов. Словарная работа
Перенос слов. Словарная работа Призентация Амонашвили Шалва Александрович
Призентация Амонашвили Шалва Александрович Основные признаки технологии
Основные признаки технологии Основные информационные процессы и их реализация с помощью компьютера
Основные информационные процессы и их реализация с помощью компьютера Нарушения полового развития девочек
Нарушения полового развития девочек Организация опытно-экспериментальной деятельности дошкольников
Организация опытно-экспериментальной деятельности дошкольников Детские пособия 2020.Таблица изменений
Детские пособия 2020.Таблица изменений Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12
Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12 Работа над дикцией и артикуляцией: игровые приемы
Работа над дикцией и артикуляцией: игровые приемы Треугольники. Построение треугольника по трём сторонам. Периметр треугольника. 5 класс,
Треугольники. Построение треугольника по трём сторонам. Периметр треугольника. 5 класс, Слайд-лекция №29. Противоаллергические и антигистаминные препараты
Слайд-лекция №29. Противоаллергические и антигистаминные препараты Реализация ФГОС нового поколения в условиях целостного педагогического подхода
Реализация ФГОС нового поколения в условиях целостного педагогического подхода Принципы построения спутниковых радионавигационных систем
Принципы построения спутниковых радионавигационных систем Японские кроссворды
Японские кроссворды Замена горелок на газовых котлах
Замена горелок на газовых котлах Подготовка студенческих работ для размещения в электронной среде
Подготовка студенческих работ для размещения в электронной среде Функциональные неврологические расстройства - психоневрологический континуум
Функциональные неврологические расстройства - психоневрологический континуум STH group - лучшие в подборе персонала
STH group - лучшие в подборе персонала Мои домашние питомцы. Проект
Мои домашние питомцы. Проект Родительское собрание :От несделанных уроков к конфликтам в семье. Приготовление домашних заданий
Родительское собрание :От несделанных уроков к конфликтам в семье. Приготовление домашних заданий Фердинанд де Соссюр
Фердинанд де Соссюр Спортивная борьба Грэпплинг
Спортивная борьба Грэпплинг Презентация к занятию Указатели поворотов
Презентация к занятию Указатели поворотов Неорганические вещества, входящие в состав клетки
Неорганические вещества, входящие в состав клетки Мой профессиональный выбор
Мой профессиональный выбор Гравитационное взаимодействие. Закон всемирного тяготения. Сила тяжести
Гравитационное взаимодействие. Закон всемирного тяготения. Сила тяжести Матрицы. Определитель матрицы
Матрицы. Определитель матрицы