Слайд 2

Требуемая
GMP
документация
Досье производственной
площадки:
документ,в котором описана деятельность производителя, имеющая отношение
к настоящим Правилам.
Типы регламентирующих документов (руководства и требования):
Спецификации:
документы, содержащие подробные требования,
которым должны соответствовать исходные и
упаковочные материалы и
продукция, использующиеся или получаемые при производстве.
Они являются основой для оценки качества лекарственных препаратов.
Слайд 3

Производственные рецептуры, технологические инструкции,
инструкции по упаковке, методики
испытаний:
документы, содержащие подробную информацию
обо всем
используемом исходном сырье, оборудовании и компьютеризированных
системах (при их наличии); в них должны содержаться все инструкции по
осуществлению технологических процессов, упаковке, отбору проб и
пров
едению испытаний.
Слайд 4

Процедуры
(стандартные операционные процедуры (СОПы):
документы, содержащие требования
по выполнению определенных операций.
Протоколы:
документы, содержащие
требования
по проведению и
регистрации отдельных операци
Слайд 5

Технические соглашения:
соглашения, заключенные
между заказчиками и исполнителями относительно работ, которые
выполняются сторонними организациями (аутсорсинг).
Типы регистрирующих документов
(записи/отчеты):
Записи: свидетельства, подтверждающие выполнение различных действий для доказательства соответствия инструкциям, например, мероприятий, происшествий, расследований; для произведенныхсерий
содержащие историю каждой серии продукции, включая ее реализацию.
Записи содержат исходные данные, используемые для формирования других
записей. В случае электронных записей определять, какие данные следует
использовать в качестве исходных, должны установленные пользователи. По
крайней мере, все данные, на которых основываются
решения по качеству, должны определяться в качестве исходных данных.
Слайд 6

Сертификаты анализа:
документы(паспорта, аналитические листки, другие документы), содержащие резюме
результатов испытаний образцов
продукции или материалов вместе с оценкой соответствия
установленной
спецификации. Как альтернатива оценка соответствия серии утвержденному регистрационному
досье может быть основана (целиком или частично) на анализе данных, параметров и результатов, полученных в реальном времени (резюме и отчеты об отклонениях). Такой подход применим, если при производстве серии
используется процессно аналитическая технология
Отчеты:
документы, сопровождающие выполнение конкретных заданий, проектов или расследований вместе с результатами, выводами и
рекомендациями
Слайд 7

Управление документацией
Документы должны тщательно разрабатываться, подготавливаться,
согласовываться и распространяться.
В зависимости
от вида они должны отвечать требованиям соответствующих частей спецификаций исследуемого препарата, регистрационного досье, а также документов, подаваемых для получения лицензии на производство. Документы могут быть в смешанных формах, например, некоторые элементы
в электронном виде, а другие на бумажном носителе.
Слайд 8

Управление документацией
Регламентирующие документы должны быть утверждены и подписаны лицами, имеющими право
подписи, с указанием даты.
Содержание документов должно быть однозначным; документы должны иметь уникальную идентификацию.
Должна быть определена дата введения в
действие.
Слайд 9

Оборудование
Производственное оборудование не должно
представлять никакой опасности для продукции. Части производственного
оборудования,
контактирующие с продукцией, не должны вступать с ней в реакцию, выделять или абсорбировать вещества в такой степени, чтобы это могло повлиять на качество продукции и создавать, таким образом, какую либо опасность.








 Конспект урока и презентация Почитай родителей
Конспект урока и презентация Почитай родителей Заболевания печени
Заболевания печени Тревожные дети тревожных родителей
Тревожные дети тревожных родителей Ароматерапія – медицина майбутнього
Ароматерапія – медицина майбутнього Становление христианства и развитие больничного дела
Становление христианства и развитие больничного дела Логопедическая работа с учащимися 1 классов.
Логопедическая работа с учащимися 1 классов. Работа ученицы Первая железная дорога
Работа ученицы Первая железная дорога Элементы дизайна
Элементы дизайна Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства
Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства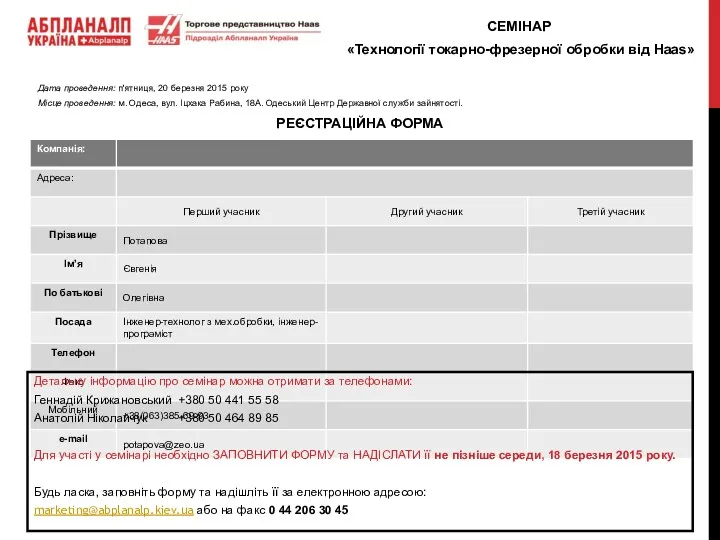 заявка на семинар
заявка на семинар Будь осторожен с огнём!
Будь осторожен с огнём! Culture and International Public Relations
Culture and International Public Relations Комплексные методы управления качеством
Комплексные методы управления качеством Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов
Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов Ряд Фурье и интеграл Фурье
Ряд Фурье и интеграл Фурье Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска
Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска Телефон доверия для детей и подростков, и их родителей
Телефон доверия для детей и подростков, и их родителей Робототехника в нашей жизни
Робототехника в нашей жизни sohrani_moyu_i_svoyu_zhizn
sohrani_moyu_i_svoyu_zhizn Выводы логики высказываний (2)
Выводы логики высказываний (2) Составляющие и функции операционной системы Linux
Составляющие и функции операционной системы Linux золотая хохлома
золотая хохлома Перекрытия и полы малоэтажных зданий
Перекрытия и полы малоэтажных зданий Поздравление с Днем рождения
Поздравление с Днем рождения Единицы времени 2. Календарь. 2 класс
Единицы времени 2. Календарь. 2 класс Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара)
Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара) Термообработка деревянного реквизита
Термообработка деревянного реквизита Характеристики позиционных систем счисления
Характеристики позиционных систем счисления