Содержание
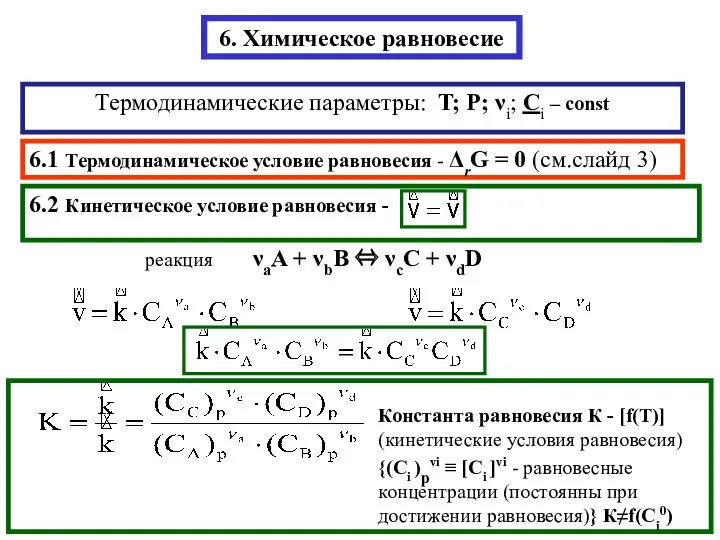
- 2. 6. Химическое равновесие Термодинамические параметры: T; P; νi; Сi – const 6.1 Термодинамическое условие равновесия -
- 3. Энергия Гиббса реакции в нестандартных условиях Сi ≠ С0 ΔrGi =ΔrG0i + R⋅T⋅lnCi ΔrG = (νc⋅ΔfG0C+
- 4. 6.1 Равновесие – термодинамические условия (ΔrG = 0 )* [Равновесные концентрации (Ci )pvi - постоянны]
- 5. Сдвиг равновесия. Определение направления сдвига. Правило Ле Шателье Равновесие νаA + νbB ↔ νсC + νdD
- 6. Константа равновесия К, её размерность. Связь между К [кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [термодинам.К0–f(T, т/д функций)]
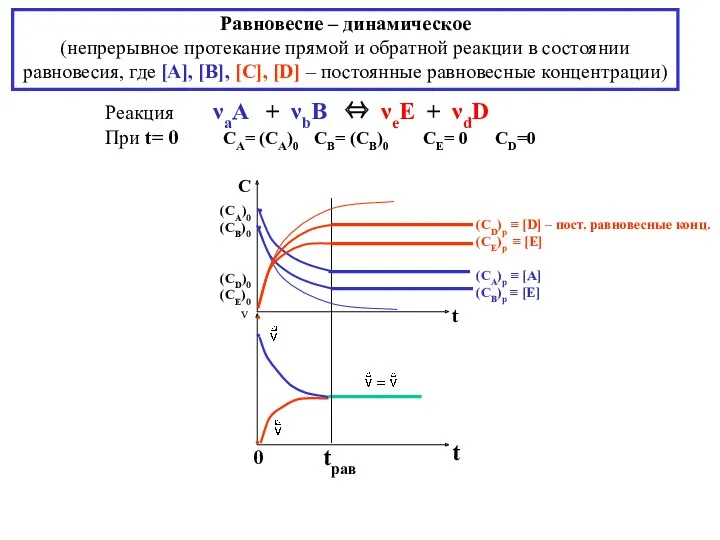
- 7. Равновесие – динамическое (непрерывное протекание прямой и обратной реакции в состоянии равновесия, где [A], [B], [C],
- 8. Расчет равновесного состава(концентраций) газовой смеси Расчет К0(Т) термодинамической → Для определенной Т рассчитывают ∆rG0 (T) ΔrG0(T)=ΔrH0(T)
- 9. 3. Пример расчета равновесного состава (через мольные доли Хi →К Х ). Диссоциация АВ при Р
- 10. Равновесие в растворах (дисперсных системах)
- 11. Электролитическая диссоциация С0 - общая концентрация СД - конц.молекул в виде ионов Сильн.: α →1 КД
- 12. Ионное произведение воды Kw = [H+]⋅ [OH–] H2O ⇔ H+ + OH- - слабый электролит Нейтральная
- 13. Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая среда pH Щелочная среда pH
- 14. Растворы кислот и оснований МеOH ⇔ Ме+ + OH- Слабые электролиты α → 0 Сильные электролиты
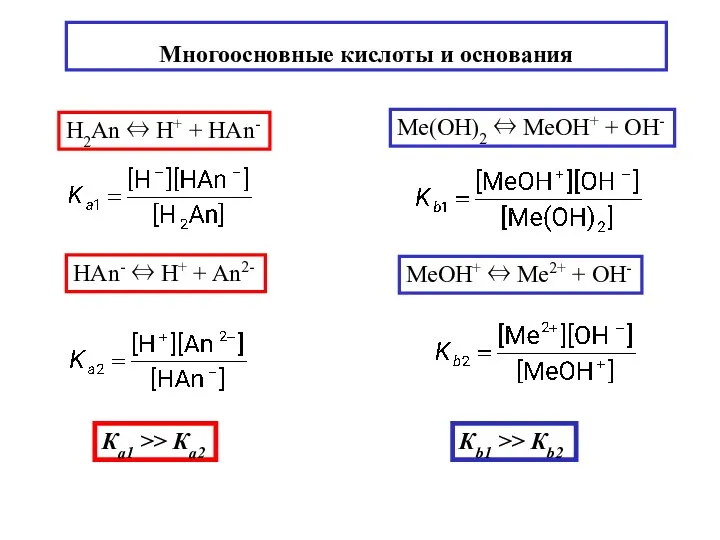
- 15. Многоосновные кислоты и основания H2An ⇔ H+ + НAn- HAn- ⇔ H+ + An2- Ка1 >>
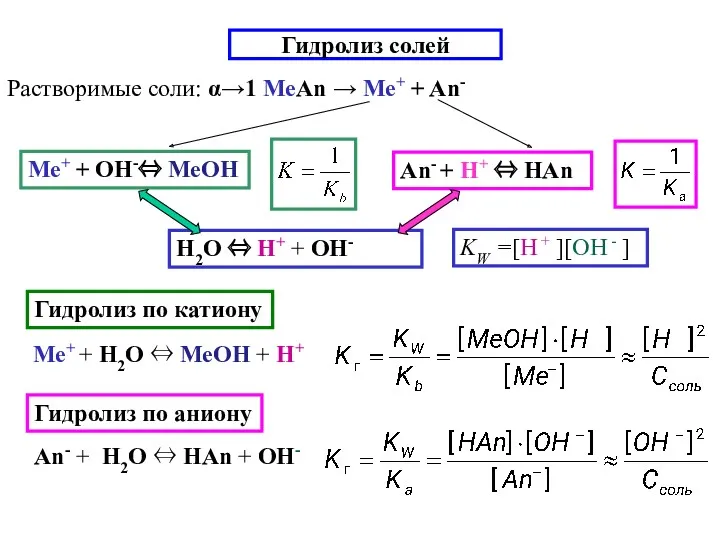
- 16. Гидролиз солей Растворимые соли: α→1 МеAn → Ме+ + An- Гидролиз по катиону Гидролиз по аниону
- 17. Примеры гидролиза солей 1) Kb→0; Ka→ ∞ CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 H2O
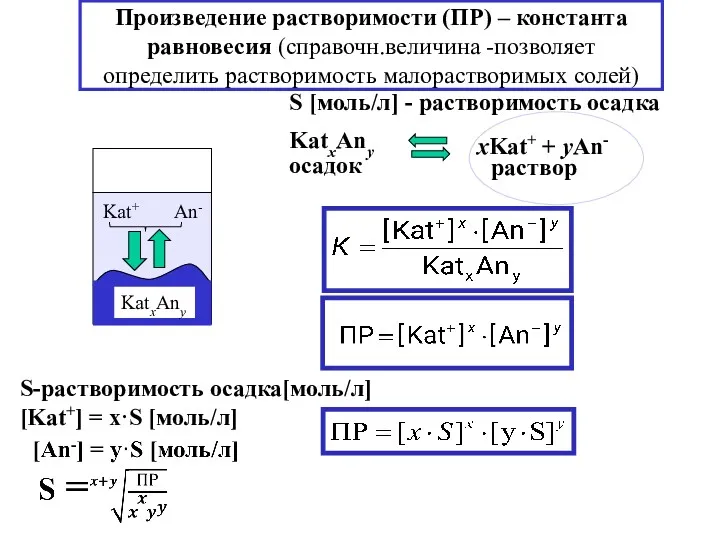
- 18. Произведение растворимости (ПР) – константа равновесия (справочн.величина -позволяет определить растворимость малорастворимых солей) S-растворимость осадка[моль/л] [Kat+] =
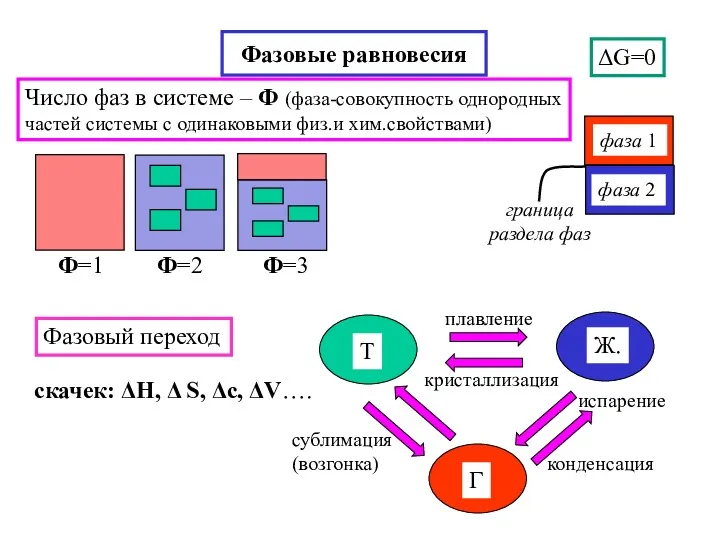
- 19. Фазовые равновесия ΔG=0 Фазовый переход скачек: ΔH, Δ S, Δc, ΔV…. Число фаз в системе –
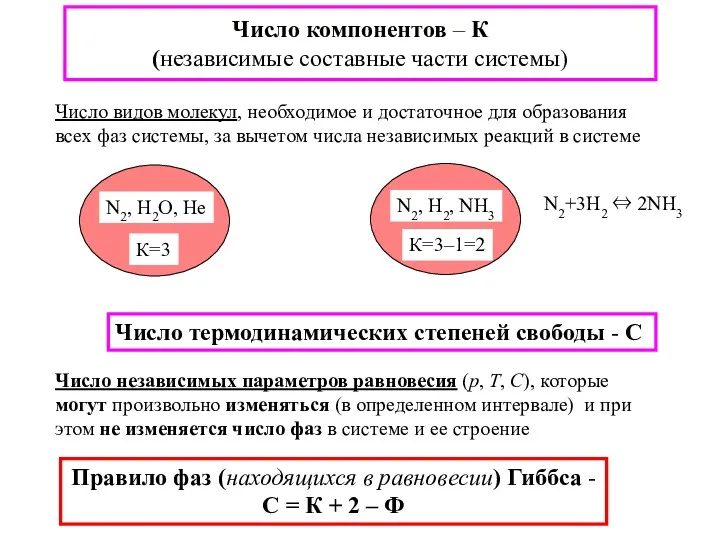
- 20. Число компонентов – К (независимые составные части системы) Число видов молекул, необходимое и достаточное для образования
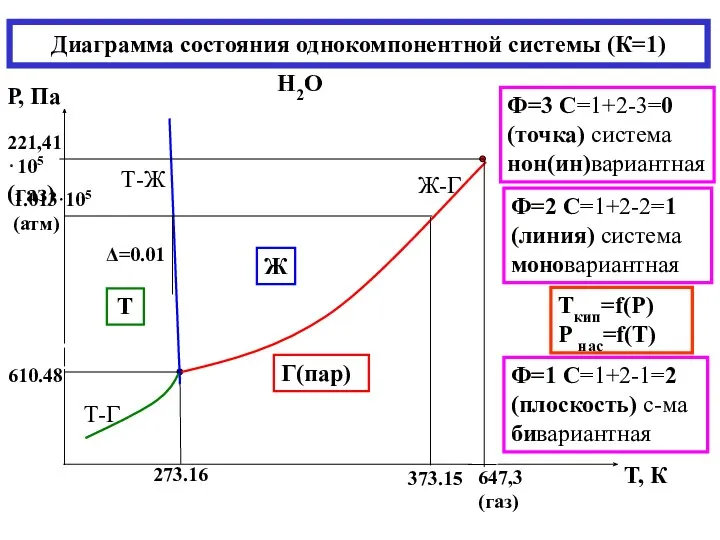
- 21. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2 С=1+2-2=1 (линия) система моновариантная Ф=3 С=1+2-3=0 (точка) система нон(ин)вариантная
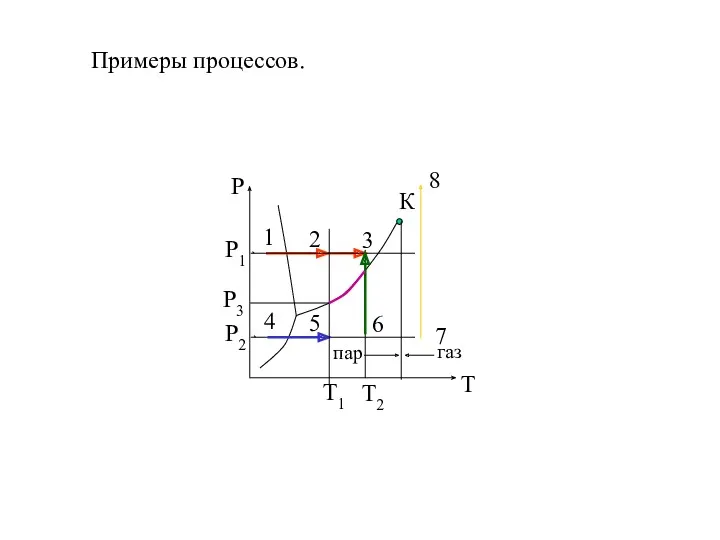
- 22. Примеры процессов.
- 23. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0 р-р неэлектролита p0 –давление насыщенного пара
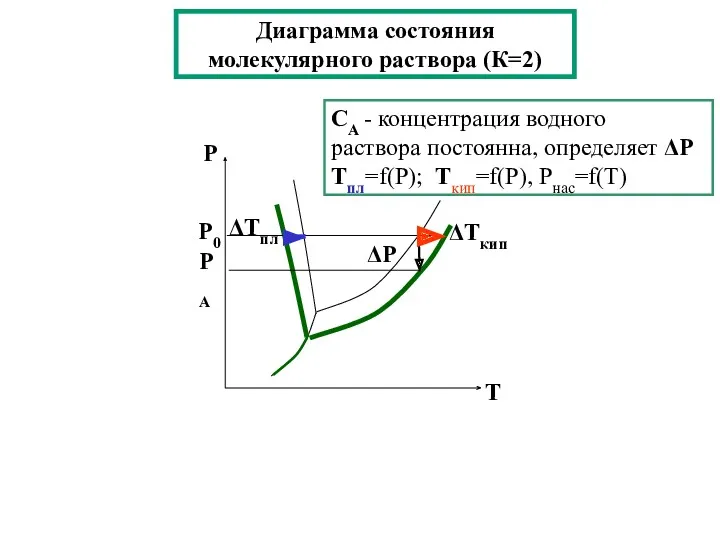
- 24. Диаграмма состояния молекулярного раствора (К=2) СА - концентрация водного раствора постоянна, определяет ΔP Tпл=f(Р); Tкип=f(Р), Рнас=f(T)
- 25. Кипение и кристаллизация растворов Повышение температуры кипения раствора по сравнению с чистым растворителем (ΔТкип) прямо пропорционально
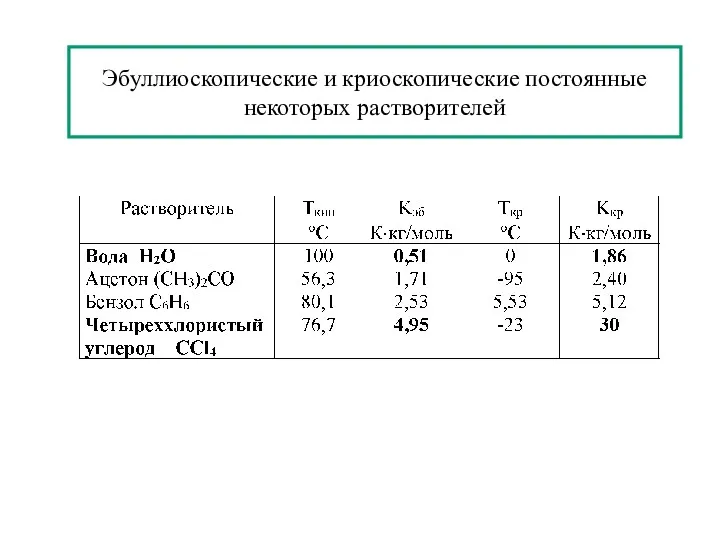
- 26. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 28. Скачать презентацию

![6.1 Равновесие – термодинамические условия (ΔrG = 0 )* [Равновесные концентрации (Ci )pvi - постоянны]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/28645/slide-3.jpg)

![Константа равновесия К, её размерность. Связь между К [кинетич.К-f(T), K≠f(Cнач)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/28645/slide-5.jpg)




![Ионное произведение воды Kw = [H+]⋅ [OH–] H2O ⇔ H+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/28645/slide-11.jpg)
![Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/28645/slide-12.jpg)


![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/28645/slide-22.jpg)

 Геометрические задачи практического содержания в вариантах ГИА
Геометрические задачи практического содержания в вариантах ГИА Дискуссионные проблемы. Задание 25 по истории
Дискуссионные проблемы. Задание 25 по истории Формы и виды публичной коммуникации
Формы и виды публичной коммуникации Роль нефти и углеводородных газов в мировом и российском топливно-энергетическом балансах
Роль нефти и углеводородных газов в мировом и российском топливно-энергетическом балансах Розвиток металургii
Розвиток металургii Сетевые черви и защита от них
Сетевые черви и защита от них Отправка заказа Avon
Отправка заказа Avon транспорт
транспорт Театрально- интегрированная деятельность для детей старше-подготовительного возраста
Театрально- интегрированная деятельность для детей старше-подготовительного возраста Наш коллектив
Наш коллектив Урок в 8 классе Генетическая связь веществ
Урок в 8 классе Генетическая связь веществ Гипертоническая болезнь
Гипертоническая болезнь Презентация Я здесь живу, и край мне этот дорог.История развития поселка Первомайский
Презентация Я здесь живу, и край мне этот дорог.История развития поселка Первомайский Образование СССР. Внешняя политика СССР в 1921-1927 годах
Образование СССР. Внешняя политика СССР в 1921-1927 годах Получение гидролизатов из пивной дробины и изучение условий культивирования на них разных видов дрожжей
Получение гидролизатов из пивной дробины и изучение условий культивирования на них разных видов дрожжей Фруктовый сад-загадки
Фруктовый сад-загадки Иудаизм в культуре
Иудаизм в культуре Фундаментальные физические явления наноэлектроники
Фундаментальные физические явления наноэлектроники Роль супервайзера в достижении лидерства ТМ Nemiroff в рознице в г. Одесса
Роль супервайзера в достижении лидерства ТМ Nemiroff в рознице в г. Одесса Грозова енергетика
Грозова енергетика Презентация к внеклассному мероприятию Здравствуй, Зимушка-зима
Презентация к внеклассному мероприятию Здравствуй, Зимушка-зима Мероприятия по раннему выявлению незаконного потребления наркотических средств и психотропных веществ
Мероприятия по раннему выявлению незаконного потребления наркотических средств и психотропных веществ e0ef78602e2a8994
e0ef78602e2a8994 Материаловедение. Технология конструкционных материалов. Материалы и материаловедение. (Тема 1)
Материаловедение. Технология конструкционных материалов. Материалы и материаловедение. (Тема 1) Оператор цикла For/Next
Оператор цикла For/Next Образ тургеневской девушки
Образ тургеневской девушки Интегрированное занятие Жили-были мама коза с козлятами
Интегрированное занятие Жили-были мама коза с козлятами Воспитательный процесс. Содержание воспитания
Воспитательный процесс. Содержание воспитания