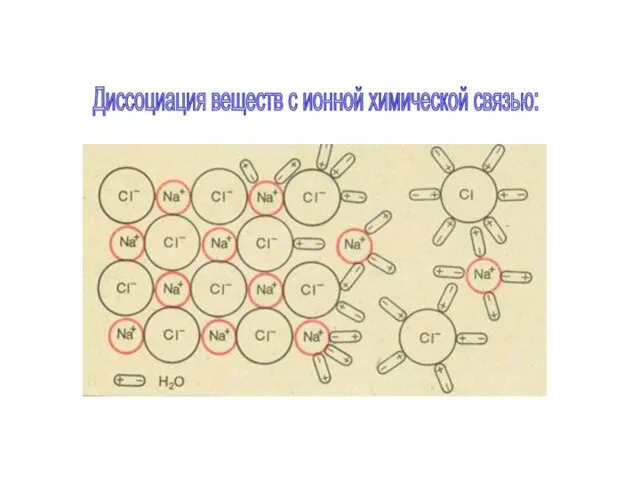
Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей
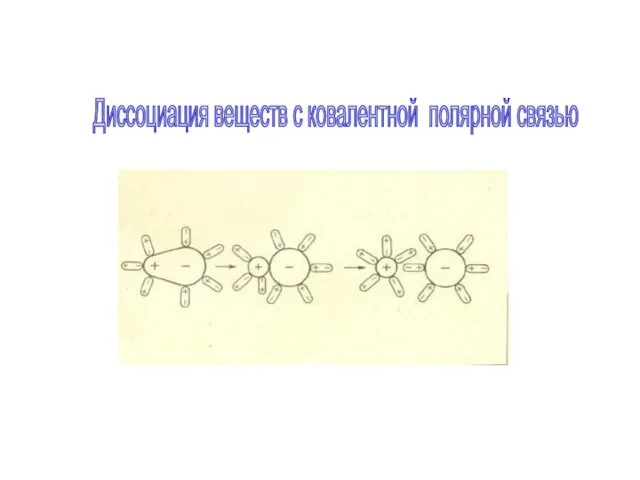
в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
SO4 + Cu = CuSO4.
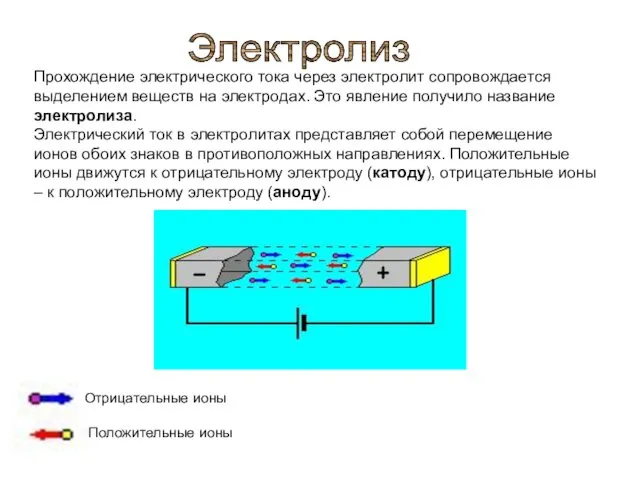
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду
процесс электролитической диссоциации







 Биполярные транзисторы
Биполярные транзисторы Групповое занятие по коррекции устной и письменной речи у младших школьников.
Групповое занятие по коррекции устной и письменной речи у младших школьников. Кем я вижу себя через 7 лет. Ващев Евгений
Кем я вижу себя через 7 лет. Ващев Евгений Презентация 11. Бытовой жанр в живописи 70-80-х годов
Презентация 11. Бытовой жанр в живописи 70-80-х годов Договорные отношения в туристической деятельности. Тема 4
Договорные отношения в туристической деятельности. Тема 4 Самоуправление- важнейший компонент воспитательной системы школы
Самоуправление- важнейший компонент воспитательной системы школы Розвиток мовлення 4 клас ІІ семестр
Розвиток мовлення 4 клас ІІ семестр Основные производственные процессы в тепловодном карповом прудовом хозяйстве
Основные производственные процессы в тепловодном карповом прудовом хозяйстве Walk, crawl, stagger
Walk, crawl, stagger Современные информационно-управляющие системы в управлении движением на железнодорожном транспорте
Современные информационно-управляющие системы в управлении движением на железнодорожном транспорте Природоведение. Урок знакомства.
Природоведение. Урок знакомства. Емдік тамақтандыру. Анемия. Қызба. Оттегі терапия
Емдік тамақтандыру. Анемия. Қызба. Оттегі терапия Специфика исследований в бизнесе и менеджменте
Специфика исследований в бизнесе и менеджменте Опухоли, опухолеподобные поражения и кисты слюнных желез. Клиника, диагностика, лечение. (Лекция 7)
Опухоли, опухолеподобные поражения и кисты слюнных желез. Клиника, диагностика, лечение. (Лекция 7) Резные кружева. Русская домовая резьба
Резные кружева. Русская домовая резьба Красный основной соус и его производные
Красный основной соус и его производные Поздравление мамам
Поздравление мамам Pour rire sans reflechir
Pour rire sans reflechir Канальное кодирование. Основы помехоустойчивого кодирования
Канальное кодирование. Основы помехоустойчивого кодирования Склейка Ландыши
Склейка Ландыши Физминутка для глаз Звездочет
Физминутка для глаз Звездочет Использование игровых методов при принятии решений в условиях риска и неопределенности понятие об игровых методах. Тема 8
Использование игровых методов при принятии решений в условиях риска и неопределенности понятие об игровых методах. Тема 8 Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия
Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия Универсальные семейные ценности
Универсальные семейные ценности Интерактивная игра-викторина по русским народным сказкам для детей старшего дошкольного возраста с ОИН
Интерактивная игра-викторина по русским народным сказкам для детей старшего дошкольного возраста с ОИН Оборудование и технология для гибридной лазерно-дуговой сварки сталей и алюминиевых сплавов
Оборудование и технология для гибридной лазерно-дуговой сварки сталей и алюминиевых сплавов Готовимся к ЕГЭ по биологии. Презентация – практикум по подготовке к успешному выполнению задания С5
Готовимся к ЕГЭ по биологии. Презентация – практикум по подготовке к успешному выполнению задания С5 Псков. Мастеровой. Гости праздника
Псков. Мастеровой. Гости праздника