Содержание
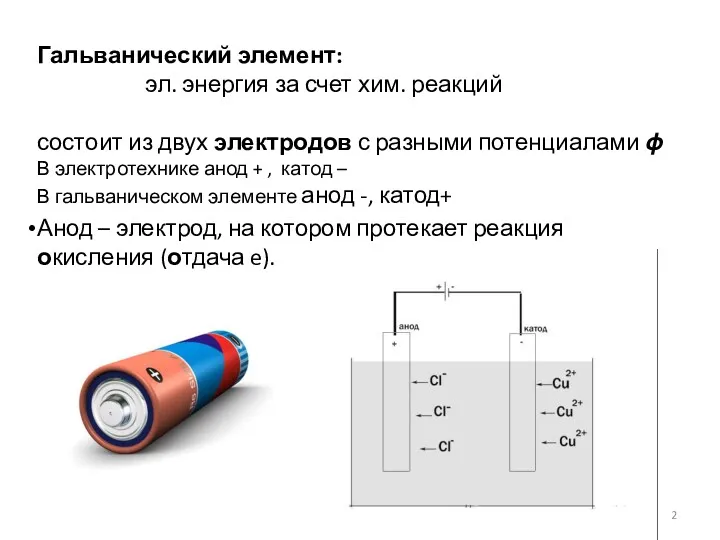
- 2. Гальванический элемент: эл. энергия за счет хим. реакций состоит из двух электродов с разными потенциалами ϕ
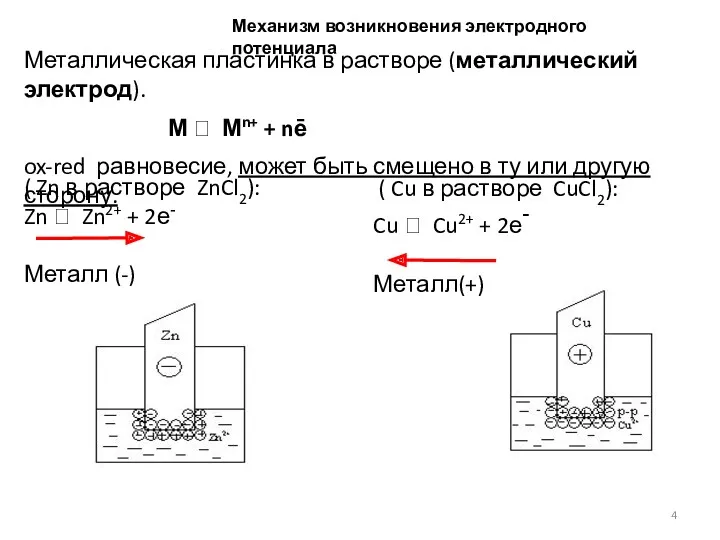
- 3. Электроды : первого рода, второго рода окислительно-восстановительные Электроды первого рода - ϕ зависит от концентрации только
- 4. ( Zn в растворе ZnCl2): Zn ⮀ Zn2+ + 2е- Металл (-) ( Cu в растворе
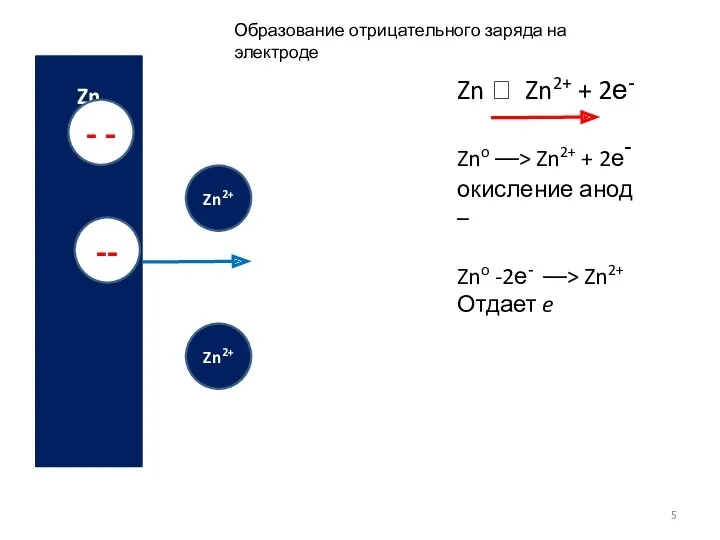
- 5. Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn - - -- Zn2+ Zn2+ Образование отрицательного заряда на электроде
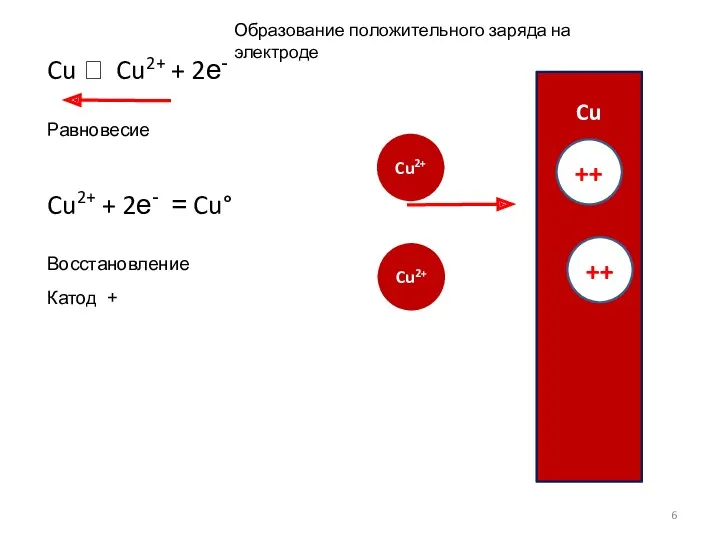
- 6. Cu Cu2+ Образование положительного заряда на электроде Cu ⮀ Cu2+ + 2е- Равновесие Cu2+ + 2е-
- 7. Основное уравнение потенциала электрода Реакция – запись всегда «от окисленной формы к восстановленной». в общем случае:
- 8. Электрическая работа nF∆ϕ совершается за счет работы хим реакции (-∆G). ур. изотермы nF∆ϕ = –ΔGr Дополнительный
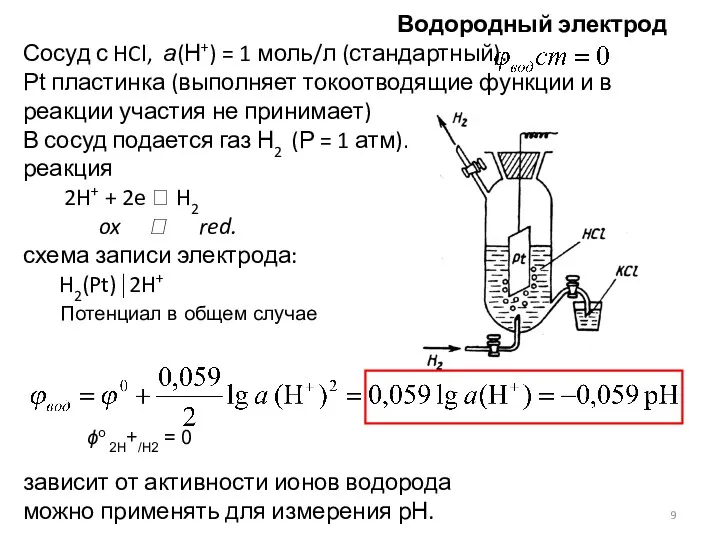
- 9. Водородный электрод Сосуд с HCl, а(Н+) = 1 моль/л (стандартный). Pt пластинка (выполняет токоотводящие функции и
- 10. Электроды второго рода обратимы к катионам и анионам, т.е. их потенциал зависит от концентрации двух ионов.
- 11. Хлоридсеребряный электрод: Ag⏐AgCl, Cl− ϕ ХС зависит от а (Ag+), которая зависит от а(Cl−) через ПРAgCl
- 12. Окислительно-восстановительными называют электроды, ϕ которых зависит от концентрации ox и red форм. Состоят из Pt пластинки,
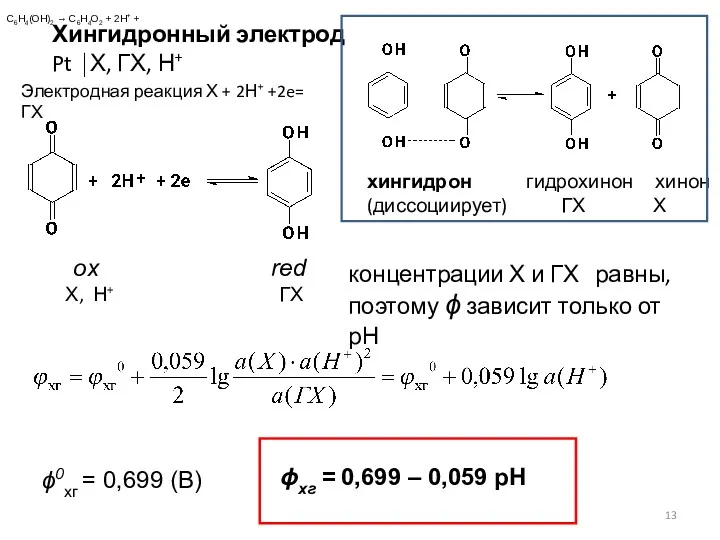
- 13. Хингидронный электрод Pt ⏐Х, ГХ, Н+ хингидрон гидрохинон хинон (диссоциирует) ГХ Х ox red Х, Н+
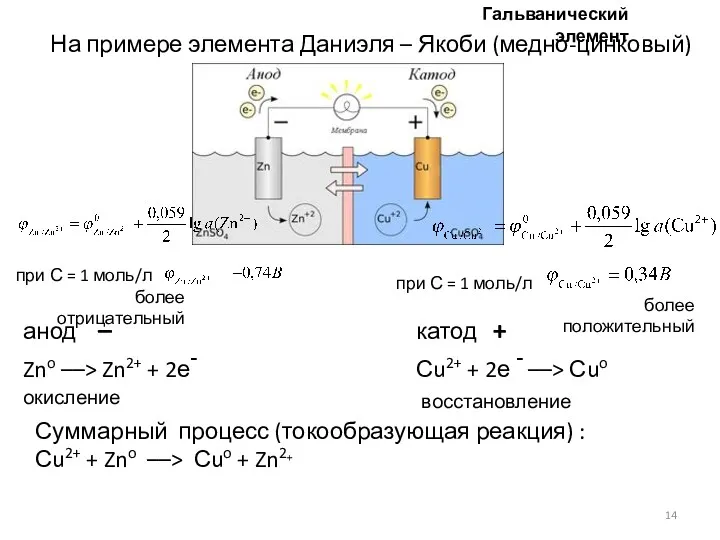
- 14. На примере элемента Даниэля – Якоби (медно-цинковый) анод – Zno ––> Zn2+ + 2е- окисление катод
- 15. Разность потенциалов ∆ϕ - «электродвижущая сила» (ЭДС) , другое принятое обозначение Е. Схема записи: слева -
- 16. Химические ГЭ состоит из двух электродов различной хим. природы: медного и цинкового, водородного и хлоридсеребряного, и
- 17. Рабочие электроды и электроды сравнения Рабочий (или индикаторный, или электрод определения) электрод выбирают в зависимости от
- 18. Потенциомерия – метод определения активности ионов, основанный на измерении ϕ рабочего электрода (т.е.обратимого по отношению к
- 19. Определение рН раствора (на примере ХС и водородного электродов) ϕхс нас = 0,202 В > ϕвод0
- 20. раствор в электроде сравнения рНстанд (рН = 2) катод исследуемый раствор pHx ( рН > 2)
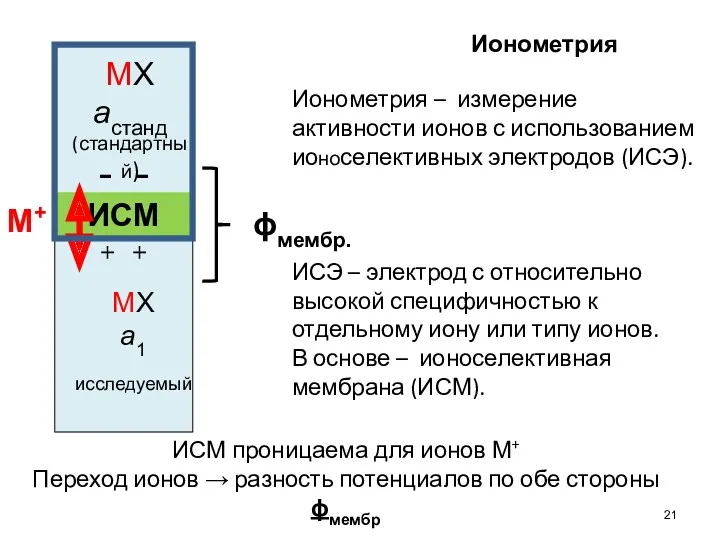
- 21. ИСМ МХ а1 исследуемый МХ астанд (стандартный) - - + + M+ ИСМ проницаема для ионов
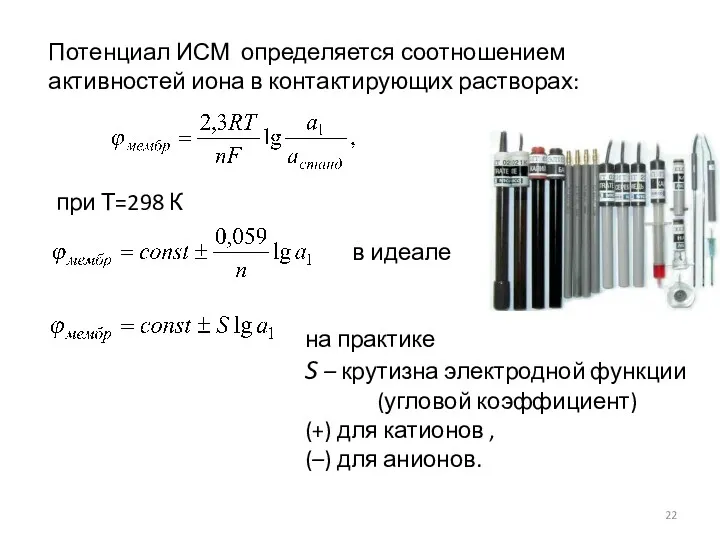
- 22. Потенциал ИСМ определяется соотношением активностей иона в контактирующих растворах: при Т=298 К в идеале на практике
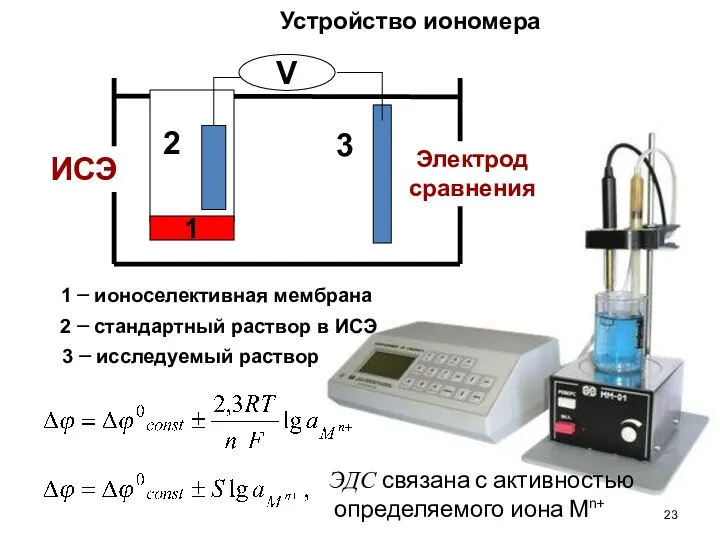
- 23. 3 1 2 1 – ионоселективная мембрана 2 – стандартный раствор в ИСЭ Устройство иономера ИСЭ
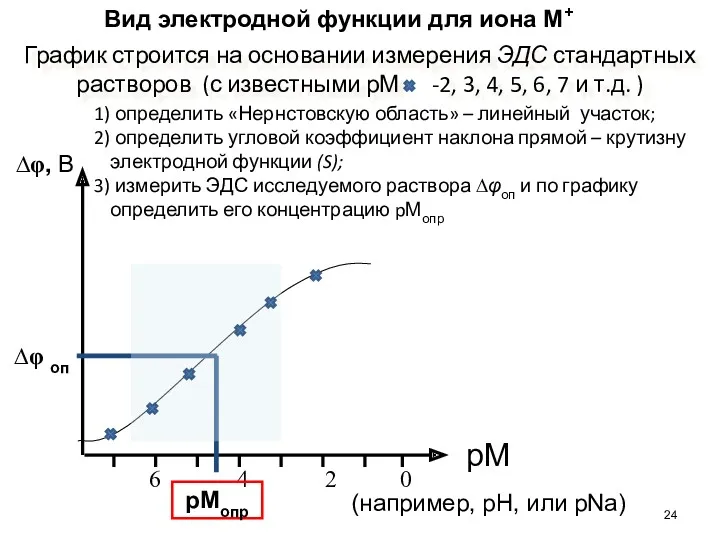
- 24. рМ (например, рН, или рNa) ∆φ, В Вид электродной функции для иона М+ ∆φ оп pМопр
- 25. Ионселективные электроды в зависимости от типа мембраны: твердофазные (с тв. мембраной, стеклянные), жидкофазные (ионактивное вещество –
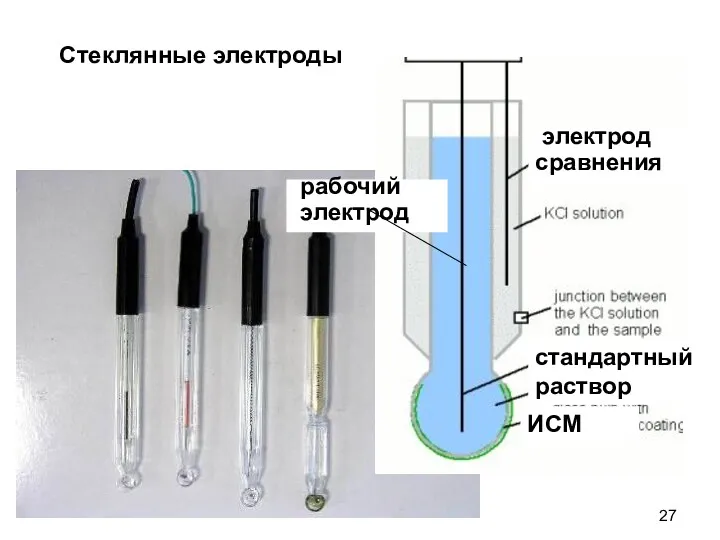
- 26. Стеклянные электроды Мембрана из натриевого (SiO2-Na2O-CaO) или литиевого (SiO2-Li2O-CaO) стекла. Обладает катионообменными свойствами. Ag, AgCl ||
- 27. Стеклянные электроды электрод сравнения стандартный раствор ИСМ рабочий электрод
- 28. Твердофазные электроды Поликристаллические Материал мембран – LaF3, AgCl, Ag2S, CuS, др. Важнейшие твердофазные электроды – pAg,
- 29. Важнейшие жидкостные электроды – pK, pCa, pMg, pNO3 Электроды с жидкой мембраной Основу мембраны составляет несмешивающаяся
- 30. Газовые электроды Газовые электроды: pCO2, pNH3, pH2S Мембрана – полимерная пленка, проницаемая для газа. разделяет исследуемый
- 31. Глюкоза глюкозооксидаза Глюконовая кислота + Н2О2 + О2 Ферментные электроды Для определения концентрации участников ферментативной реакции.
- 33. Скачать презентацию


















 Миеломная болезнь (болезнь Рустицкого-Калера)
Миеломная болезнь (болезнь Рустицкого-Калера) Кровотечения в последовом и раннем послеродовом периоде
Кровотечения в последовом и раннем послеродовом периоде Галантерейные товары
Галантерейные товары Воскресение Христово
Воскресение Христово XXXIII Отчетно-выборная профсоюзная конференция
XXXIII Отчетно-выборная профсоюзная конференция Oriflame Cosmetics. Сервис Е-каталог
Oriflame Cosmetics. Сервис Е-каталог Соединения химических элементов
Соединения химических элементов Игра-презентация по Карточкам Ханса
Игра-презентация по Карточкам Ханса Виртуальная выставка: Астафьев В. П
Виртуальная выставка: Астафьев В. П Презентация Имя Д.И.Менделеева в геграфических названиях
Презентация Имя Д.И.Менделеева в геграфических названиях Презентация основного понятия здоровьесберегающих технологий на уроке в начальной школе
Презентация основного понятия здоровьесберегающих технологий на уроке в начальной школе Презентация по теме ЧС природного характера
Презентация по теме ЧС природного характера Природа человека. Изучение нового материала
Природа человека. Изучение нового материала Сельское хозяйство городского округа г. Бор
Сельское хозяйство городского округа г. Бор Здоровое питание
Здоровое питание Заходер. Птичья школа
Заходер. Птичья школа Картотека Прогулки зимой
Картотека Прогулки зимой Обморожение у детей
Обморожение у детей Задачи нравственно-патриотического воспитания по программе От рождения до школы презентация Диск
Задачи нравственно-патриотического воспитания по программе От рождения до школы презентация Диск Географическое положение Евразии. Исследования Центральной Азии. 7 класс
Географическое положение Евразии. Исследования Центральной Азии. 7 класс Zaschita
Zaschita Презентация История Пасхи как события
Презентация История Пасхи как события Путешествие по Транссибирской железной дороге
Путешествие по Транссибирской железной дороге Презентация Развитие творческих способностей на уроке литературного чтения в первом классе
Презентация Развитие творческих способностей на уроке литературного чтения в первом классе Совет молодежи АО ТЯЖМАШ. Отчет о результатах работы за 2018 год
Совет молодежи АО ТЯЖМАШ. Отчет о результатах работы за 2018 год Графический торговый знак
Графический торговый знак Якість і надійність машин
Якість і надійність машин Жизнь и творчество И.П.Крымшамхалова.
Жизнь и творчество И.П.Крымшамхалова.