Содержание
- 2. Планирование изучения темы 1.Степень окисления. Бинарные соединения. 2.Оксиды. 3.Основания. 4.Кислоты. 5-6.Соли – как производные кислот и
- 3. Урок 1. Степень окисления Цели: Сформировать понятие о степени окисления Научить находить степени окисления по формуле
- 4. Продолжи предложение Наука химия изучает … Вещества делятся на … Простые вещества состоят из … Сложные
- 5. Урок 1. Степень окисления Степень окисления – это условный заряд атомов х.э. в соединении, вычисленный на
- 6. Нахождение степени окисления Значение С.О. определяется числом электронов, смещённых от данного атома к атому более электроотрицательного
- 7. С.О. кислорода всегда равна «-2» Исключение: +1 -1 пероксиды H2O2 +2 -1 фторид кислорода OF2 запомните
- 8. C.О. водорода всегда равна «+1» Исключение: гидриды металлов +1 -1 +2 -1 +3 -1 NaH CaH2
- 9. Металлы в соединениях всегда имеют положительное значение степени окисления С.О. металлов главных подгрупп численно равна номеру
- 10. В соединениях сумма значений положительных и отрицательных степеней окисления равна нулю +3 -2 Al2O3 (+3)*2 +
- 11. Бинарные соединения Бинарные соединения – это соединения, в состав которых входят атомы двух х.э. (би –
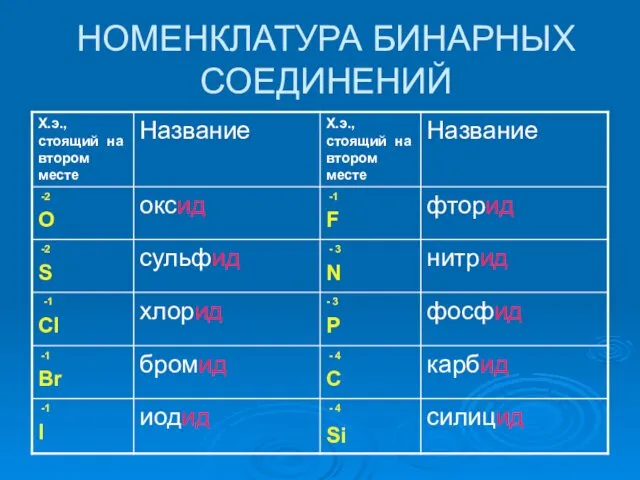
- 12. НОМЕНКЛАТУРА БИНАРНЫХ СОЕДИНЕНИЙ
- 13. Определение степени окисления в бинарных соединениях В бинарных соединениях С.О. х.э., стоящего на втором месте, находим
- 14. Если атом одного х.э. может принимать несколько значений С.О., в названии указывают С.О. римскими цифрами в
- 15. проверь себя Назовите вещества: CaO AlCl3 Fe2S3 K2O FeBr2 AlN Названия веществ: Оксид кальция Хлорид алюминия
- 16. Проверь себя Найди значение С.О. CaO AlCl3 Fe2S3 K2O FeBr2 AlN Правильные ответы: +2, -2 +3,
- 17. Проверь себя (2 вариант) Найди значение С.О. CaO AlCl3 Fe2S3 K2O FeBr2 AlN Правильные ответы: +2,
- 18. Как вы думаете, можно ли составить формулу вещества, зная степени окисления химических элементов, из которых состоит
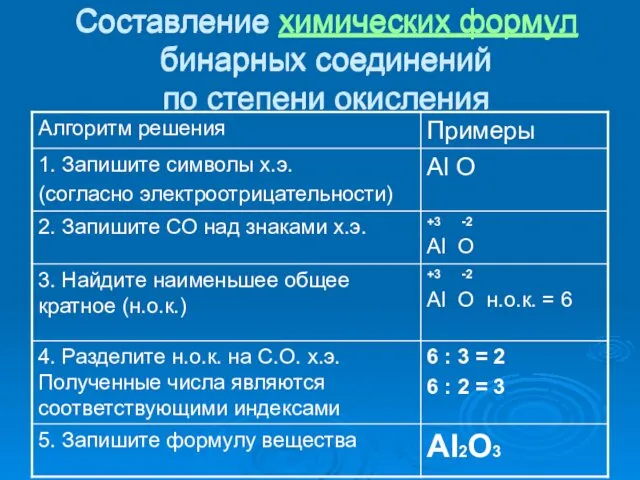
- 19. Составление химических формул бинарных соединений по степени окисления (алгоритм) 1. Запишите символы х.э. (согласно электроотрицательности) 2.
- 20. Составление химических формул бинарных соединений по степени окисления Составление химических формул бинарных соединений по степени окисления
- 22. Скачать презентацию

















 Презентация Игровая педагогическая технология
Презентация Игровая педагогическая технология презентация к уроку профориентации Что такое профессия. Какие бывают профессии
презентация к уроку профориентации Что такое профессия. Какие бывают профессии Латинская Америка в XIX – начале XX в.: время перемен
Латинская Америка в XIX – начале XX в.: время перемен классный час Мы в ответе за свои поступки
классный час Мы в ответе за свои поступки Зеленый наряд нашей планеты. Презентация.
Зеленый наряд нашей планеты. Презентация. Наладка систем измерения расхода
Наладка систем измерения расхода Рельеф Земли. Равнины суши. Горы суши
Рельеф Земли. Равнины суши. Горы суши Организация проектной деятельности в образовательном процессе ДОУ. Диск
Организация проектной деятельности в образовательном процессе ДОУ. Диск городская социально-педагогическая программа Поморье(1 этап)
городская социально-педагогическая программа Поморье(1 этап) Оформление сертификатов
Оформление сертификатов Блокада Ленинграда
Блокада Ленинграда Жалпы гигиена және Экология. Атом энергетикасын пайдалану қауіпсіздік мемлекеттік реттеу
Жалпы гигиена және Экология. Атом энергетикасын пайдалану қауіпсіздік мемлекеттік реттеу Введение в специальность. Профессиональная этика и деонтология
Введение в специальность. Профессиональная этика и деонтология Разгадываем загадки
Разгадываем загадки Аквалос в бетоне производительностью 1000 м3/сут
Аквалос в бетоне производительностью 1000 м3/сут Методический материал к занятиям по музыки с 1-4 класс
Методический материал к занятиям по музыки с 1-4 класс Презентация Гидролиз
Презентация Гидролиз Дисперсные системы.
Дисперсные системы. Права человека. Свобода, равенство и братство
Права человека. Свобода, равенство и братство Компания Мега Вольт
Компания Мега Вольт Логистикалық кәсіпорындарының іс-әрекетін талдау
Логистикалық кәсіпорындарының іс-әрекетін талдау Презентация Забавные загадки
Презентация Забавные загадки Делірії та депресії у людей похилого та старечого віку
Делірії та депресії у людей похилого та старечого віку презентация
презентация Документы для внутренней и внешней общественности
Документы для внутренней и внешней общественности Danone. Пищевая промышленность. Продукция: молочные продукты, минеральная вода, детское питание
Danone. Пищевая промышленность. Продукция: молочные продукты, минеральная вода, детское питание Соотношение постоянной и переменной части вознаграждения
Соотношение постоянной и переменной части вознаграждения Государство и право в Древней Руси (IX-XV вв.)
Государство и право в Древней Руси (IX-XV вв.)