Содержание
- 2. Химическая кинетика – раздел химии, изуча-ющий закономерности протекания химичес-ких процессов во времени Основное понятие химической кинетики
- 3. 7.2. Типы химических реакций I. Элементарные реакции (одностадийные, простые) протекают в одну стадию: 2NO + O2
- 4. II Гомоенные реакции – протекают в объеме одной фазы: NaOH (раствор)+ НCl (раствор) = NaCl (раствор)+H2O
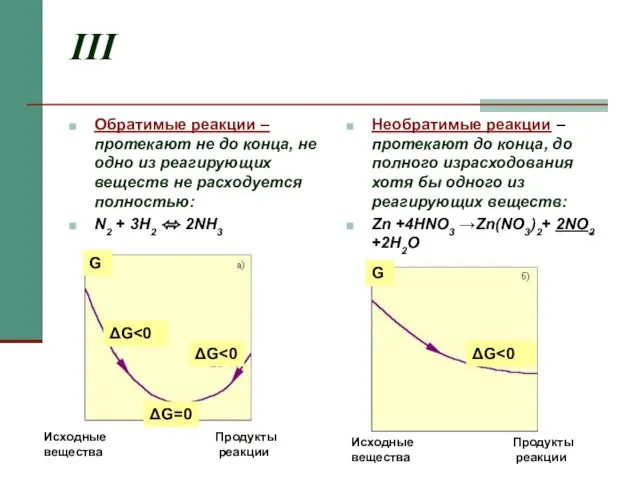
- 5. III Обратимые реакции – протекают не до конца, не одно из реагирующих веществ не расходуется полностью:
- 6. 6.3. Скорость химической реакции Скорость химической реакции – это число элементар-ных актов взаимодействия между молекулами реаги-рующих
- 7. 6.4. Факторы, влияющие на скорость химических реакций. Закон действующих масс. Опыт: Na2S2O3 +H2SO4= Na2SO4 +S↓+SO2 +
- 8. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. aA +
- 9. Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию. В других
- 10. 6.5. Влияние температуры на скорость химической реакции Опыт: Na2S2O3 +H2SO4= Na2SO4 +S↓+SO2 + H2O Вывод: Чем
- 11. Правило Вант-Гоффа (1884 г.) При повышении температуры на каждые десять градусов скорость химической реакции возрастает в
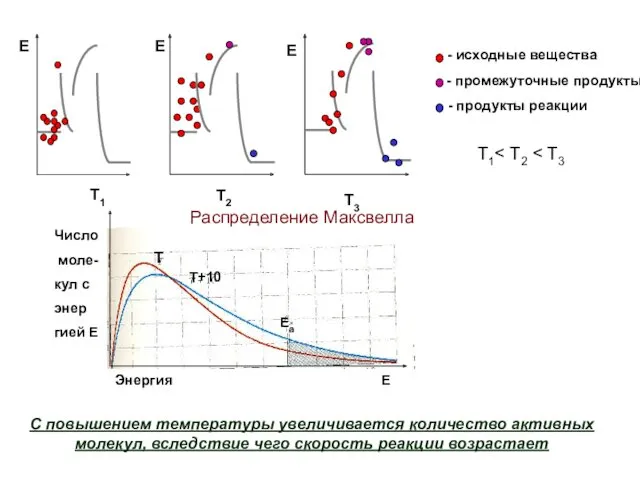
- 12. Уравнение Аррениуса (1889 г.) 1859-1927 Молекулы, вступающие в реакцию при столкно- вении, называются активными. Энергия активации
- 13. Т1 С повышением температуры увеличивается количество активных молекул, вследствие чего скорость реакции возрастает Распределение Максвелла
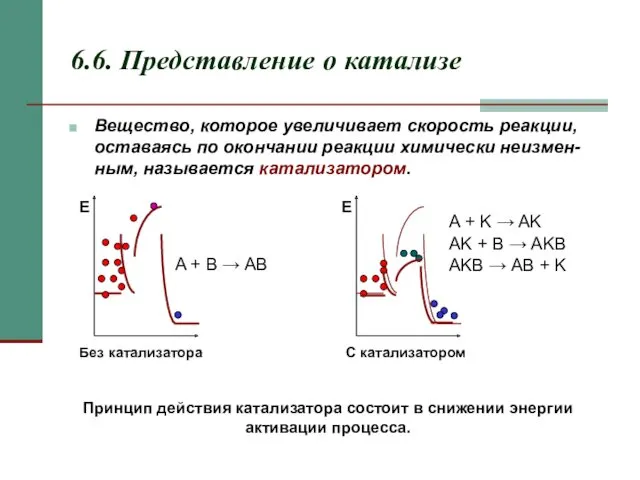
- 14. 6.6. Представление о катализе Вещество, которое увеличивает скорость реакции, оставаясь по окончании реакции химически неизмен-ным, называется
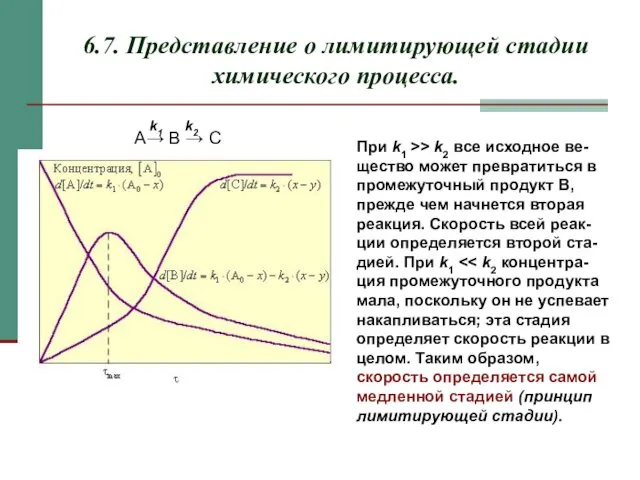
- 15. 6.7. Представление о лимитирующей стадии химического процесса. При k1 >> k2 все исходное ве-щество может превратиться
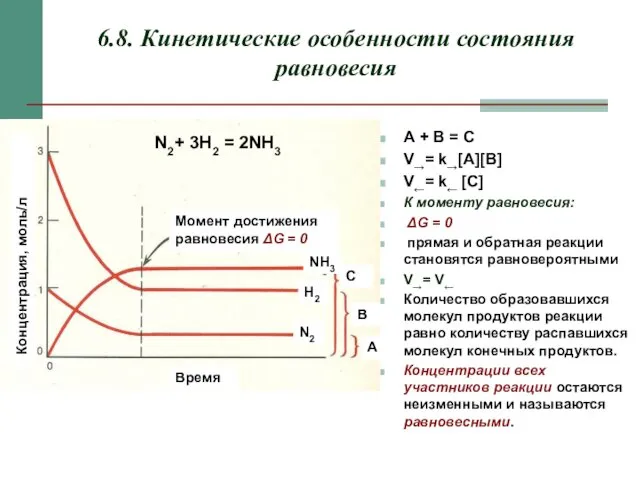
- 16. 6.8. Кинетические особенности состояния равновесия А + B = C V→= k→[A][B] V←= k← [C] К
- 17. Отношение констант скоростей прямой и обратной реакции в состоянии равновесия при фиксированной температуре есть величина постоянная
- 18. Константы равновесия некоторых реакций
- 19. Принцип Ле Шателье (1884 г.) Опыт: FeCl3 +6KCNS ⬄ K3[Fe(CNS)6] + 3KCl Оранж. Кроваво-красный Вывод: добавление
- 20. N2O4(г)⬄ 2NO2(г); Δ H = +57,2 кДж бесцвет коричнев Равно- весие Равно- весие нарушено Равно- весие
- 22. Скачать презентацию











![Принцип Ле Шателье (1884 г.) Опыт: FeCl3 +6KCNS ⬄ K3[Fe(CNS)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43690/slide-18.jpg)

 Архитектурно-строительная акустика. Защита от шума
Архитектурно-строительная акустика. Защита от шума Информация в памяти компьютера
Информация в памяти компьютера Использование пестицидов в сельском хозяйстве
Использование пестицидов в сельском хозяйстве Основные педагогические системы, дидактические конценции и технологии обучения
Основные педагогические системы, дидактические конценции и технологии обучения Знаток родного края
Знаток родного края мастер-класс на тему Критической мышление
мастер-класс на тему Критической мышление Ах, лето красное. Игра
Ах, лето красное. Игра Православные монастыри. Оптина пустынь
Православные монастыри. Оптина пустынь Виды, способы и техники лепки в детском саду
Виды, способы и техники лепки в детском саду Лента памяти: 1941-1945
Лента памяти: 1941-1945 Презентация Решение задач на движение
Презентация Решение задач на движение Бореальные леса Евразии (тайга)
Бореальные леса Евразии (тайга) Общие сведения о зданиях, сооружениях и их эксплуатации. Характеристика зданий, их проектирования и строительства
Общие сведения о зданиях, сооружениях и их эксплуатации. Характеристика зданий, их проектирования и строительства Политический режим. Лекция № 11
Политический режим. Лекция № 11 Производственные процессы при разведении в прудах растительноядных рыб
Производственные процессы при разведении в прудах растительноядных рыб Пятно как средство выражения ритм пятен
Пятно как средство выражения ритм пятен Музыка П.И.Чайковского в анимации
Музыка П.И.Чайковского в анимации Kök kanal morfoloji̇leri̇ ve gi̇ri̇ş kavi̇tesi̇ preparasyonlari
Kök kanal morfoloji̇leri̇ ve gi̇ri̇ş kavi̇tesi̇ preparasyonlari Как вырастить здоровый электронный журнал?
Как вырастить здоровый электронный журнал? Течения в океане
Течения в океане Гипергликемиялық кома
Гипергликемиялық кома SAINTS from the banks of the Neva River
SAINTS from the banks of the Neva River Инновационный образовательный проект Создание модели социально адаптированной личности выпускника посредством интеграции учебной и внеклассной работы учителя химии
Инновационный образовательный проект Создание модели социально адаптированной личности выпускника посредством интеграции учебной и внеклассной работы учителя химии Ядерные реакции и реагенты. Применение и биологическая роль
Ядерные реакции и реагенты. Применение и биологическая роль Растим патриотов!
Растим патриотов! Категорія числа іменників
Категорія числа іменників Сфера обслуживания на Красной горке
Сфера обслуживания на Красной горке Анна Герман
Анна Герман