Содержание
- 2. Кинетика – это раздел химии, изучающий скорость, механизмы, факторы, от которых они зависят. Некоторые реакции протекают
- 3. Скорость химической реакции – это изменение концентрации исходных веществ в единицу времени. .
- 4. Скорость реакции для гомогенных систем: для гетерогенных систем:
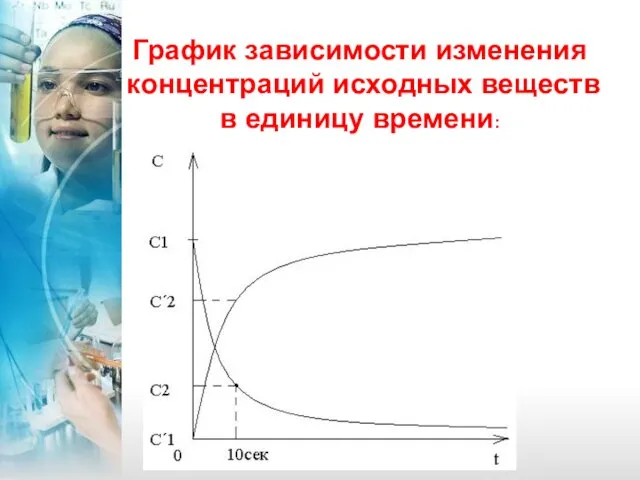
- 5. График зависимости изменения концентраций исходных веществ в единицу времени:
- 6. Мгновенная скорость – это изменение концентрации за бесконечно малый промежуток времени
- 7. Скорость реакции зависит от: - концентрации реагентов - агрегатного состояния (газ, жидкость, тверд.) - природы растворителя
- 8. Зависимость скорости реакции от концентрации впервые была сформулирована в 1867 году Гульдбергом и Вааге и названа
- 9. Например для процесса: aA + bB ↔ cC + dD Скорость прямой реакции: V = k1∙[A]a
- 10. Большинство процессов происходит через несколько элементарных стадий, в которых принимают участие 1, 2, 3 молекулы. Число
- 11. Скорость многостадийной реакции определяется скоростью самой медленной стадии. В зависимости от механизма реакции бывают простые (протекающие
- 12. Сложные реакции могут быть: - последовательные (идут через несколько разных промежуточных стадий, следующих одна за другой)
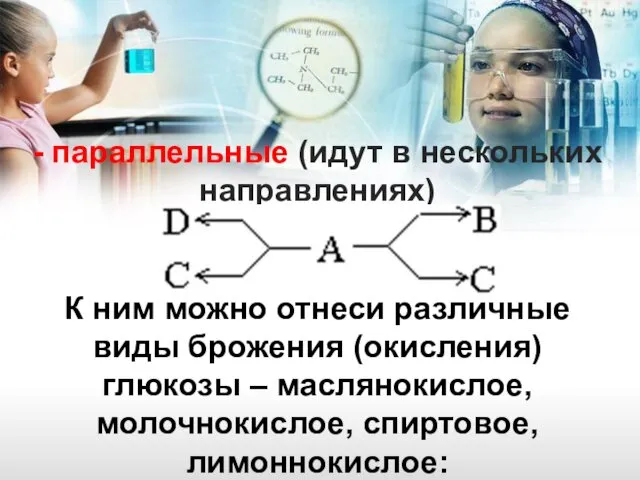
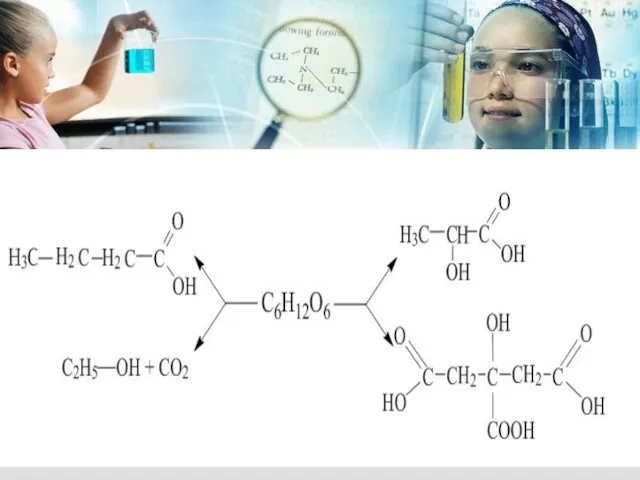
- 13. - параллельные (идут в нескольких направлениях) К ним можно отнеси различные виды брожения (окисления) глюкозы –
- 15. - сопряженные (это такие две реакции, одна из которых вызывает в системе протекание другой реакции, не
- 16. - конкурирующие – это сложные реакции, в которых одно и тоже вещество (А) взаимодействует с несколькими
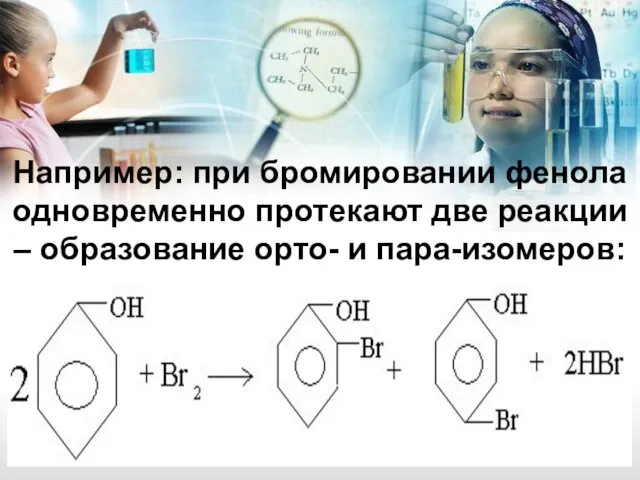
- 17. Например: при бромировании фенола одновременно протекают две реакции – образование орто- и пара-изомеров:
- 18. Кинетические уравнения могут быть I и II порядка, которые характеризуются константой первого порядка. Она рассчитывается: Ʈ
- 19. К уравнениям второго порядка относятся реакции соединения и обмена: А + В → С А +
- 20. В биохимических процессах нет реакций, имеющих порядок более второго. Количественной характеристикой протекания реакции во времени является
- 21. Период полупревращения Для реакций I порядка: Ʈ½ = 0,693/ k1 Для реакций II порядка: Ʈ ½
- 22. Кинетические закономерности распределения лекарственных препаратов во внутренней среде изучаются фарамакокинетикой. Основная задача этой науки – с
- 23. Экспериментальные методы определения скорости реакций: химические, физические и биохимические методы. Химические: гравиметрия, титриметрия. Физические: спектральные методы,
- 24. Зависимость скорости реакции от температуры – Закон Вант – Гоффа: при повышении температуры на каждые 10°С
- 26. Уравнение Аррениуса:
- 27. Где: k – постоянная скорости реакции; А - предэкспоненциальный множитель, который отражает долю эффективных соударений молекул
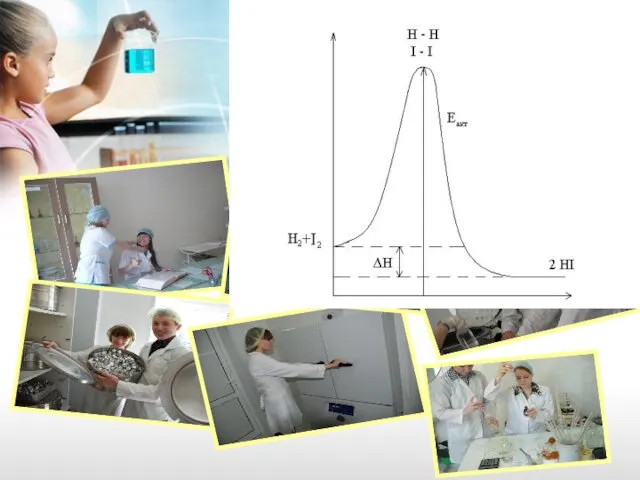
- 28. Энергия активации - избыточная энергия, необходимая для вступления реагирующих веществ в реакцию при их столкновении по
- 30. Скорость реакции для газообразных веществ зависит от давления: с повышением давления увеличивается концентрация веществ, следовательно, увеличивается
- 31. Катализаторы изменяют скорость химической реакции, сохраняя при этом свой состав, они понижают энергию активации. А +
- 32. Катализ подразделяют на положительный (каталитический) и отрицательный (ингибирующий). В организме ингибиторы процессов старения – антиоксиданты (зеленый
- 33. Различают катализ гомогенный (реагирующие вещества и катализатор находятся в одной фазе: окисление серы (IV) кислородом ускоряется
- 34. Микрогетерогенный катализ – в нем используют ВМС в коллоидном состоянии, т.е. ферменты и энзимы (инсулин, гидролаза,
- 35. Характерные особенности ферментов: - Высокая эффективность (в тысячи раз эффективнее химических катализаторов). 2 H2O2 → 2
- 36. - Высокая специфичность, которая осуществляет специфический контакт активного центра фермента с субстратом (амилаза, глюкозидаза, каталаза, пероксидаза,
- 37. Активаторами ферментов могут быть ионы металлов и сложные органические молекулы: нуклеотиды, витамины - коферменты. НАД; НАДН
- 38. Теорию ферментативного катализа предложили Мехаэллис и Ментен в 1913 году.
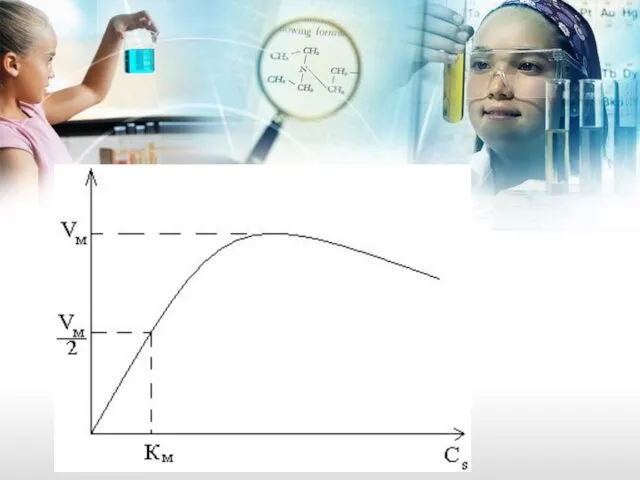
- 39. Они вывели формулу зависимости стационарной скорости ферментативной реакции (Vст) от концентрации субстрата ( Cs)
- 40. Где: Vм, Kм – постоянные величины для определенных ферментов. Vм – это максимально возможная скорость превращения
- 42. Леонор Михаэлис, Мод Ментен и их грустная кривая , говорящая о том, что если что нибудь
- 43. В настоящее время развивается медицинская энзимология – наука, занимающаяся изучением применения ферментов в качестве лекарственных веществ,
- 44. Принцип Ле-Шателье самостоятельно. Уравнение изотермы: ∆G = -2,3∙R∙T∙lg Kpавн. Химическое равновесие: V = V, ∆G =
- 45. Из уравнения видно, что меньшим значениям ΔG отвечают большие величины Кр, т.е. в равновесной смеси преобладают
- 46. Расчет энтальпии:
- 47. По уравнению изобары видно, что экзотермические реакции (∆Н а эндотермические (∆Н > 0) - в прямом
- 49. Скачать презентацию



















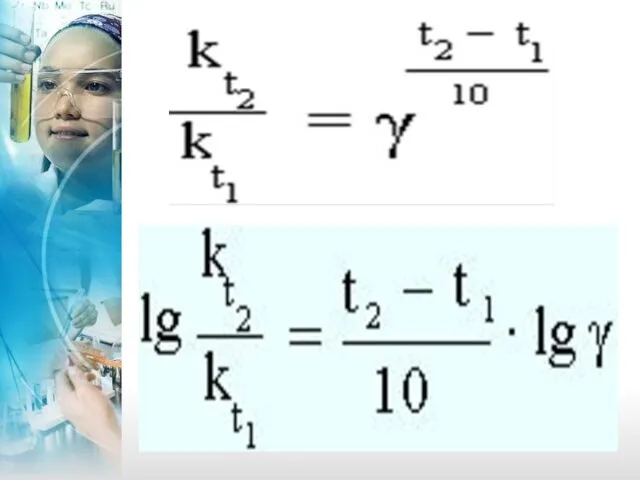




















 Программы для занятий
Программы для занятий Организация сравнительных сценариев ТВ Samsung In-store
Организация сравнительных сценариев ТВ Samsung In-store Презентация к занятию на тему: Форма, цвет, размер
Презентация к занятию на тему: Форма, цвет, размер Основные методы и особенности оценки земель сельскохозяйственного назначения
Основные методы и особенности оценки земель сельскохозяйственного назначения Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов
Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов История возникновения степени числа (7 класс)
История возникновения степени числа (7 класс) Электронные образовательные ресурсы в начальной школе
Электронные образовательные ресурсы в начальной школе Түйсік және ес
Түйсік және ес Культурные растения
Культурные растения Моё село.
Моё село. Древнегреческий скульптор Поликлет
Древнегреческий скульптор Поликлет Устал от своей работы?
Устал от своей работы? Атмосферный воздух и его физические свойства. (Лекция 5)
Атмосферный воздух и его физические свойства. (Лекция 5) Презентация Открытка к 8 марта
Презентация Открытка к 8 марта Образование и культура в XVII веке в России
Образование и культура в XVII веке в России Смысл жертвы Иисуса Христа
Смысл жертвы Иисуса Христа Переработка алюмо-силикатной микросферы
Переработка алюмо-силикатной микросферы Предметно - развивающая среда логопедического кабинета и группы детского сада
Предметно - развивающая среда логопедического кабинета и группы детского сада Народные росписи
Народные росписи Хранение варено-копченых колбас
Хранение варено-копченых колбас Божа благодать в житті християнина
Божа благодать в житті християнина Әртүрлі құрылыс материалдарының беріктігі мен жылуөткізгіштігін зерттеу
Әртүрлі құрылыс материалдарының беріктігі мен жылуөткізгіштігін зерттеу Невропатология. Данные о патологии нервной системы
Невропатология. Данные о патологии нервной системы Великой Победе посвящается....
Великой Победе посвящается.... Родительское собрание. Возрастные особенности учащихся 2-х классов.
Родительское собрание. Возрастные особенности учащихся 2-х классов. Тест по рассказу В.М. Шукшина Срезал
Тест по рассказу В.М. Шукшина Срезал Технология гибридных микросхем
Технология гибридных микросхем Права ребенка
Права ребенка