Содержание
- 2. План І. Введение ІІ. Оснавная часть а) Потенциометрия б) Потенциометрическое титрование ІІІ. Заключение IV.Литература
- 3. Потенциометрия Основана на измерении потенциала ячейки , т.е. разности потенциалов между двумя электродами (индикаторным электродом и
- 5. Ме0 ↔ Меn + ne Ex = E0 + RT/nF ln cMe (1) Уравнение Нернста аМе
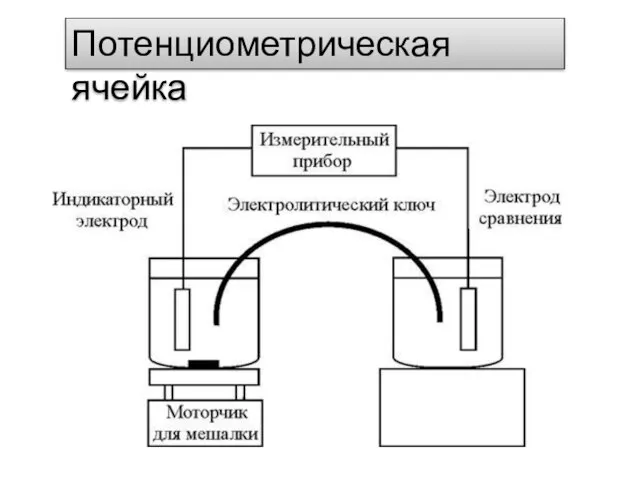
- 6. Потенциометрическая ячейка
- 7. Е = (Еинд - Еср) + Еj правый левый где Еинд – потенциал индикаторного электрода; Еср
- 8. Электрод первого рода – металл, погруженный в раствор соли этого же металла; Электрод второго рода –
- 9. 1) Классические электроды: Класс 0. Инертные металлы; Класс 1. Обратимые: металл /ион металла; Класс 2. Обратимые:
- 10. Должны удовлетворять следующим требованиям: равновесный потенциал электрода должен быть воспроизводимым и устанавливаться быстро, иначе анализ потребует
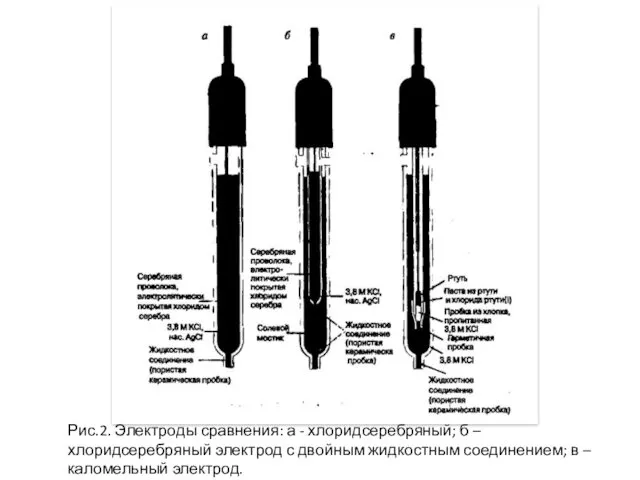
- 11. Хлоридсеребряный электрод (Ag│AgСl, KCl) AgСl (тв.) + е ↔ Ag(тв.) + Сl- Каломельный электрод (Hg│Hg2Cl2, KCl)
- 12. Рис.2. Электроды сравнения: а - хлоридсеребряный; б – хлоридсеребряный электрод с двойным жидкостным соединением; в –
- 14. Важными требованиями к электроду сравнения являются: обратимость, воспроизводимость и стабильность во времени.
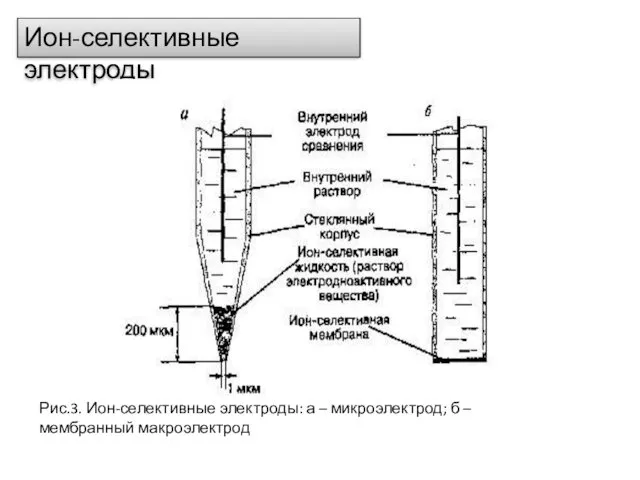
- 15. Ион-селективные электроды Рис.3. Ион-селективные электроды: а – микроэлектрод; б – мембранный макроэлектрод
- 16. ∆φ1 Δφ2 Δφj Ем ∆ φ3 Hg│Hg2Cl2, KCl (насыщ.)║солевой мостик║проба│мембрана│внутр. р-р, AgCl│ Ag Е = (Δφ1
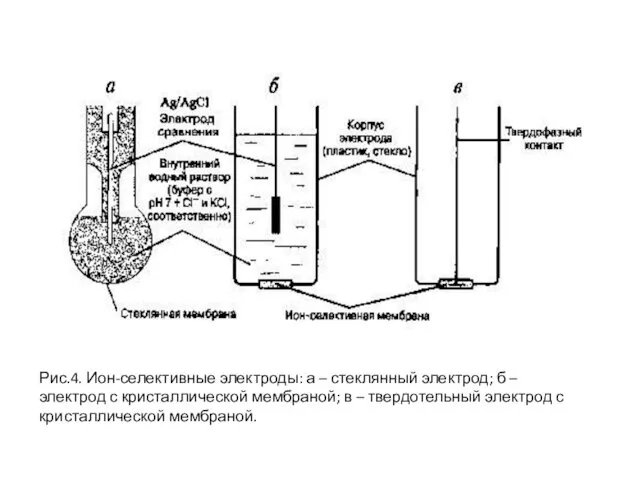
- 17. Типы ион-селективных электродов. Первичные ион-селективные электроды: а) электроды со стеклянной мембраной; б) кристаллические (твердофазные) мембранные электроды;
- 18. Рис.4. Ион-селективные электроды: а – стеклянный электрод; б – электрод с кристаллической мембраной; в – твердотельный
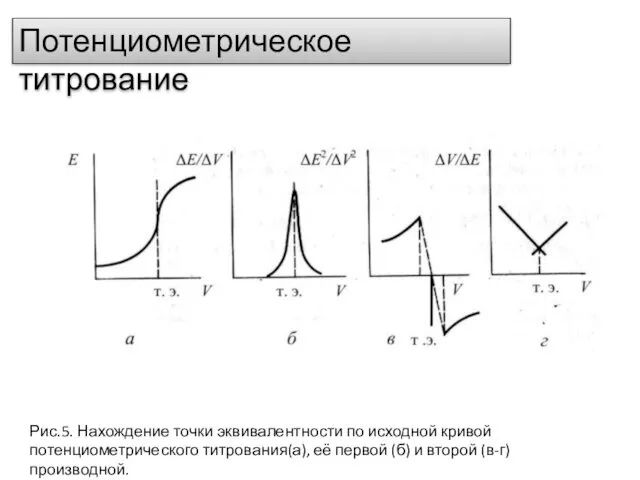
- 19. Потенциометрическое титрование Рис.5. Нахождение точки эквивалентности по исходной кривой потенциометрического титрования(а), её первой (б) и второй
- 20. Преимуществами метода потенциометрического титрования по сравнению с обычным титрованием являются возможность: титровать окрашенные растворы, когда цветные
- 21. Приборы в потенциометрии
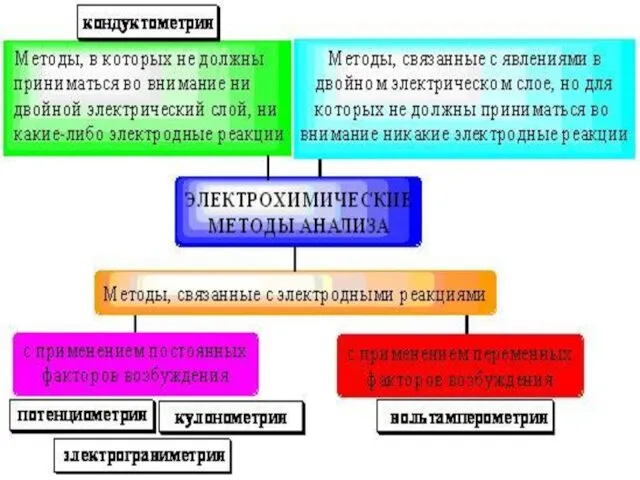
- 22. Электрохимические методы анализа — группа методов количественного химического анализа, основанные на использовании электролиза. Разновидностями метода являются
- 23. 1. Арзамасцев А.П. Фармакопейный анализ – М.: Медицина, 1971. 2. Беликов В.Г.Фармацевтическая химия. В 2 частях.
- 25. Скачать презентацию
















 Металлургия и экологические проблемы
Металлургия и экологические проблемы АПК Кожевниковского района
АПК Кожевниковского района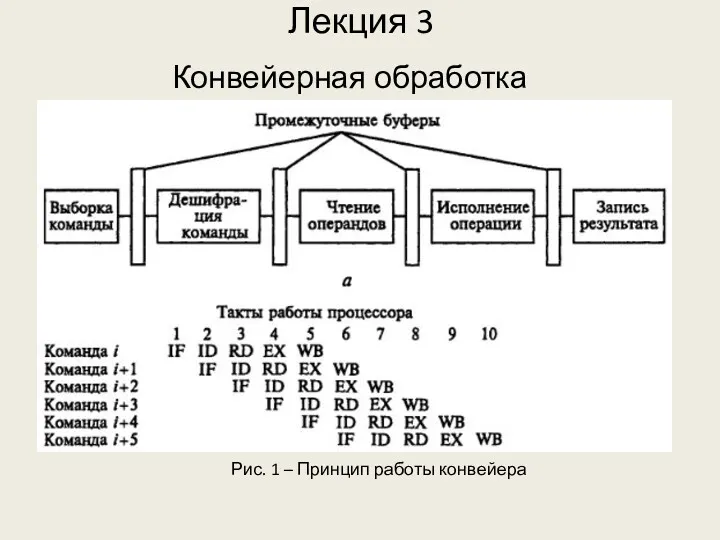 Конвейерная обработка
Конвейерная обработка Мистический Екатеринбург
Мистический Екатеринбург Презентация по технологии
Презентация по технологии Мир и согласие между людьми
Мир и согласие между людьми Hacking attacks
Hacking attacks Крепость Ладога (Старая Ладога)
Крепость Ладога (Старая Ладога) Презентация к уроку технологии 3 класс
Презентация к уроку технологии 3 класс Проектная деятельность Дорогою добра
Проектная деятельность Дорогою добра История развития ГИС за рубежом и в нашей стране. Наиболее популярные современные ГИС. Их краткая характеристика
История развития ГИС за рубежом и в нашей стране. Наиболее популярные современные ГИС. Их краткая характеристика Пирамида, её основание, вершина, боковые рёбра, высота, боковая поверхность
Пирамида, её основание, вершина, боковые рёбра, высота, боковая поверхность Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Пасха
Пасха Дошкольный возраст. Социальная ситуация развития
Дошкольный возраст. Социальная ситуация развития Проект Театр дарит радость
Проект Театр дарит радость Трудности адаптации пятиклассников.
Трудности адаптации пятиклассников. Розрахункова схема дорожнього одягу та її розвиток. Лекція №3
Розрахункова схема дорожнього одягу та її розвиток. Лекція №3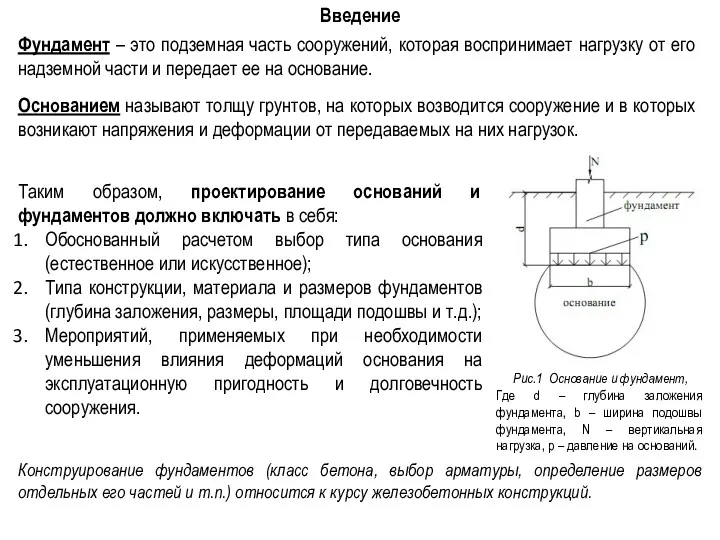 Введение. Фундамент. Основание
Введение. Фундамент. Основание Презентация к уроку по теме Гидролиз 9 класс
Презентация к уроку по теме Гидролиз 9 класс Добро и зло
Добро и зло Расчет ПГУ с АБХМ
Расчет ПГУ с АБХМ Озеро Ханка
Озеро Ханка Педагогический проект Театр и дети
Педагогический проект Театр и дети Конспект и презентация занятия внеурочной деятельности по теме :Лес. Словообразование по программе внеурочной деятельности Речевые игры.
Конспект и презентация занятия внеурочной деятельности по теме :Лес. Словообразование по программе внеурочной деятельности Речевые игры. Теоретические основы товароведения продовольственных товаров
Теоретические основы товароведения продовольственных товаров Иммунология. Антитела и В-лимфоциты. (Лекция 4)
Иммунология. Антитела и В-лимфоциты. (Лекция 4) Выпускники 2013 года. Диск
Выпускники 2013 года. Диск