Содержание
- 2. МККОС. Л.К. № 10. Попова Людмила Федоровна ЛИТЕРАТУРА
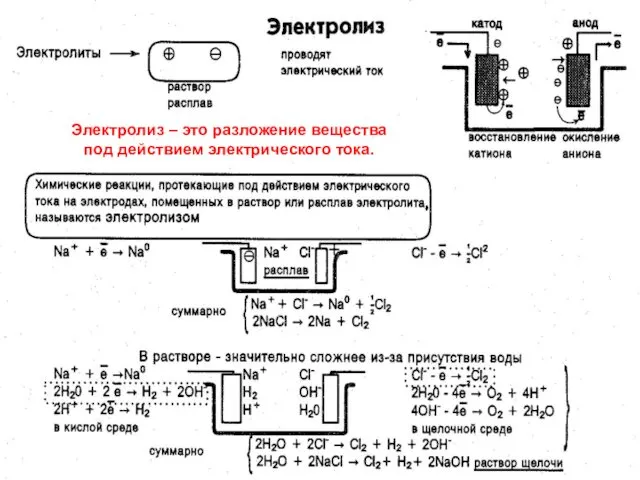
- 3. МККОС. Л.К. № 10. Попова Людмила Федоровна Электролиз – это разложение вещества под действием электрического тока.
- 4. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 5. МККОС. Л.К. № 10. Попова Людмила Федоровна Законы электролиза Масса вещества (m), выделившаяся при электролизе, прямо
- 6. МККОС. Л.К. № 10. Попова Людмила Федоровна Законы электролиза m = kЭ • Q = kЭ
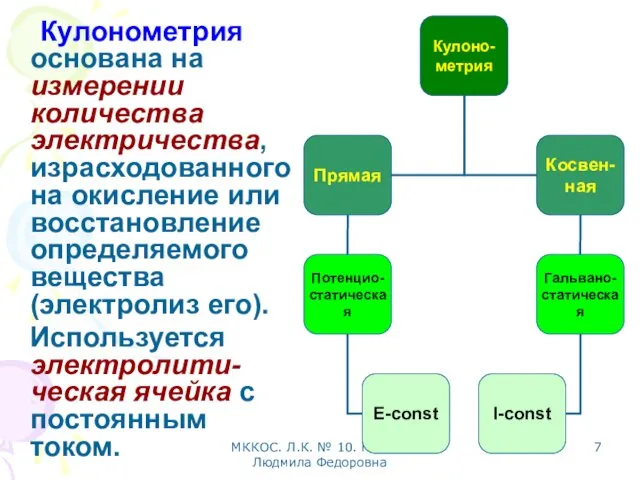
- 7. МККОС. Л.К. № 10. Попова Людмила Федоровна Кулонометрия основана на измерении количества электричества, израсходованного на окисление
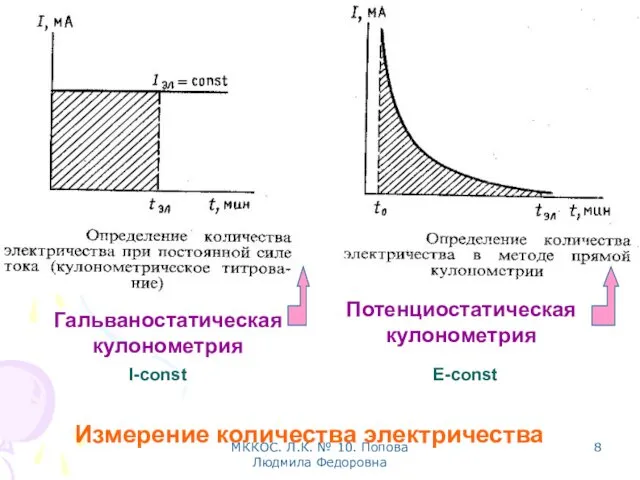
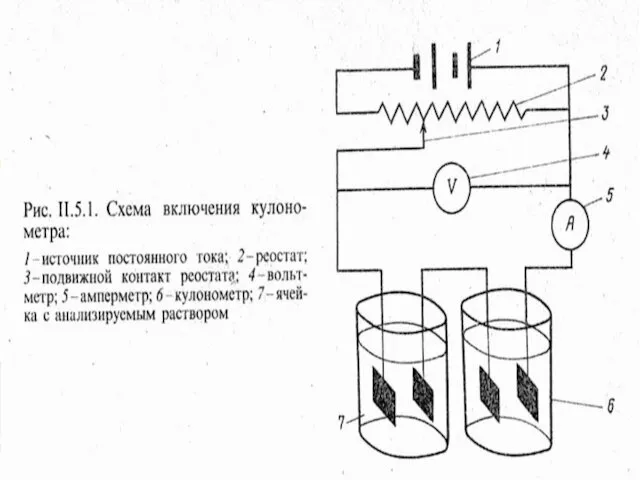
- 8. МККОС. Л.К. № 10. Попова Людмила Федоровна Потенциостатическая кулонометрия Гальваностатическая кулонометрия Измерение количества электричества I-const E-const
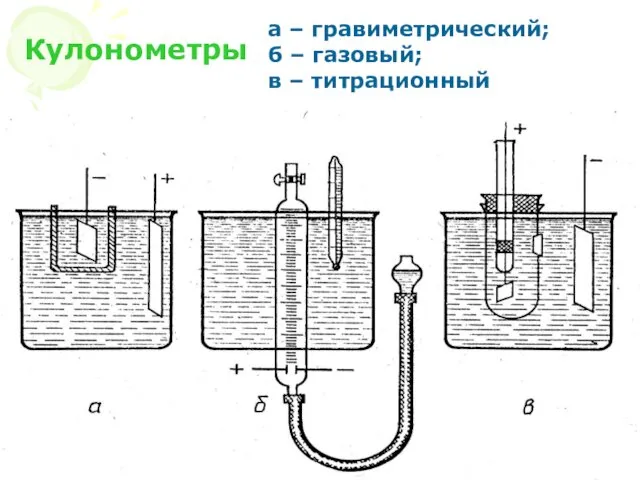
- 9. МККОС. Л.К. № 10. Попова Людмила Федоровна Кулонометры а – гравиметрический; б – газовый; в –
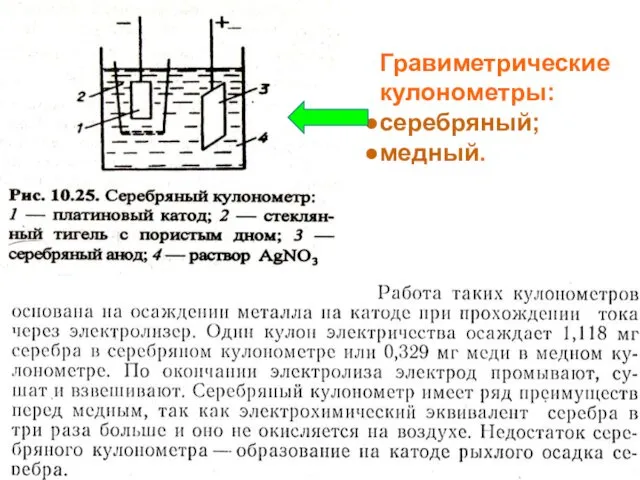
- 10. МККОС. Л.К. № 10. Попова Людмила Федоровна Гравиметрические кулонометры: серебряный; медный.
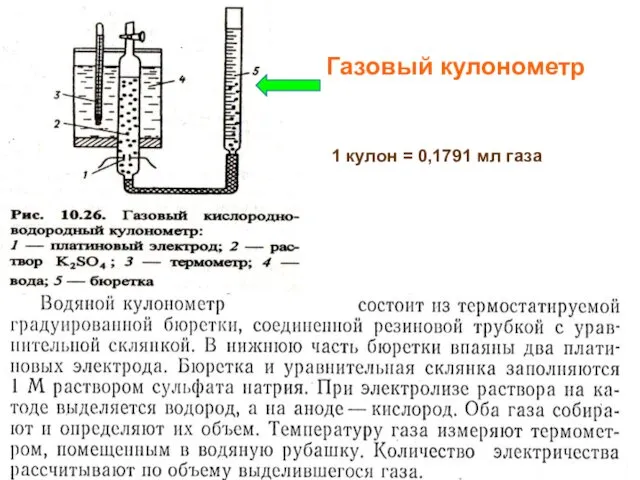
- 11. МККОС. Л.К. № 10. Попова Людмила Федоровна Газовый кулонометр 1 кулон = 0,1791 мл газа
- 12. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 13. МККОС. Л.К. № 10. Попова Людмила Федоровна Прямая кулонометрия В основе метода – непосредственное электропревращение определяемого
- 14. МККОС. Л.К. № 10. Попова Людмила Федоровна Для ускорения завершения электролиза применяют электрод с достаточно большой
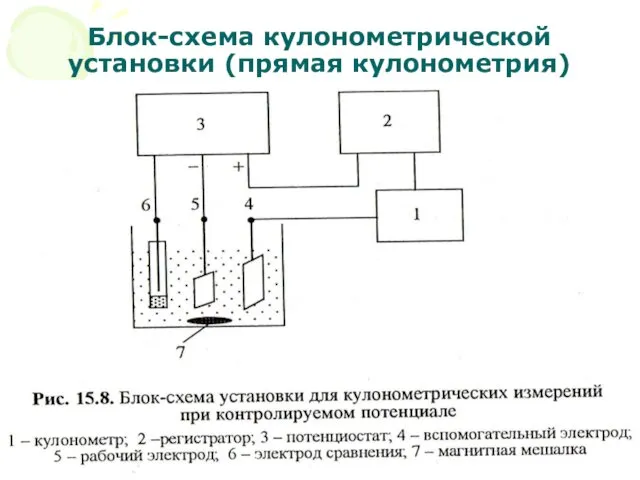
- 15. МККОС. Л.К. № 10. Попова Людмила Федоровна Блок-схема кулонометрической установки (прямая кулонометрия)
- 16. МККОС. Л.К. № 10. Попова Людмила Федоровна Прямая кулонометрия
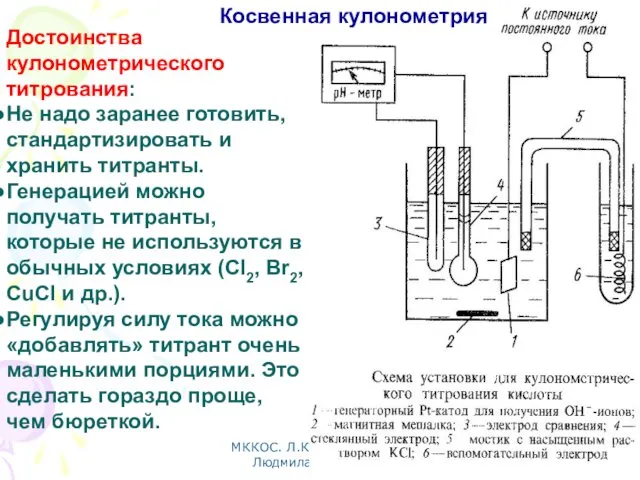
- 17. МККОС. Л.К. № 10. Попова Людмила Федоровна Косвенная кулонометрия В процессе кулонометрического титрования определяемое вещество реагирует
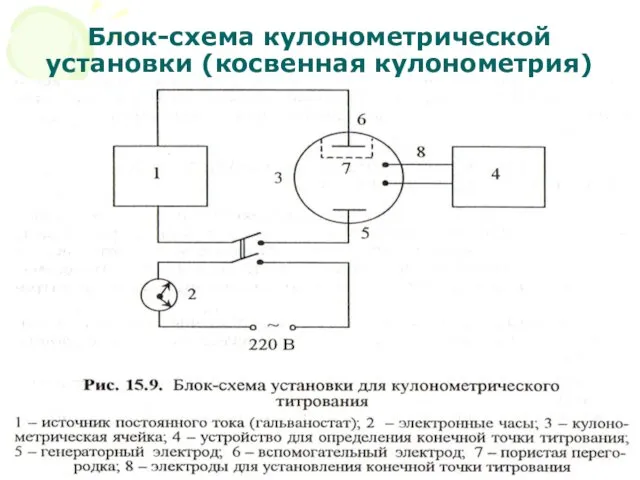
- 18. МККОС. Л.К. № 10. Попова Людмила Федоровна Блок-схема кулонометрической установки (косвенная кулонометрия)
- 19. МККОС. Л.К. № 10. Попова Людмила Федоровна Существует два приема получения электрогенерированного титранта: С внутренней генерацией
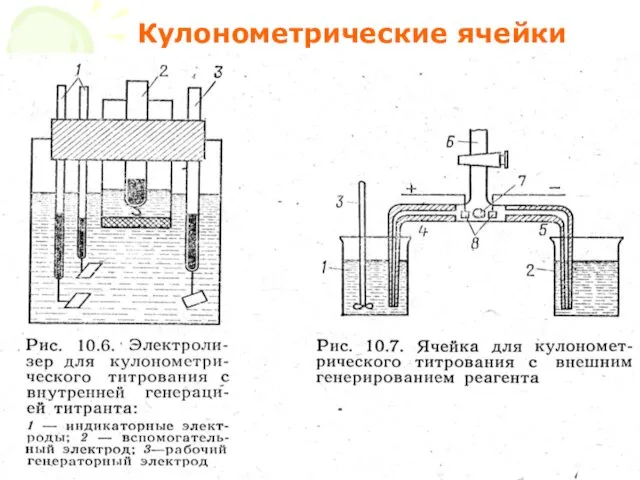
- 20. МККОС. Л.К. № 10. Попова Людмила Федоровна Кулонометрические ячейки
- 21. МККОС. Л.К. № 10. Попова Людмила Федоровна Достоинства кулонометрического титрования: Не надо заранее готовить, стандартизировать и
- 22. МККОС. Л.К. № 10. Попова Людмила Федоровна Применение кулонометрии Экспресс-анализаторы углерода и серы. Газоанализаторы на СО;
- 23. Поляризационные электрохимические методы
- 24. МККОС. Л.К. № 10. Попова Людмила Федоровна
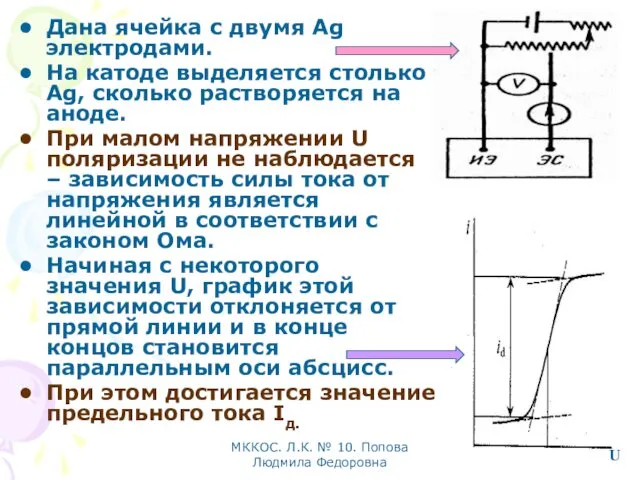
- 25. МККОС. Л.К. № 10. Попова Людмила Федоровна Дана ячейка с двумя Ag электродами. На катоде выделяется
- 26. МККОС. Л.К. № 10. Попова Людмила Федоровна Причина поляризации состоит в том, что разряд ионов на
- 27. МККОС. Л.К. № 10. Попова Людмила Федоровна Встречаются и необратимые виды поляризации: Омическая поляризация – обусловлена
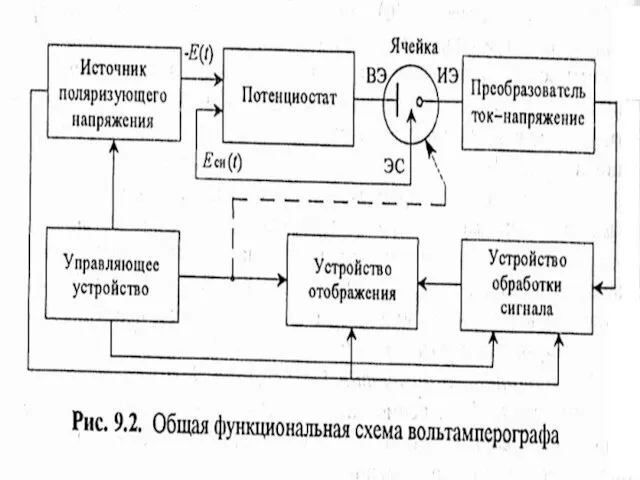
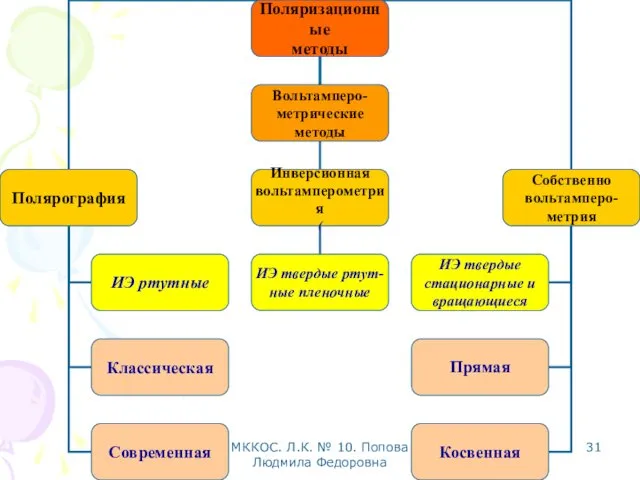
- 28. МККОС. Л.К. № 10. Попова Людмила Федоровна Вольтамперометрические методы Основаны на расшифровке поляризационных кривых (вольтамперограмм), полученных
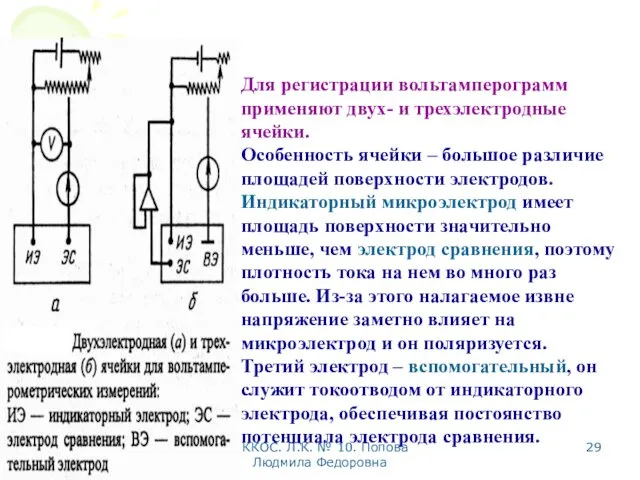
- 29. МККОС. Л.К. № 10. Попова Людмила Федоровна Для регистрации вольтамперограмм применяют двух- и трехэлектродные ячейки. Особенность
- 30. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 31. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 32. МККОС. Л.К. № 10. Попова Людмила Федоровна
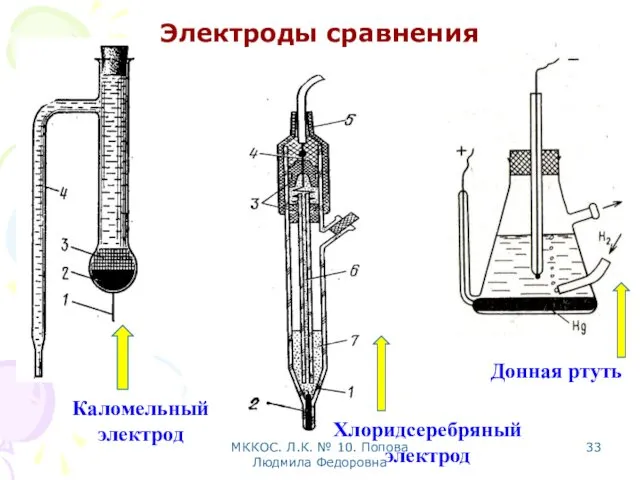
- 33. МККОС. Л.К. № 10. Попова Людмила Федоровна Электроды сравнения Донная ртуть Каломельный электрод Хлоридсеребряный электрод
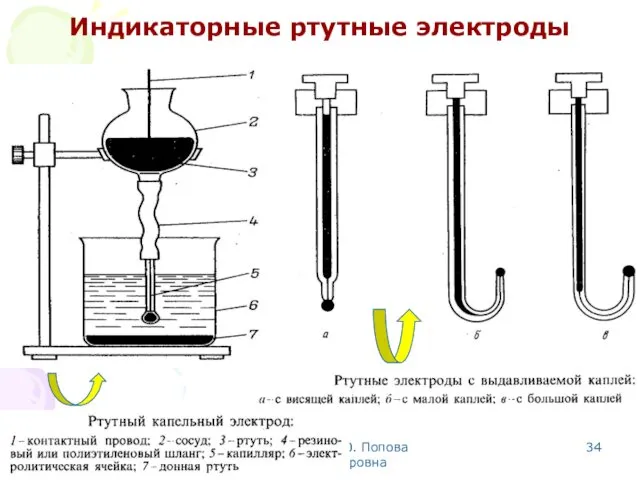
- 34. МККОС. Л.К. № 10. Попова Людмила Федоровна Индикаторные ртутные электроды
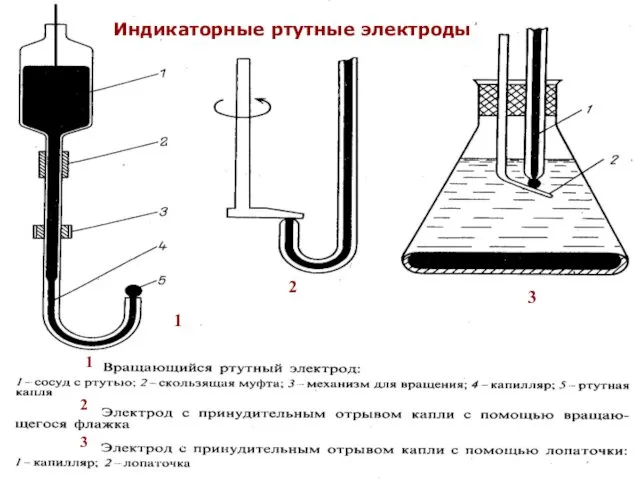
- 35. МККОС. Л.К. № 10. Попова Людмила Федоровна 1 1 2 3 2 3 Индикаторные ртутные электроды
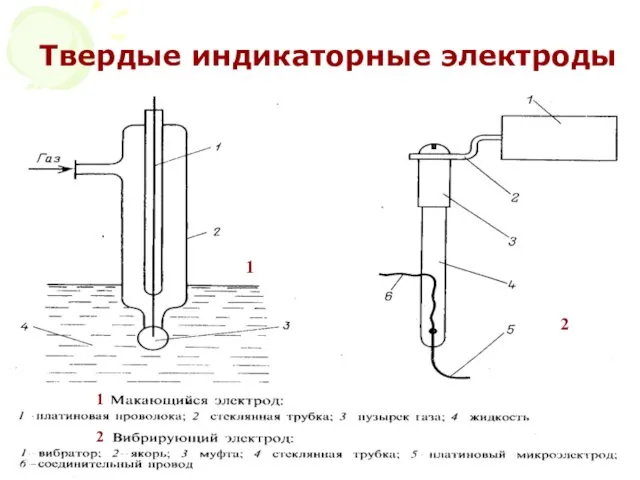
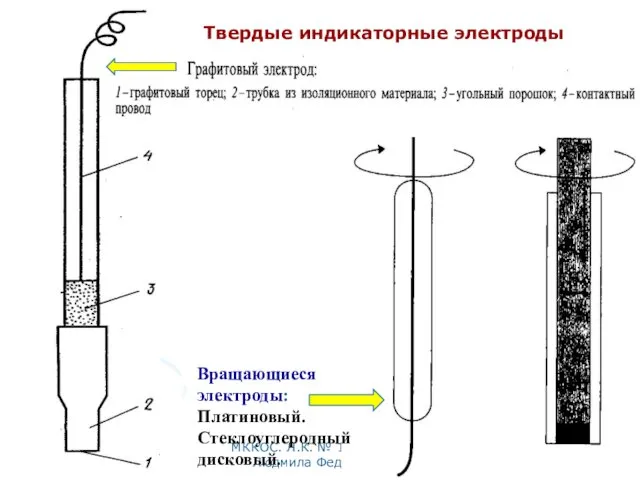
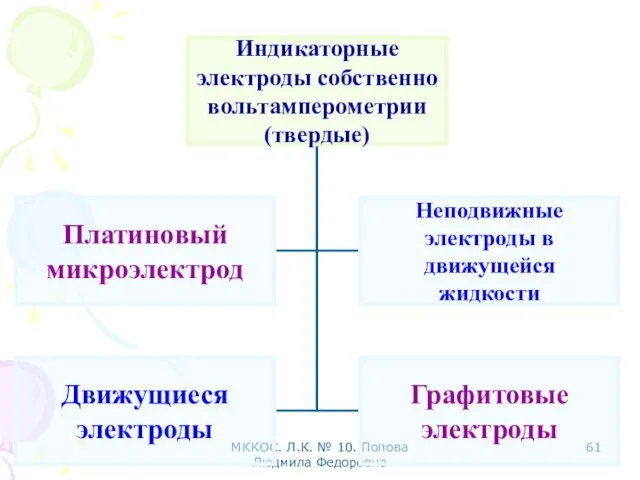
- 36. МККОС. Л.К. № 10. Попова Людмила Федоровна Твердые индикаторные электроды 1 1 2 2
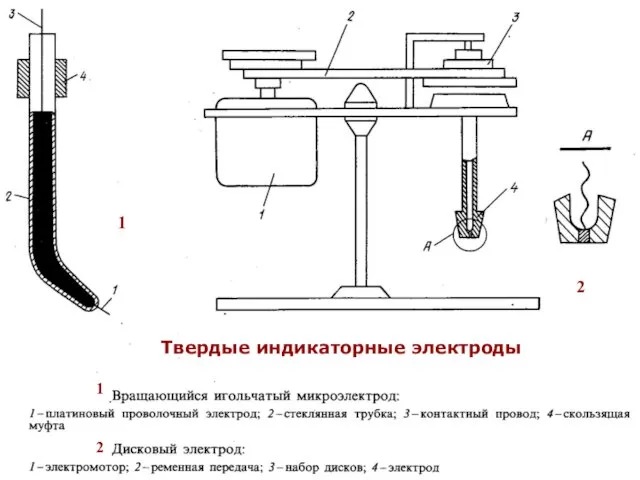
- 37. МККОС. Л.К. № 10. Попова Людмила Федоровна 1 1 2 2 Твердые индикаторные электроды
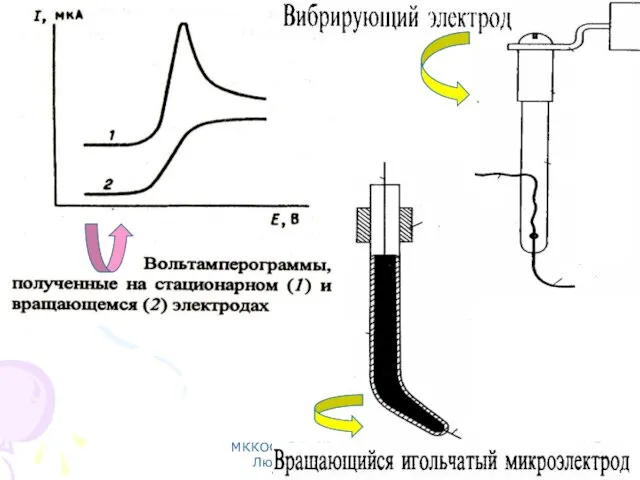
- 38. МККОС. Л.К. № 10. Попова Людмила Федоровна Вращающиеся электроды: Платиновый. Стеклоуглеродный дисковый. Твердые индикаторные электроды
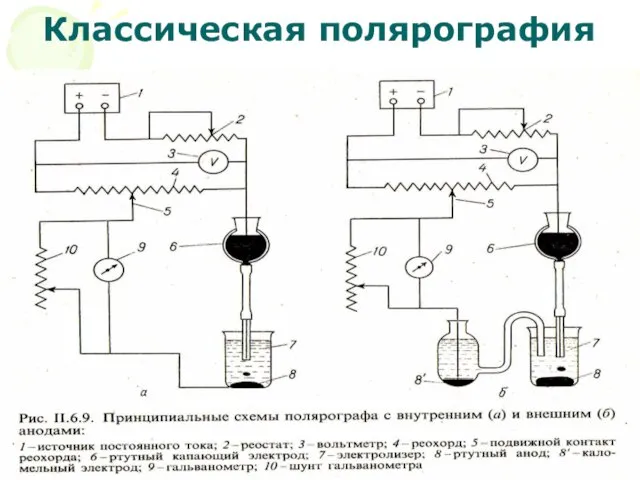
- 39. МККОС. Л.К. № 10. Попова Людмила Федоровна Классическая полярография
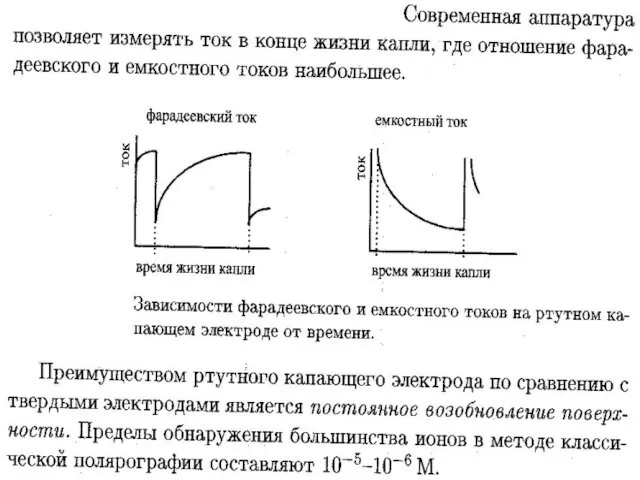
- 40. МККОС. Л.К. № 10. Попова Людмила Федоровна Достоинства: Из-за постоянной скорости вытекания капель величина их поверхности
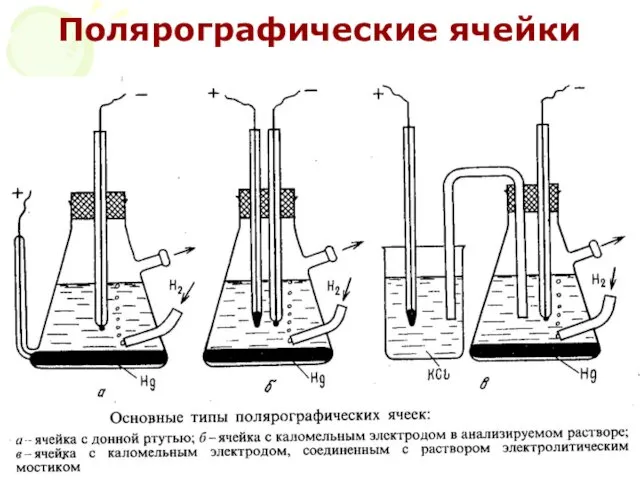
- 41. МККОС. Л.К. № 10. Попова Людмила Федоровна Полярографические ячейки
- 42. МККОС. Л.К. № 10. Попова Людмила Федоровна Внешнее напряжение, налагаемое на полярографическую ячейку, расходуется на изменение
- 43. МККОС. Л.К. № 10. Попова Людмила Федоровна Если сопротивление раствора уменьшить, то и слагаемым IR можно
- 44. МККОС. Л.К. № 10. Попова Людмила Федоровна Перед регистрацией полярограммы необходимо удалить из раствора растворенный кислород
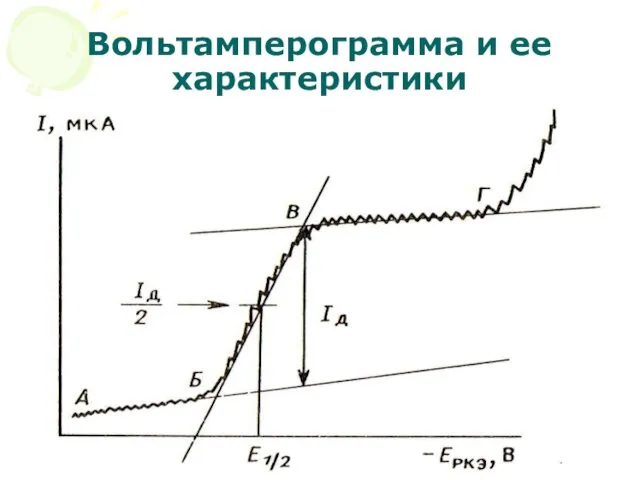
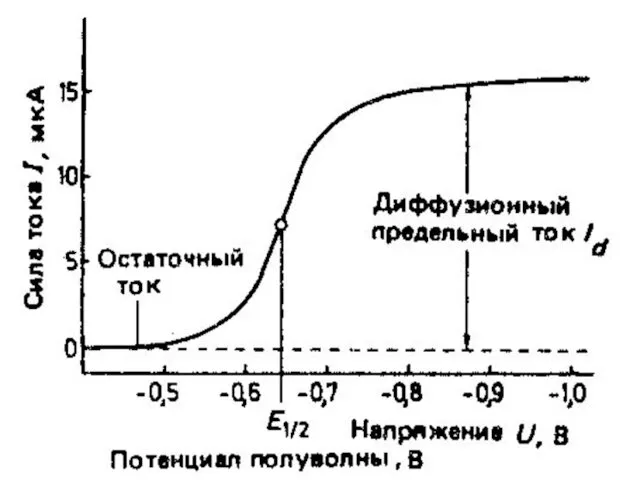
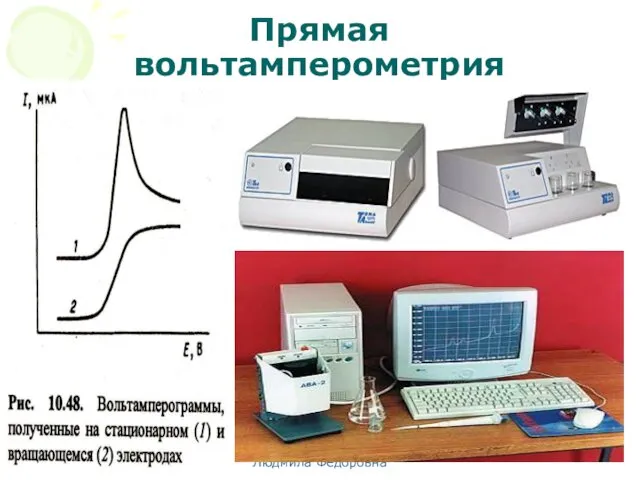
- 45. МККОС. Л.К. № 10. Попова Людмила Федоровна Вольтамперограмма и ее характеристики
- 46. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 47. МККОС. Л.К. № 10. Попова Людмила Федоровна Наличие остаточного тока (АБ) обусловлено двумя причинами: Могут восстанавливаться
- 48. МККОС. Л.К. № 10. Попова Людмила Федоровна Потенциал в точке (Б) – потенциал выделения. Он отвечает
- 49. МККОС. Л.К. № 10. Попова Людмила Федоровна Миграция ионов к катоду обусловлена действием его электрического поля.
- 50. МККОС. Л.К. № 10. Попова Людмила Федоровна Участок (БВ) – здесь идет рост тока (I), достигающий
- 51. МККОС. Л.К. № 10. Попова Людмила Федоровна При этом возникает приэлектродный слой, где концентрация деполяризатора падает
- 52. МККОС. Л.К. № 10. Попова Людмила Федоровна Диффундирующие к поверхности электрода катионы восстанавливаются, но т.к. разность
- 53. МККОС. Л.К. № 10. Попова Людмила Федоровна Предельный ток складывается из фарадеевского, миграционного и конвекционного токов.
- 54. МККОС. Л.К. № 10. Попова Людмила Федоровна
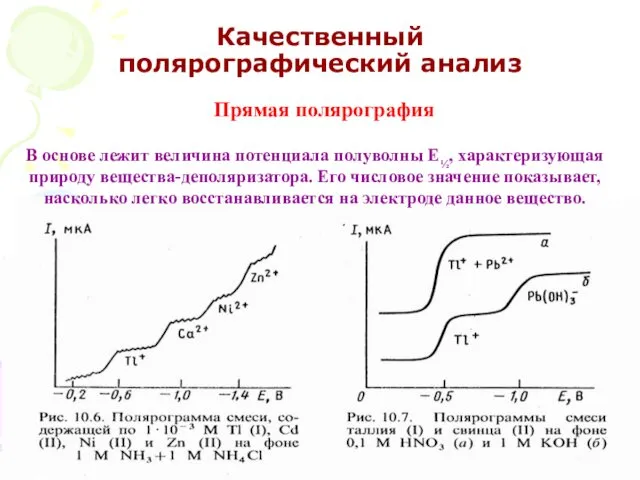
- 55. МККОС. Л.К. № 10. Попова Людмила Федоровна Качественный полярографический анализ В основе лежит величина потенциала полуволны
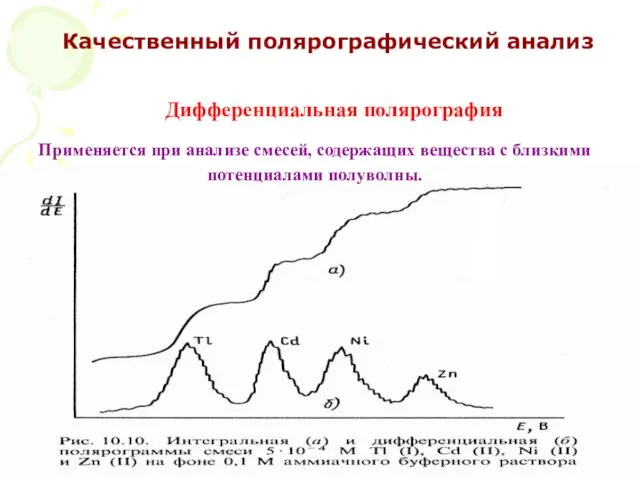
- 56. МККОС. Л.К. № 10. Попова Людмила Федоровна Качественный полярографический анализ Применяется при анализе смесей, содержащих вещества
- 57. МККОС. Л.К. № 10. Попова Людмила Федоровна Количественный полярографический анализ Основан на непосредственном применении уравнения Ильковича.
- 58. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 59. МККОС. Л.К. № 10. Попова Людмила Федоровна Современные разновидности полярографии Улучшают Соотношение: За счет: Увеличения IF
- 60. МККОС. Л.К. № 10. Попова Людмила Федоровна Вольтамперометрия Это поляризационные электрохимические методы, основанные на изучении вольтамперограмм,
- 61. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 62. МККОС. Л.К. № 10. Попова Людмила Федоровна Способы очистки поверхности индикаторного электрода Механический – полировка тонкой
- 63. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 64. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 65. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 66. МККОС. Л.К. № 10. Попова Людмила Федоровна Прямая вольтамперометрия
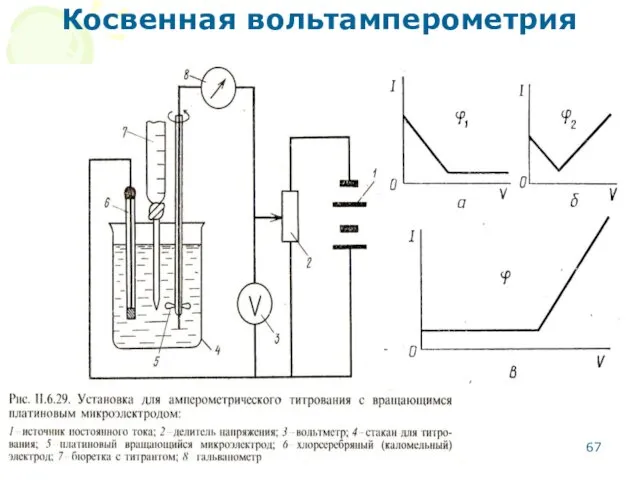
- 67. МККОС. Л.К. № 10. Попова Людмила Федоровна Косвенная вольтамперометрия
- 68. МККОС. Л.К. № 10. Попова Людмила Федоровна Основные этапы амперометрического титрования Вольтамперометрическое исследование – определение условий
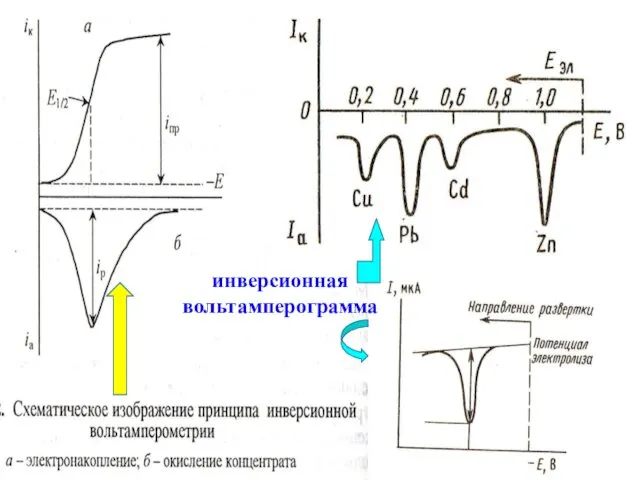
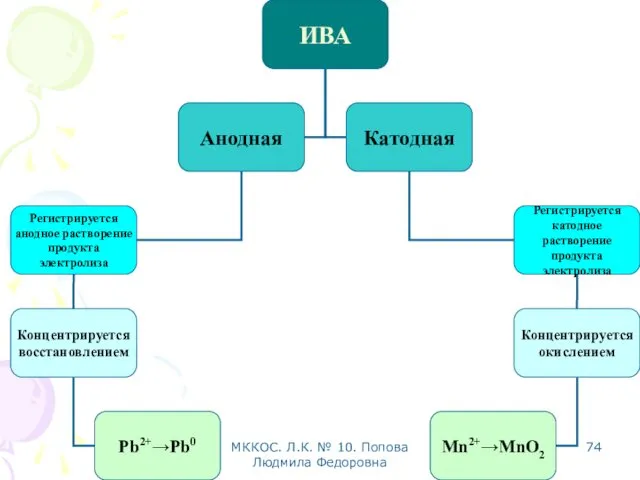
- 69. МККОС. Л.К. № 10. Попова Людмила Федоровна Инверсионная вольтамперометрия (ИВА)
- 70. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 71. МККОС. Л.К. № 10. Попова Людмила Федоровна
- 72. МККОС. Л.К. № 10. Попова Людмила Федоровна
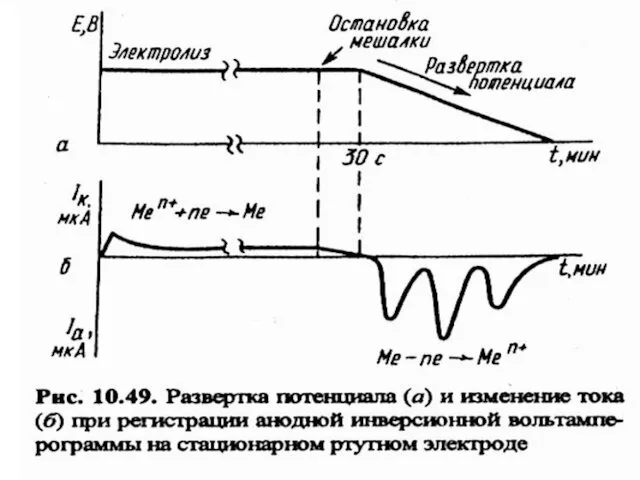
- 73. МККОС. Л.К. № 10. Попова Людмила Федоровна инверсионная вольтамперограмма
- 74. МККОС. Л.К. № 10. Попова Людмила Федоровна
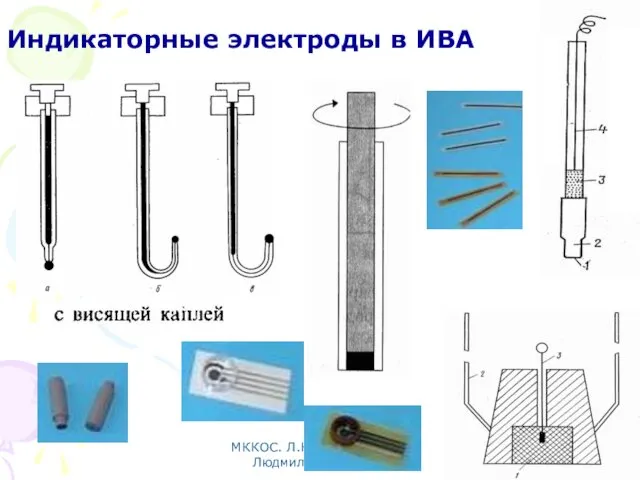
- 75. МККОС. Л.К. № 10. Попова Людмила Федоровна Индикаторные электроды в ИВА
- 77. Скачать презентацию






































 Особенности календарного праздника Егорьев день
Особенности календарного праздника Егорьев день Державні замовлення та сучасні контрактні системи
Державні замовлення та сучасні контрактні системи Дидактическая игра как метод и форма обучения
Дидактическая игра как метод и форма обучения Презентация рабочей программы кружка по конструированию Путешествие Роботенка
Презентация рабочей программы кружка по конструированию Путешествие Роботенка Презентация Вода - источник жизни
Презентация Вода - источник жизни Структура трехуровневой распределенной АСУ ТП
Структура трехуровневой распределенной АСУ ТП Конституция Германской империи 1871 года
Конституция Германской империи 1871 года Портфолио преподавателя
Портфолио преподавателя Программа мониторинга уровня сформированности УУД в начальной школе
Программа мониторинга уровня сформированности УУД в начальной школе презентация Игровая деятельность в ДОУ
презентация Игровая деятельность в ДОУ Виды капитального ремонта
Виды капитального ремонта Способы быстрого умножения. 5 класс
Способы быстрого умножения. 5 класс Мини-проект как одна из форм деятельности на уроке информатики. 5 класс
Мини-проект как одна из форм деятельности на уроке информатики. 5 класс cdb57-660f1006
cdb57-660f1006 Презентация по географии 6 класс Волны и их виды
Презентация по географии 6 класс Волны и их виды Радиолокационная система РТВ
Радиолокационная система РТВ Пунктуация в предложениях с однородными членами
Пунктуация в предложениях с однородными членами Кроссворд по правилам дорожного движения (с использованием клавиатуры)
Кроссворд по правилам дорожного движения (с использованием клавиатуры) Гомогенизация молочного сырья. Механическая обработка молочного сырья
Гомогенизация молочного сырья. Механическая обработка молочного сырья Система оповещения населения о чрезвычайных ситуациях
Система оповещения населения о чрезвычайных ситуациях Биологическое действие излучения
Биологическое действие излучения prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj
prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj Искусственный интеллект
Искусственный интеллект Театр будущего и будущее театра
Театр будущего и будущее театра Творчество Т.Г. Шевченко
Творчество Т.Г. Шевченко Зачем мы изучаем логарифмы
Зачем мы изучаем логарифмы Презентация к Уроку - 75 л. образования Краснодарского края
Презентация к Уроку - 75 л. образования Краснодарского края Татарские народные костюмы!!!
Татарские народные костюмы!!!