Содержание
- 2. Рекомендовано к изданию методическим советом института химии и экологии ФГБОУ ВО «ВятГУ» в качестве учебного пособия
- 3. Краткая информация о курсе Лекции – 18 ч; Лабораторные занятия – 36 ч (6 шести часовых);
- 4. Прикладная электрохимия : учеб. / Р. И. Агладзе [и др.]; под ред. А. П. Томилова. -
- 5. Преимущества и недостатки электрохимического способа получения химических продуктов Преимущества электрохимического способа получения веществ по сравнению с
- 6. Недостатки: 1. Большой удельный расход электроэнергии (Wуд). Несмотря на то, что выход по току (ВТ) обычно
- 7. Обычно разрабатывается и используется несколько методов получения продукта, но преимущественно используется метод, оптимальный по сумме технико-экономических
- 8. Электроды – основные конструктивные элементы электролизеров – наиболее сложная и дорогостоящая их часть. От устройства электродов
- 9. Материал катода – обычная сталь, которая при катодной поляризации достаточно стойка во многих электролитах. Лишь в
- 10. Обеспечение достаточно развитой поверхности для интенсификации процесса и создания компактных электролизеров. Обеспечение максимального сближения катода и
- 11. Электропроводность чистой воды мала: водопроводной близка к 10-1, а дистиллированной – 4⋅10-6 Ом-1м-1. Для увеличения электропроводности,
- 12. При промышленном получении водорода применяют растворы щелочей. На катоде в щелочных растворах разряжаются молекулы воды: Н2О
- 13. Для электролиза применяют чистый щелочной электролит, приготовленный на дистиллированной воде из реактивов марки «ч». Поэтому единственной
- 14. Напряжение на ванне Uв – сумма падений напряжения на всех последовательных участках прохождения электрического тока через
- 15. Теоретическое напряжение разложения – термодинамическая характеристика электрохимической системы, мало зависит от условий электролиза. Величину Етеор рассчитывают
- 16. Перенапряжение – отклонение потенциала электрода под током от его равновесного значения (η = Еi – Ер)
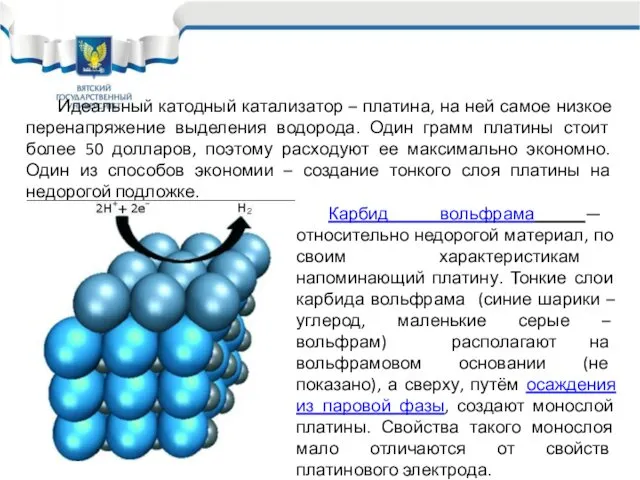
- 17. Идеальный катодный катализатор – платина, на ней самое низкое перенапряжение выделения водорода. Один грамм платины стоит
- 18. Падение напряжения в электролите Падение напряжения в электролите рассчитывается по формуле: ΔUэл-т = Кг , где
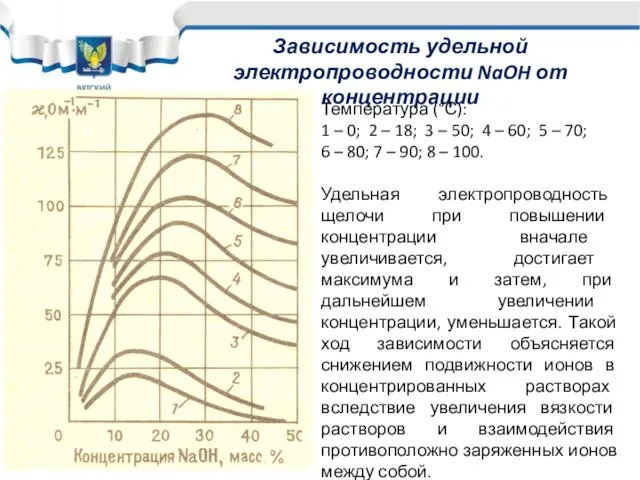
- 19. Зависимость удельной электропроводности NaOH от концентрации Температура (°С): 1 – 0; 2 – 18; 3 –
- 20. При увеличении температуры удельная электропроводность электролита повышается. Электролиз проводят при максимально возможных температурах, если при этом
- 21. Если основной электродный процесс – выделение газа, газонаполнение может достигать десятков процентов. Основной метод снижения газонаполнения
- 22. Падение напряжения в диафрагме определяется не только свойствами электролита в порах диафрагмы, но и характеристиками диафрагмы.
- 23. При электролизе воды используют асбестовую диафрагму. В процессе работы за счет набухания асбестовых волокон увеличивается толщина
- 24. В процессе электролиза воды напряжение на ванне быстро увеличивается в первые 12–24 часа, затем медленно поднимается
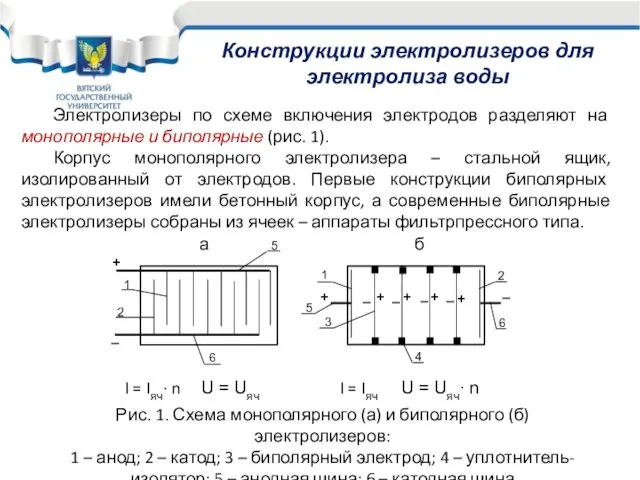
- 25. Конструкции электролизеров для электролиза воды I = Iяч∙ n U = Uяч I = Iяч U
- 26. Преимущества: Увеличение мощности за счет повышения токовой нагрузки и количества последовательно включенных ячеек, следовательно, сокращение производственных
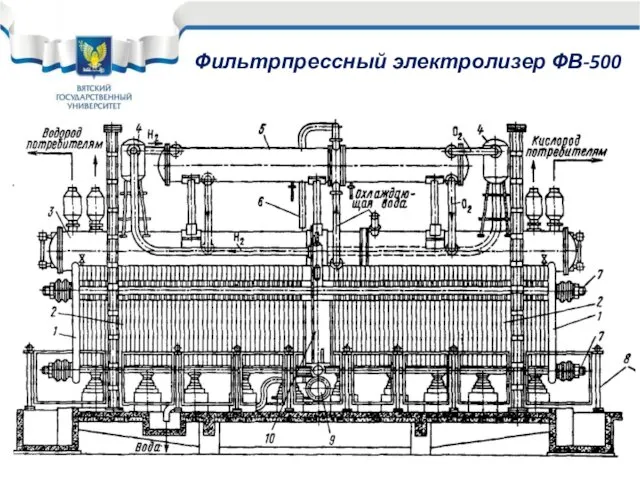
- 27. Фильтрпрессный электролизер ФВ-500
- 28. Электролизер ФВ-500
- 29. Электролизер ФВ-500 – агрегат, включающий всю вспомогательную аппаратуру для первичной обработки (отделение газов от электролита, охлаждение
- 30. Ячейка фильтрпрессного электролизера 1 – диафрагменная рама; 2 – диафрагма; 3 – биполярный электрод (основной сплошной
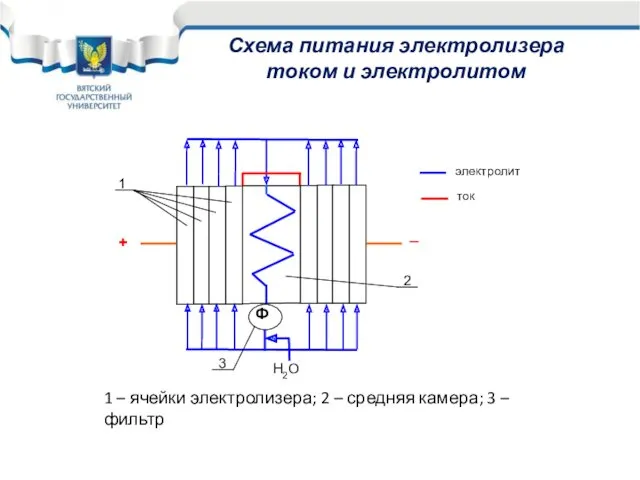
- 31. Схема питания электролизера током и электролитом
- 32. Средняя камера электролизера предназначена для охлаждения циркулирующего электролита, перемешивания и выравнивания концентрации щелочи в католите и
- 33. Утечки тока из ячеек по штуцерам и вдоль каналов имеют два пути: по раствору; по диафрагменным
- 34. Электролизер ФВ-180
- 36. Скачать презентацию


![Прикладная электрохимия : учеб. / Р. И. Агладзе [и др.];](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/57497/slide-3.jpg)

























 Балалайка - музыкальный символ России
Балалайка - музыкальный символ России Организация ремонтных работ токарного металло-обрабатываюшего с ЧПУ станка серии СТ16А25АМ
Организация ремонтных работ токарного металло-обрабатываюшего с ЧПУ станка серии СТ16А25АМ Презентация
Презентация Прекращение горения на пожаре. Способы прекращения горения на пожаре
Прекращение горения на пожаре. Способы прекращения горения на пожаре Образовательный проект Елочка красавица
Образовательный проект Елочка красавица Психология педагогического общения: конфликты и пути их разрешения
Психология педагогического общения: конфликты и пути их разрешения Презентация для начальных классов Конвенция и права детей
Презентация для начальных классов Конвенция и права детей Лента Мёбиуса. (6 класс)
Лента Мёбиуса. (6 класс) Электронное портфолио
Электронное портфолио Цвета. Colours
Цвета. Colours Совершенствование систем оплаты труда в вузах
Совершенствование систем оплаты труда в вузах Всемирный день хлеба
Всемирный день хлеба Азбука театра
Азбука театра Николай Васильевич Гоголь Пьеса Ревизор. Действие 4. Чиновники на приёме у ревизора
Николай Васильевич Гоголь Пьеса Ревизор. Действие 4. Чиновники на приёме у ревизора Источники тока в электрической цепи
Источники тока в электрической цепи Опасности в интернете. Мошенники в интернете
Опасности в интернете. Мошенники в интернете 20 марта - Международный День счастья
20 марта - Международный День счастья Образование и культура в XVII веке в России
Образование и культура в XVII веке в России Презентация аналитического отчета за 2012-2013 уч.г.
Презентация аналитического отчета за 2012-2013 уч.г. Прибыль и рентабельность
Прибыль и рентабельность SLOBODA-2018 Новогодний банкет
SLOBODA-2018 Новогодний банкет Мастерство работника. 7 класс
Мастерство работника. 7 класс Клетка. Ядро
Клетка. Ядро Михаил Юрьевич Лермонтов
Михаил Юрьевич Лермонтов Проектирование тепловой защиты зданий
Проектирование тепловой защиты зданий Анкилозирующий спондилит и другие серонегативные спондилоартропатии
Анкилозирующий спондилит и другие серонегативные спондилоартропатии Слайды о зубах на тувинском языке
Слайды о зубах на тувинском языке Бюджет для граждан. К бюджету города Боровичи на 2020 год и на плановый период 2021 и 2022 годов
Бюджет для граждан. К бюджету города Боровичи на 2020 год и на плановый период 2021 и 2022 годов