Содержание
- 2. Процесс распада электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией. Положительные ионы называют
- 3. ДИССОЦИАЦИЯ КИСЛОТ: H2SO4 → 2H+ + SO42- HCl → H+ + Cl- HNO3 → H+ +
- 4. ДИССОЦИАЦИЯ ОСНОВАНИЙ: NaOH → Na+ + OH-; Ca(OH)2 → Ca2+ + 2OH-;
- 5. Диссоциация растворимых солей: NaCI Na+ + CI- AI2(SO4)3 2AI3+ + 3SO42-
- 6. ДИССОЦИАЦИЯ ВОДЫ: Н2О → Н+ + ОН –
- 7. В чистой воде соотношение ионов водорода и гидроксид-ионов равное: Н+ = ОН- среда нейтральная; При добавлении
- 8. ГИДРОЛИЗ СОЛЕЙ Гидролиз солей Учитель химии: А.А. Намы
- 9. ГИДРОЛИЗ - от греч. «гидро» - вода, «лизис» - разложение.
- 10. ГИДРОЛИЗ СОЛЕЙ – реакция обмена между солью и водой, приводящая к образованию слабого электролита.
- 11. 4 ТИПА СОЛЕЙ: соль, образованная сильной кислотой и слабым основанием (ALCl3); сильным основанием и слабой кислотой
- 12. : Соль, образованная сильной кислотой и слабым основанием. AlCl3 → Al3+ + 3Cl-; Н2О → Н+
- 13. Соль, образованная, сильным основанием и слабой кислотой. Na2S 2Na++S2- Н2О → Н+ + ОН –; S2-
- 14. Соль, образованная сильным основанием и сильной кислотой КСl + Н2О ↔ КСl ↔ К + +
- 15. Соль, образованная слабым основанием и сильной кислотой. CH3COONH4 CH3COO- +NH4+ Н2О → Н+ + ОН –;
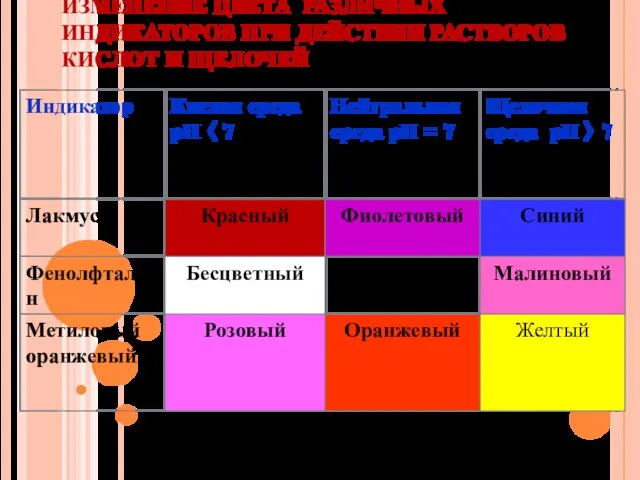
- 16. Индикаторы –вещества, которые меняют окраску в зависимости от среды.
- 17. ИЗМЕНЕНИЕ ЦВЕТА РАЗЛИЧНЫХ ИНДИКАТОРОВ ПРИ ДЕЙСТВИИ РАСТВОРОВ КИСЛОТ И ЩЕЛОЧЕЙ
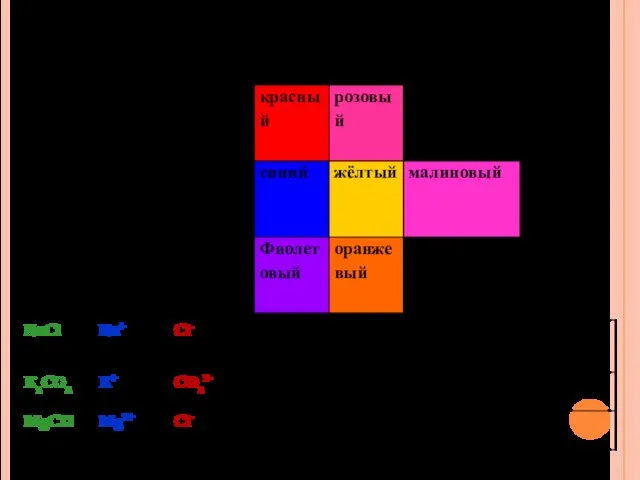
- 18. Демонстрационный опыт: к раствору соды Na2CO3 приливаем поочерёдно индикаторы лакмус и метилоранж, фенолфталеин. Na2CO3
- 19. Каждой группе предлагаю по одному примеру провести исследование солей: Al2(SO4)3, NH4NO3, СuSO4, Na3PO4, NaCl, Na2CO3, Na2SO3
- 20. Задание №1. а) используя метилоранж или лакмус, определите среду раствора соли сульфата алюминия.
- 21. Вывод: раствор соли, образованной слабым основанием и сильной кислотой имеет кислую среду.
- 22. ЗАДАНИЕ №2. а) используя метилоранж или лакмус, определите среду раствора соли фосфата натрия.
- 23. КАКОЙ ВЫВОД МОЖНО СДЕЛАТЬ, ИСХОДЯ ИЗ СОСТАВА СОЛИ И СРЕДОЙ ЕЁ РАСТВОРА? Раствор соли, образованной сильным
- 24. Задание №3. а) определить среду раствора соли, образованной сильной кислотой и сильным основанием NaCI. б) обосновать
- 25. Вывод: Среда нейтральная,т.к. не образуется слабый электролит; такие соли гидролизу не подвергаются.
- 27. СИЛУ УМУ ПРИДАЮТ УПРАЖНЕНИЯ 1.Кислую среду имеет водный раствор: а.Na3PO4 б.KCl в.Na2CO3 г. ZnSO4 2.Щелочную среду
- 28. 3.Нейтральную среду имеет раствор: а. Нитрата меди (II) Cu(NO3)2 б.Нитрата бария BaNO3 в.Ацетата калия CH3COONH4 г.Карбоната
- 29. 5.Кислую реакцию среды имеет каждый из двух растворов: а.BaCl2 и ZnCl2 б.AlCl3 и FeCl2 в.FeCl3 и
- 30. 7. Установите соответствие между составом соли и реакцией среды её водного раствора Ответ:
- 31. 8. Установите соответствие между названием соли и средой её водного раствора.
- 32. 9. Установите соответствие между названием соли и отношением её к гидролизу.
- 33. 10.Установите соответствие между названием соли и отношением её к гидролизу.
- 34. 11. Установите соответствие между веществом и продуктами его гидролиза.
- 36. Скачать презентацию

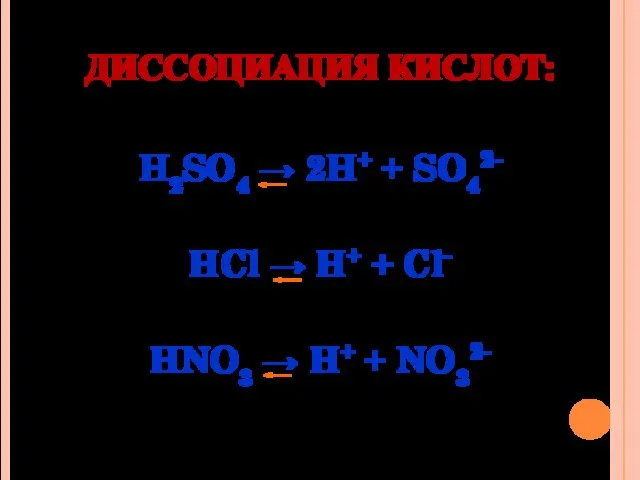


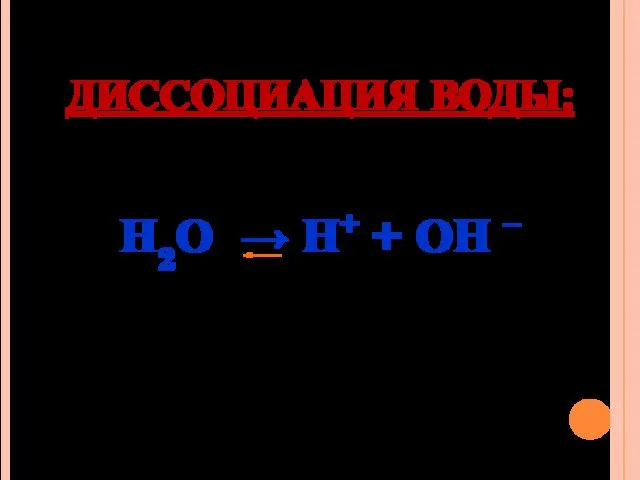


























 Добро и зло. Понятие греха, раскаяния и воздаянияв курсе ОРКСЭ Диск
Добро и зло. Понятие греха, раскаяния и воздаянияв курсе ОРКСЭ Диск Талант-шоу Time of changes
Талант-шоу Time of changes Использование ИКТ в работе учителя-логопеда
Использование ИКТ в работе учителя-логопеда Публичная презентация результатов педагогической деятельности учителя химии ГБОУ СОШ № 8 ОЦ Гербик Марины Александровны
Публичная презентация результатов педагогической деятельности учителя химии ГБОУ СОШ № 8 ОЦ Гербик Марины Александровны Зачетка №2: Новые коллекции матрасов
Зачетка №2: Новые коллекции матрасов Листовая штамповка. Обтяжка
Листовая штамповка. Обтяжка Московский технологический университет. Центр дистанционного обучения. Развитие информационного общества
Московский технологический университет. Центр дистанционного обучения. Развитие информационного общества Молодёжный центр им. А.П. Чехова Ленинского района города Новосибирска. Итоги реализации программы развития
Молодёжный центр им. А.П. Чехова Ленинского района города Новосибирска. Итоги реализации программы развития Бысровозводимые дома и их разновидности
Бысровозводимые дома и их разновидности Фоторезисторы. Классификация, назначение (функция) и области применения. Параметры и их расчетные формулы
Фоторезисторы. Классификация, назначение (функция) и области применения. Параметры и их расчетные формулы Об интеграции математики и естественно- научных дисциплин в контексте концепции математического образования.
Об интеграции математики и естественно- научных дисциплин в контексте концепции математического образования. Дорога и я. Правила дорожного движения для младших школьников
Дорога и я. Правила дорожного движения для младших школьников Экономика производителя
Экономика производителя Нейропсихологические синдромы поражения конвекситальной коры височной области мозга
Нейропсихологические синдромы поражения конвекситальной коры височной области мозга Искусство Древнего мира
Искусство Древнего мира Течения
Течения Презентация по теме Осложнения ЖКБ.
Презентация по теме Осложнения ЖКБ. Химия - это просто! Живые модели.
Химия - это просто! Живые модели. 9 д
9 д Проектирование технического и организационного обеспечения ИС. Лекция 9
Проектирование технического и организационного обеспечения ИС. Лекция 9 Сценарий выпускного вечера
Сценарий выпускного вечера Буддизм
Буддизм Project Kick-Off. Tube Bender Upgrade
Project Kick-Off. Tube Bender Upgrade Проектная деятельность в 1 классе
Проектная деятельность в 1 классе Конспект урока по ОРКСЭ Диск
Конспект урока по ОРКСЭ Диск Педагогический проект по ознакомлению дошкольников с их правами
Педагогический проект по ознакомлению дошкольников с их правами Компьютер или книга - что лучше
Компьютер или книга - что лучше London
London