Содержание
- 2. Введение Виды химической связи Основные положения строения атома Виды орбиталей Сигма-связь, пи-связь Метод валентных связей Основные
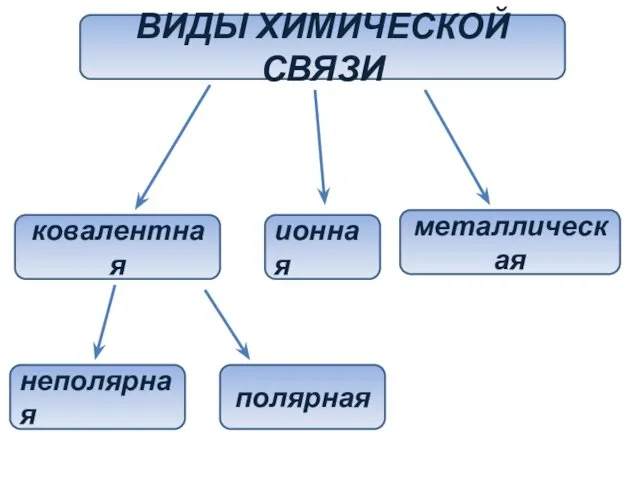
- 3. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ ковалентная ионная металлическая неполярная полярная
- 4. Al Na Ba Fe Mg Металлическая – в простых веществах-металлах
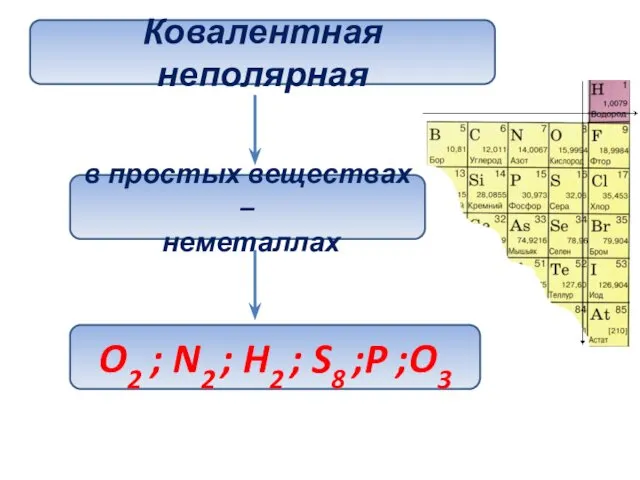
- 5. Ковалентная неполярная в простых веществах – неметаллах O2 ; N2 ; H2 ; S8 ;P ;O3
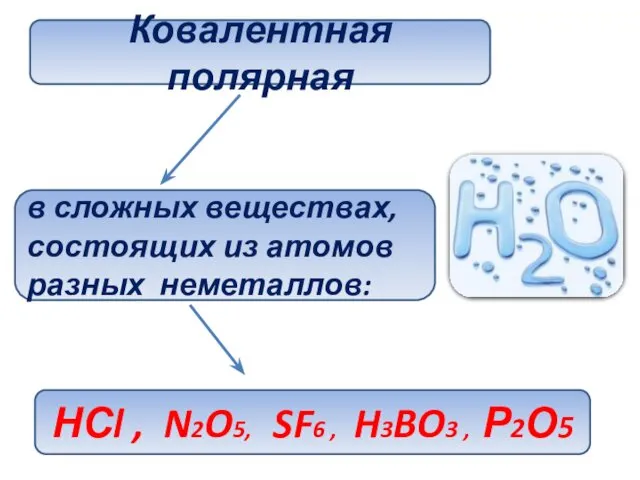
- 6. Ковалентная полярная в сложных веществах, состоящих из атомов разных неметаллов: НСl , N2O5, SF6 , H3BO3
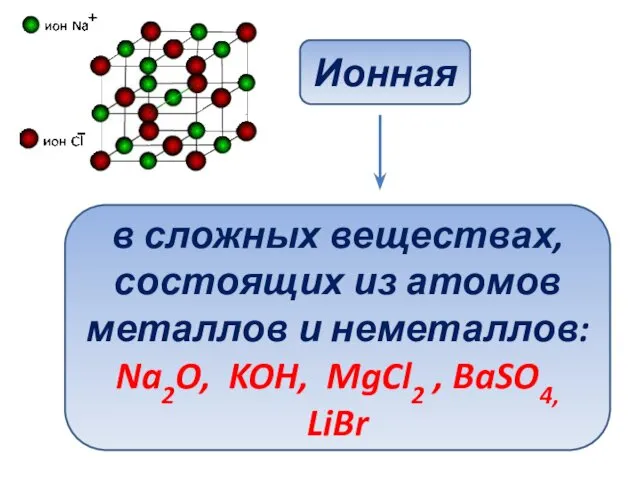
- 7. Ионная в сложных веществах, состоящих из атомов металлов и неметаллов: Na2O, KOH, MgCl2 , BaSO4, LiBr
- 8. Основные положения теории строения атома: Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. число
- 9. Нельзя проследить траекторию движения электрона. Область, в которой нахождение электрона наиболее вероятно, называют орбиталью. Орбитали различаются
- 10. Виды орбиталей (по форме): s-орбиталь р-орбиталь d-орбиталь f-орбиталь
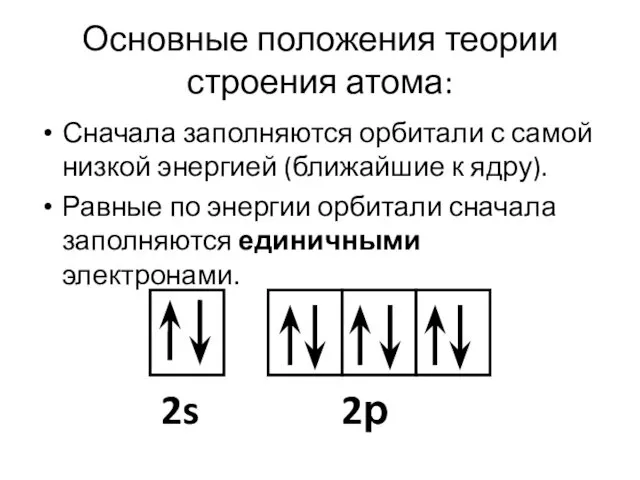
- 11. Основные положения теории строения атома: Сначала заполняются орбитали с самой низкой энергией (ближайшие к ядру). Равные
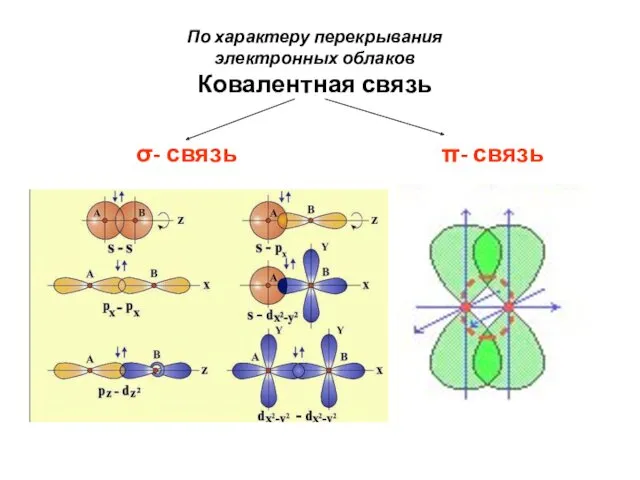
- 12. По характеру перекрывания электронных облаков Ковалентная связь σ- связь π- связь
- 13. Химические связи, образующиеся в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов, называют σ-связями.
- 14. Метод валентных связей (ВС) Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или
- 16. Скачать презентацию







 презентации по географии
презентации по географии Дробление. Биологическое значение дробления
Дробление. Биологическое значение дробления Жан-Мишель Баския (1960-1988)
Жан-Мишель Баския (1960-1988) Rabota_s_topograficheskoy_kartoy_1_2
Rabota_s_topograficheskoy_kartoy_1_2 Система инженерных изысканий в строительстве
Система инженерных изысканий в строительстве Программирование в компьютерных играх
Программирование в компьютерных играх Половинки (первый и последний звук)
Половинки (первый и последний звук) Влияние социальных сетей на подростков и молодежь
Влияние социальных сетей на подростков и молодежь Презентация Портфолио учителя-логопеда Чугуновой Н.Н.
Презентация Портфолио учителя-логопеда Чугуновой Н.Н. Угольная промышленность
Угольная промышленность Осенний листопад
Осенний листопад Гидроцефалия диагнозымен ауыратын жаңа туылған және 5 айлық балалардағы шунттау операциясы
Гидроцефалия диагнозымен ауыратын жаңа туылған және 5 айлық балалардағы шунттау операциясы Прямая и отрезок
Прямая и отрезок Профилактика аддиктивного поведения у младших школьников
Профилактика аддиктивного поведения у младших школьников Форми, види і економічні межі кредиту
Форми, види і економічні межі кредиту Проблема обеспечения надёжности технических объектов и основные пути её решения
Проблема обеспечения надёжности технических объектов и основные пути её решения Право в системе социальных норм
Право в системе социальных норм Правописание Ъ и Ь
Правописание Ъ и Ь Окружность. Длина окружности
Окружность. Длина окружности Современные проблемы цепочки поставок
Современные проблемы цепочки поставок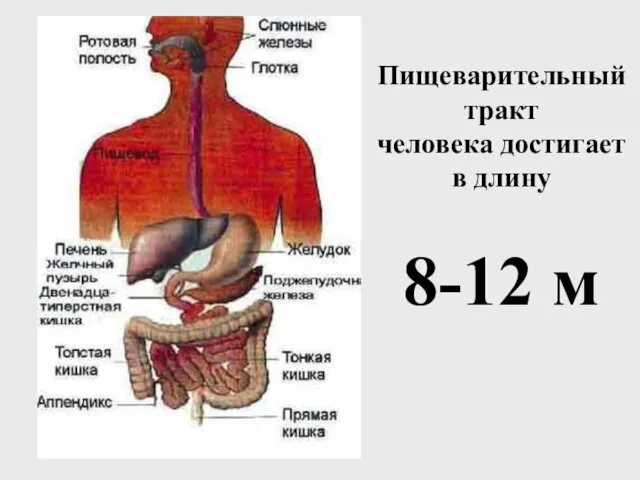 Пищеварительный тракт человека. Функции пищеварительной системы
Пищеварительный тракт человека. Функции пищеварительной системы Нахождение значений дробных выражений. 6 класс
Нахождение значений дробных выражений. 6 класс Муниципальное бюджетное учреждение Спортивная школа Триумф
Муниципальное бюджетное учреждение Спортивная школа Триумф Великая Отечественная война. Блокада Ленинграда
Великая Отечественная война. Блокада Ленинграда Презентация_Инженеры_ПТО
Презентация_Инженеры_ПТО Урок географии в 7 классе коррекционной школы VIII вида на тему Животный мир тундры
Урок географии в 7 классе коррекционной школы VIII вида на тему Животный мир тундры Психические процессы и учебная деятельность младших школьников
Психические процессы и учебная деятельность младших школьников Системы собственных нужд электростанций и подстанций. (Лекция 1)
Системы собственных нужд электростанций и подстанций. (Лекция 1)