Содержание
- 2. Общая характеристика Фтор и его соединения Бром и иод Хлор Хлороводород и соляная кислота Оксиды и
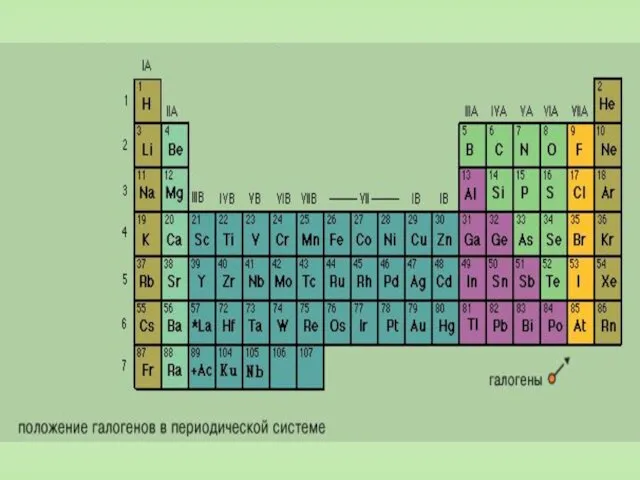
- 3. В группу галогенов входят фтор, хлор, бром, иод и астат. Эти элементы составляют главную подгруппу VII
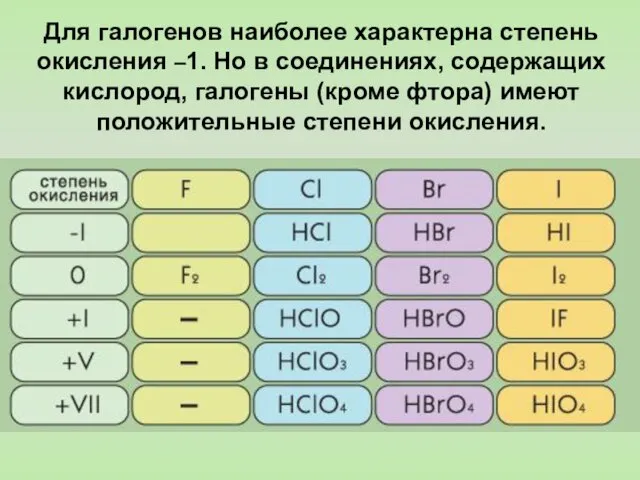
- 5. Для галогенов наиболее характерна степень окисления –1. Но в соединениях, содержащих кислород, галогены (кроме фтора) имеют
- 6. Распространение в природе и важнейшие соединения галогенов
- 8. Галогены образуют двухатомные непрочные молекулы. Легкость распада молекул галогенов на атомы – одна из причин их
- 9. Фтор (газ) Хлор (газ) Бром (жидкость) Иод (кристаллы) Агрегатное состояние и цвет галогенов
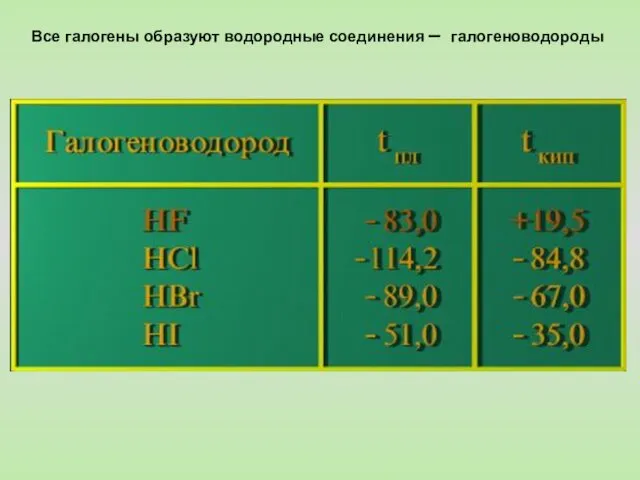
- 10. Все галогены образуют водородные соединения – галогеноводороды
- 11. С увеличением порядкового номера окислительная способность галогенов в свободном состоянии падает. Поэтому каждый предыдущий галоген вытесняет
- 12. Фтор Фтор – самый сильный окислитель из всех известных элементов. Химически очень активен. Энергия связи в
- 14. С водородом фтор реагирует со взрывом, который происходит даже при сильном охлаждении газов и в темноте.
- 15. Древесный уголь, сера, кремний, фосфор, бром, иод при соприкосновении с фтором воспламеняются. Фтор окисляет и некоторые
- 17. HF
- 20. Бром Иод Бром – летучая красно-бурая жидкость, иод – чёрное кристаллическое вещество с металлическим блеском.
- 21. С химической точки зрения бром и иод обладают сходными свойствами с остальными галогенами, хотя и менее
- 22. При взаимодействии с металлами и неметаллами бром и иод образуют соответственно бромиды и иодиды.
- 24. Хлор
- 25. История открытия хлора
- 26. Физические свойства Хлор – газ жёлто-зелёного цвета, со специфическим запахом. Ядовит. При –34°С легко сжижается, при
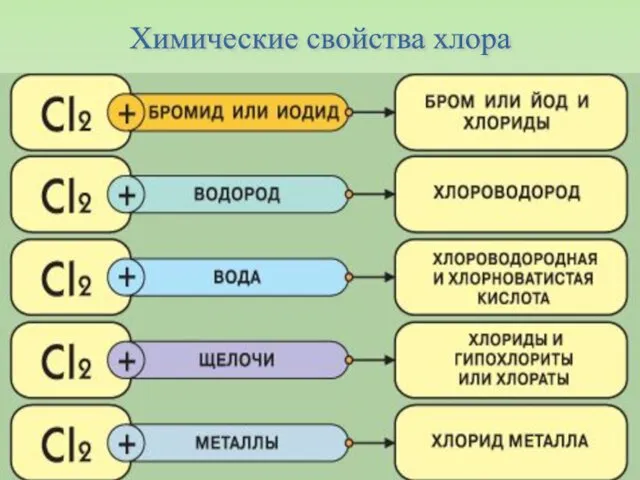
- 27. Химические свойства хлора
- 28. Химическая активность хлора
- 29. Хлор один из самых активных неметаллов, несколько менее активный, чем фтор. Хлор легко присоединяет электрон и
- 30. При взаимодействии хлора с водородом образуется хлороводород: H2 + Cl2 = 2HCl При обычных условиях реакция
- 31. Взаимодействие хлора с водой: Раствор хлора в воде (хлорная вода) содержит две кислоты – соляную HCl
- 32. Со щелочами: Хлор взаимодействует с раствором NaOH, образуя соль хлорноватистой кислоты (гипохлорит) и хлорид натрия: Cl2
- 33. Окислительные свойства хлора:
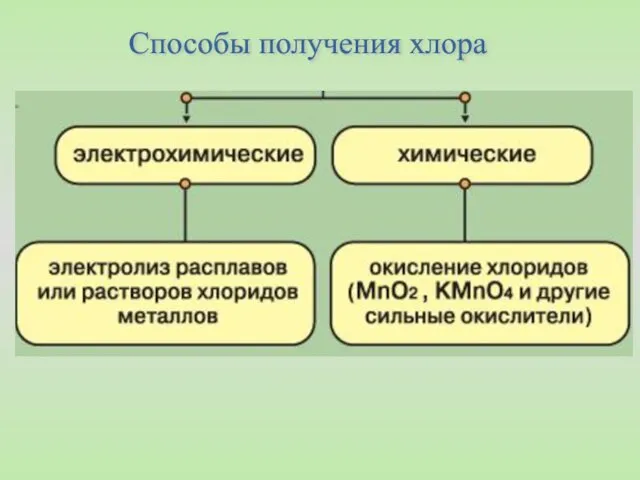
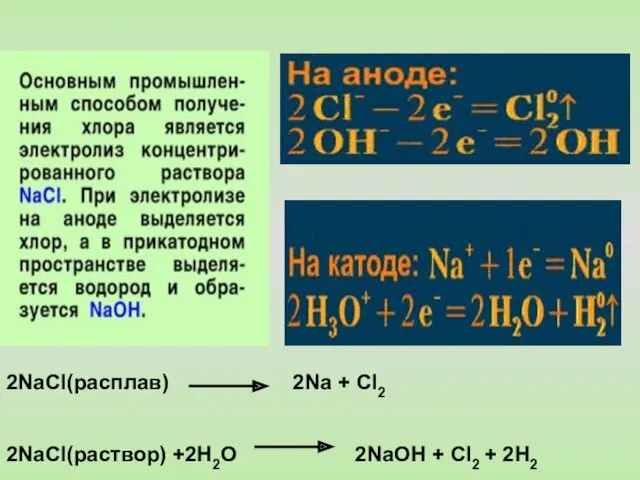
- 35. Способы получения хлора
- 37. 2NaCl(расплав) 2Na + Cl2 2NaCl(раствор) +2Н2О 2NaОН + Cl2 + 2Н2
- 38. Применение хлора
- 39. Хлороводород Соляная кислота
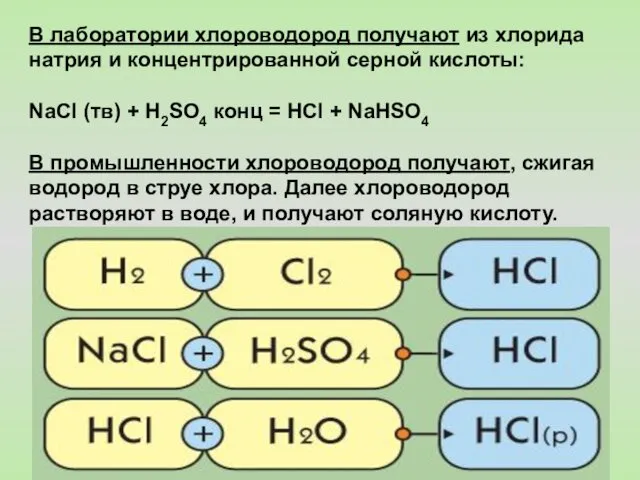
- 40. Хлороводород HCl – бесцветный удушливый ядовитый газ, тяжелее воздуха, хорошо растворим в воде с образованием соляной
- 42. В лаборатории хлороводород получают из хлорида натрия и концентрированной серной кислоты: NaCl (тв) + H2SO4 конц
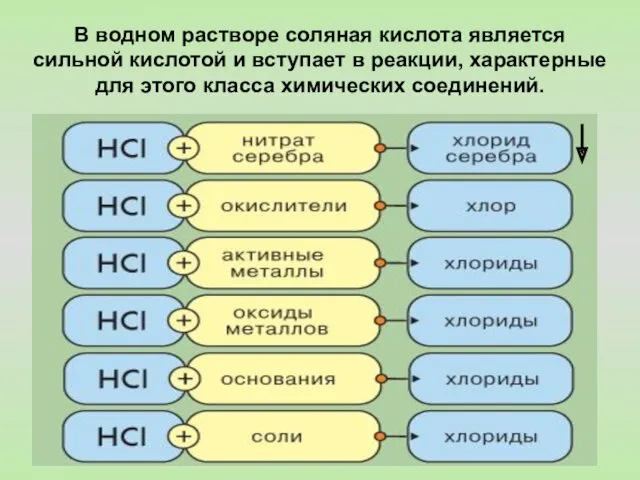
- 43. В водном растворе соляная кислота является сильной кислотой и вступает в реакции, характерные для этого класса
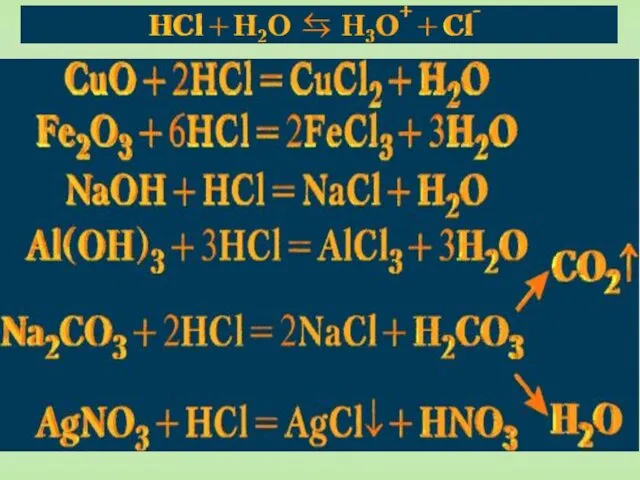
- 44. Соляная кислота – сильная, одноосновная, взаимодействует с металлами, стоящими в ряду напряжений до водорода, например: Zn
- 48. Оксиды и оксокислоты хлора
- 49. Известны следующие оксиды хлора: Cl2O, Cl2O3, Cl2O5 и Cl2O7. Все они неустойчивы, могут быть получены только
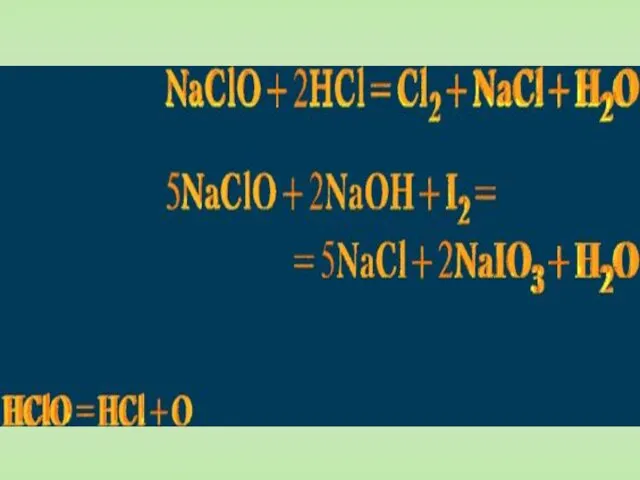
- 50. Хлорноватистая HClO гипохлориты Хлористая HClO2 хлориты Хлорноватая HClO3 хлораты Хлорная HClO4 перхлораты
- 58. Скачать презентацию












































 Теория ноосферы В. И. Вернадского и её развитие в XXI веке
Теория ноосферы В. И. Вернадского и её развитие в XXI веке Учитель года-2012
Учитель года-2012 Презентация Зимние виды спорта
Презентация Зимние виды спорта Національна культура в сучасній Україні
Національна культура в сучасній Україні Командная спортивная игра волейбол
Командная спортивная игра волейбол Устройство и эксплуатация средств связи. Радиостанции малой мощности
Устройство и эксплуатация средств связи. Радиостанции малой мощности Товарная информация как средство управления безопасностью продуктов детского питания
Товарная информация как средство управления безопасностью продуктов детского питания Иоганн Себастьян Бах (1685-1750)
Иоганн Себастьян Бах (1685-1750) Особенности устройства рельсовой колеи на кривом участке двухпутной линии
Особенности устройства рельсовой колеи на кривом участке двухпутной линии Строки. Специальные символы (JavaScript)
Строки. Специальные символы (JavaScript) Южная Америка: образ материка
Южная Америка: образ материка Куда девается мусор
Куда девается мусор Классный час на тему Права, обязанности и ответственность ребенка 5-7 классы Классный час на тему Права, обязанности и ответственность ребенка
Классный час на тему Права, обязанности и ответственность ребенка 5-7 классы Классный час на тему Права, обязанности и ответственность ребенка Презентация учебного занятия на тему:Вышивка лентами по программе Вологодское кружево
Презентация учебного занятия на тему:Вышивка лентами по программе Вологодское кружево растим патриотов
растим патриотов Театральна студія Мізансцена
Театральна студія Мізансцена презентация методы рефлексии
презентация методы рефлексии Муниципальное бюджетное учреждение Спортивная школа №2 г. Ижевск
Муниципальное бюджетное учреждение Спортивная школа №2 г. Ижевск Правописание гласных после шипящих и Ц
Правописание гласных после шипящих и Ц Энергетический менеджмент
Энергетический менеджмент Презентация П.И.Чайковский
Презентация П.И.Чайковский Как создать свой мультфильм
Как создать свой мультфильм 19 секретов для родителей второклассников
19 секретов для родителей второклассников 8 марта (открытки)
8 марта (открытки) Кодирование информации, 8 класс
Кодирование информации, 8 класс Fotometria2022
Fotometria2022 Mouline
Mouline Школа критики Полярного дня. Есенин vs Слава КПСС
Школа критики Полярного дня. Есенин vs Слава КПСС