Содержание
- 2. Цели урока Рассмотреть положение неметаллов в ПСХЭ и особенности строения их атомов, вспомнить ряд электроотрицательности. Повторить
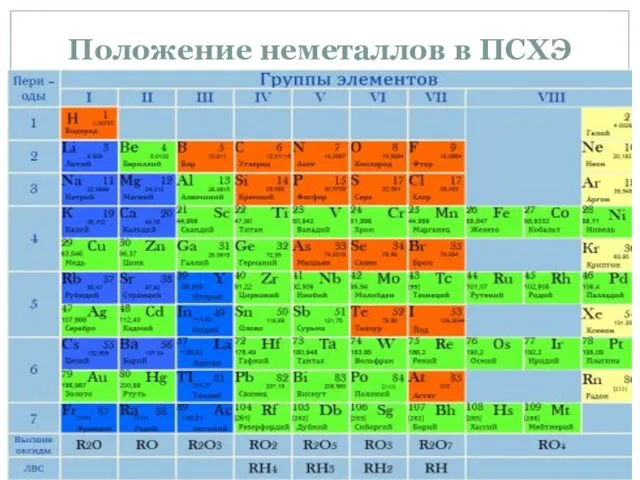
- 3. Положение неметаллов в ПСХЭ
- 4. Неметаллы в сравнении с металлами Атомы неметаллов имеют более маленький радиус. На внешнем слое атомов находится
- 5. Неметаллы – простые вещества Неметаллы имеют различное агрегатное состояние при обычных условиях: Газы – Н₂, O₂,
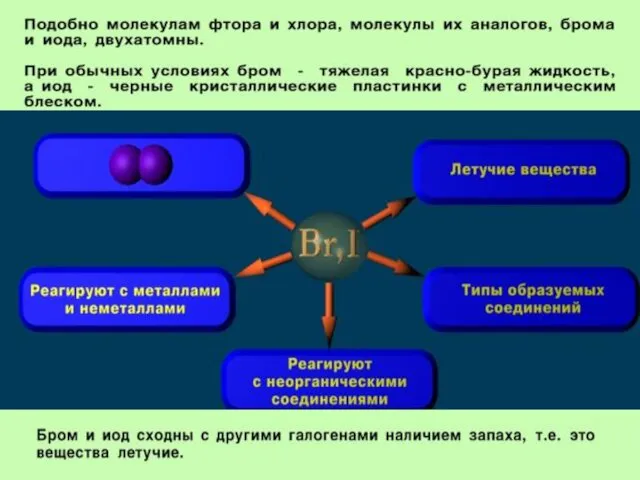
- 6. Br2
- 7. Неметаллы – простые вещества Неметаллы имеют различную окраску: Сера – желтая, Фосфор – белый (желтый), красный,
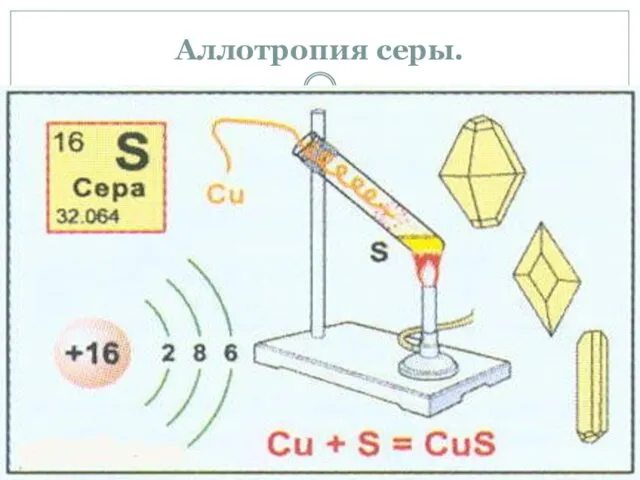
- 8. Аллотропия серы.
- 9. Аллотропия серы: кристаллическая, пластическая и моноклинная
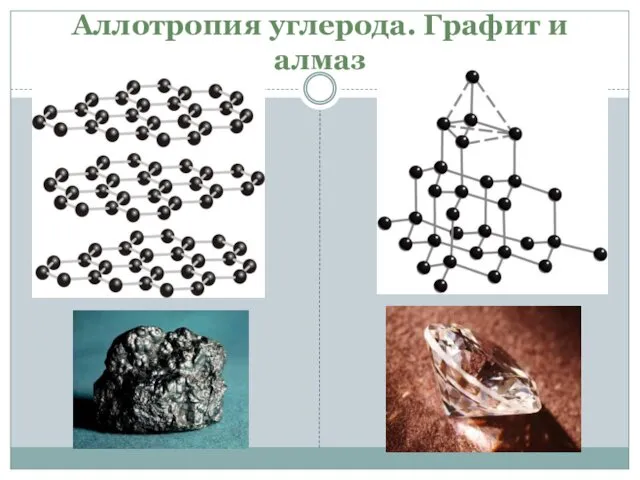
- 10. Аллотропия углерода. Графит и алмаз
- 11. Аллотропия кислорода Кислород О2 в нормальных условиях – газ без цвета и запаха, аллотропная модификация –
- 12. Аллотропия фосфора Красный фосфор по своим свойствам сильно отличается от белого фосфора. Не ядовит, не растворяется
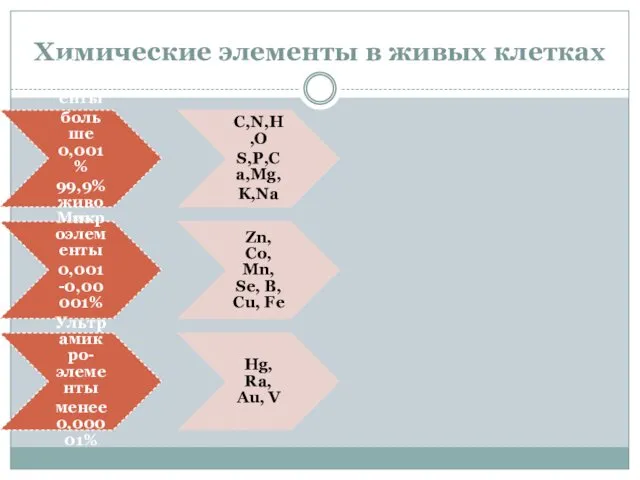
- 13. Химические элементы в живых клетках Макроэлементы больше 0,001 % 99,9% живого субстрата C,N,H,O S,P,Ca,Mg, K,Na Микроэлементы
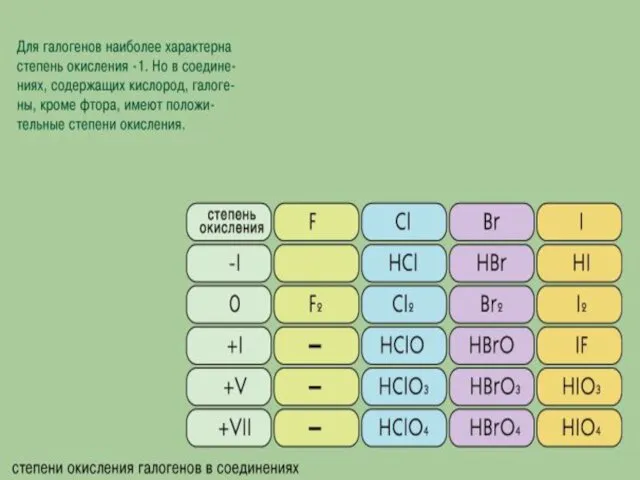
- 14. Галогены В группу галогенов входят фтор, хлор, бром, йод и астат. Эти элементы составляют главную подгруппу
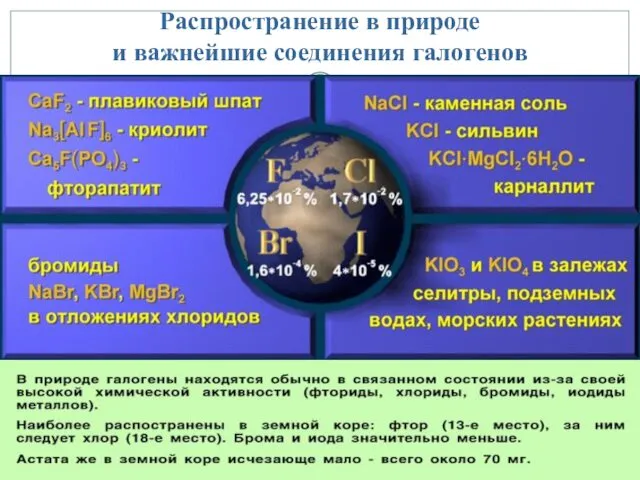
- 16. Распространение в природе и важнейшие соединения галогенов
- 18. Агрегатное состояние и цвет галогенов Фтор (газ) Хлор (газ) Бром (жидкость) Йод (кристаллы)
- 19. Фтор
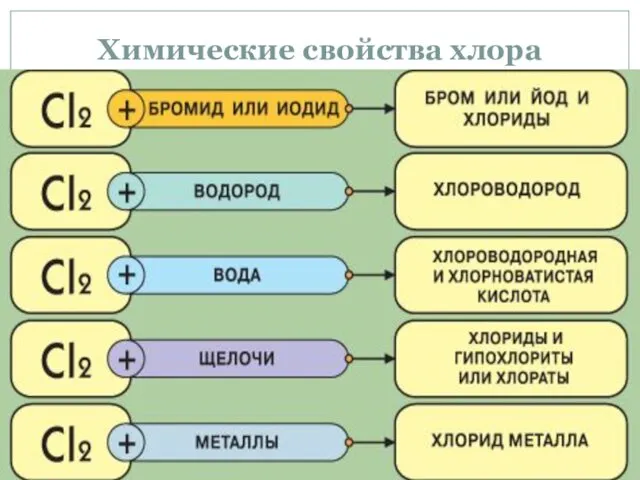
- 25. Химические свойства хлора
- 26. Взаимодействие со щелочами: Хлор взаимодействует с раствором NaOH, образуя соль хлорноватистой кислоты (гипохлорит) и хлорид натрия:
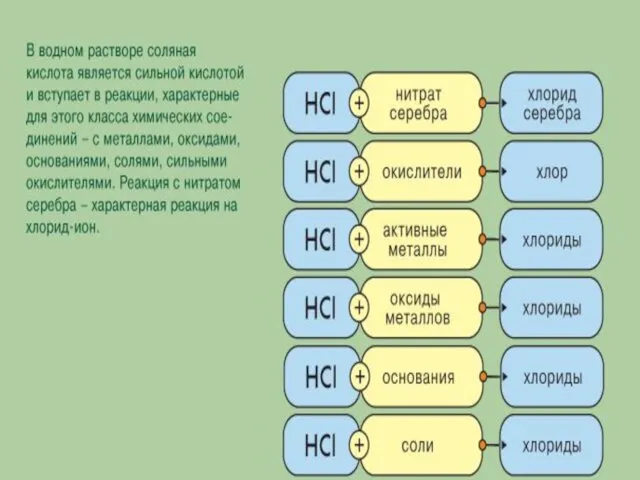
- 29. Соединения хлора Хлороводород HCl - бесцветный удушливый ядовитый газ, тяжелее воздуха, хорошо растворим в воде с
- 31. Свойства соляной кислоты Соляная кислота – сильная, одноосновная, взаимодействует с металлами, стоящими в ряду напряжений до
- 33. Скачать презентацию












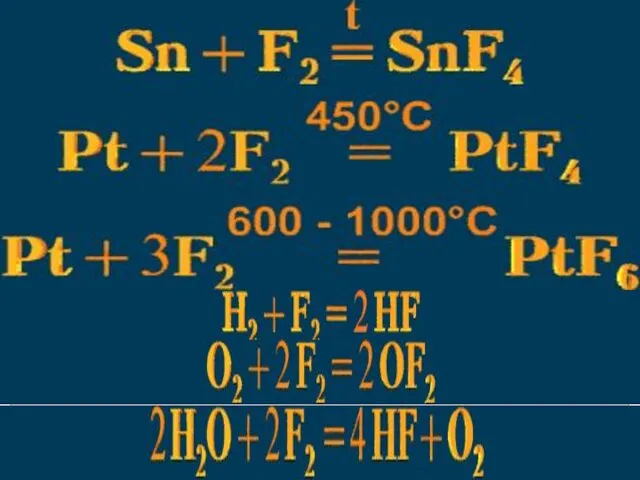








 Реклама Франции конца ХІХ века. Плакат
Реклама Франции конца ХІХ века. Плакат Бытовые электронагревательные приборы
Бытовые электронагревательные приборы Защита электрических сетей с малыми токами замыкания на землю
Защита электрических сетей с малыми токами замыкания на землю Свет Зеркального в глазах моих друзей
Свет Зеркального в глазах моих друзей Оборудование предприятий торговли. Режущие машины периодического действия
Оборудование предприятий торговли. Режущие машины периодического действия Из истории храма Покрова Пресвятой Богородицы
Из истории храма Покрова Пресвятой Богородицы Инфузии и трансфузии
Инфузии и трансфузии Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза
Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза Podstawy rachunkowości
Podstawy rachunkowości Перегруженность сетей Ethernet и Token Ring
Перегруженность сетей Ethernet и Token Ring Проект Моя родословная
Проект Моя родословная Инновационные технологии на уроках математики
Инновационные технологии на уроках математики Технологический колледж. Монтажник радиоэлектронной аппаратуры и приборов
Технологический колледж. Монтажник радиоэлектронной аппаратуры и приборов Внеурочное занятие по курсу Уроки нравственности по теме Золотое правило нравственности
Внеурочное занятие по курсу Уроки нравственности по теме Золотое правило нравственности Искусство фотопейзажа и фотоинтерьера
Искусство фотопейзажа и фотоинтерьера Управление бизнес-проектами
Управление бизнес-проектами Создание семейного клуба
Создание семейного клуба Использование данных мониторинга для прогнозирования показателей разработки и оценки эффективности технологических мероприятий
Использование данных мониторинга для прогнозирования показателей разработки и оценки эффективности технологических мероприятий Диктатический материал, используемый на занятиях по автоматизации слогослияния.
Диктатический материал, используемый на занятиях по автоматизации слогослияния. ШКАЛА ТВЕРДОСТИ
ШКАЛА ТВЕРДОСТИ Героини сказок
Героини сказок 2-х спальная кровать
2-х спальная кровать Канский технологический колледж
Канский технологический колледж Работа на электронной контрольно-кассовой машине ЭКР-2102 РПУ
Работа на электронной контрольно-кассовой машине ЭКР-2102 РПУ 4 ноября День народного единства
4 ноября День народного единства Программа развития для ДОУ
Программа развития для ДОУ 0 (12 files merged)
0 (12 files merged) Основные понятия из теории надежности и задачи технической диагностики
Основные понятия из теории надежности и задачи технической диагностики