Содержание
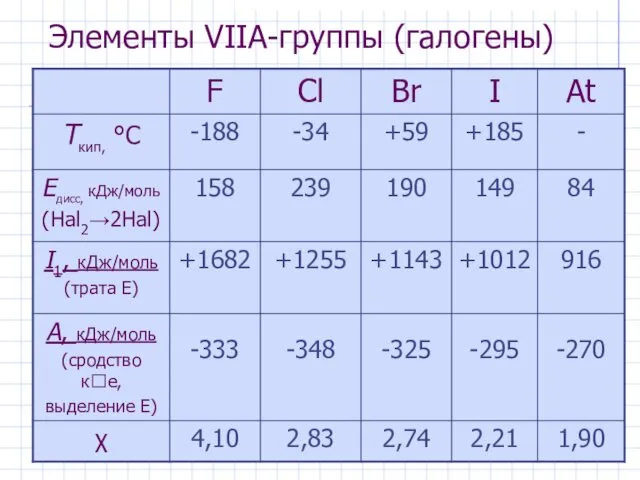
- 2. Элементы VIIА-группы (галогены)
- 3. Простые вещества: F2, Cl2, Br2, I2, At2 Иод Бром Фтор Хлор
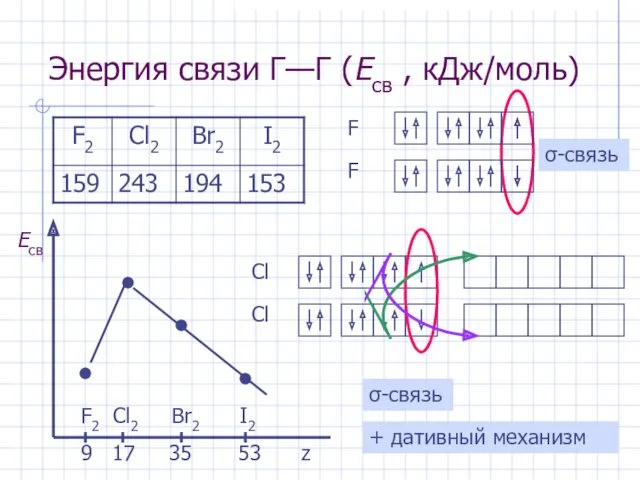
- 4. Энергия связи Г—Г (Eсв , кДж/моль) F2 Cl2 Br2 I2 9 17 35 53 z σ-связь
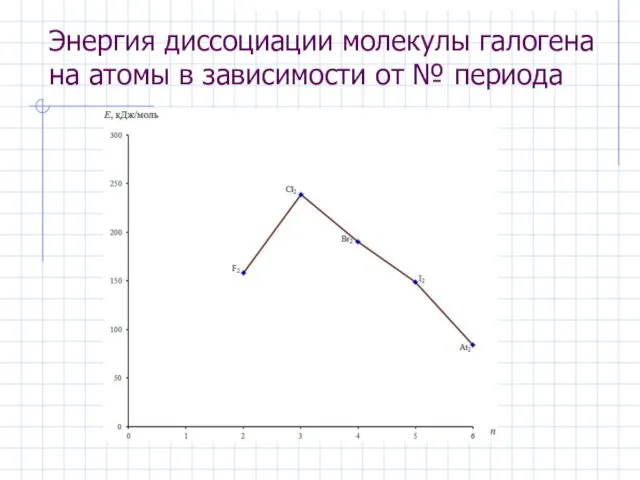
- 5. Энергия диссоциации молекулы галогена на атомы в зависимости от № периода
- 6. Кристаллы флюорита
- 7. Фтор F2 т.пл. –220 °С, т.кип. –183 °С Э + F2 → Э+νFν–I (ν - высокая,
- 8. Соединения фтора. Фтороводород Фтороводород HF : (HF)n т.кип. +19,5 °С, неограниченно растворим в воде Автопротолиз: H2F2
- 9. Фтороводород SiO2 + 4HF газ = SiF4↑ + 2H2O (травление стекла) SiO2 + 6HF изб. =
- 10. Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз HF+KF (≈KHF2)
- 11. Получение фтора и фтороводорода В промышленности: электролиз расплава KHF2 (т. пл. 239 °C) или KH2F3 (т.
- 12. Фтороводородная (плавиковая) кислота [H3O]+F- [H3O]+[HF2]- [H3O]+[H3F4]- Специфическая ионизация р-ров HF и специфический гидролиз водных р-ров фторидов:
- 13. Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т.п. HF: получение синтетического
- 15. Скачать презентацию







![Фтороводородная (плавиковая) кислота [H3O]+F- [H3O]+[HF2]- [H3O]+[H3F4]- Специфическая ионизация р-ров HF](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/57339/slide-11.jpg)

 Гражданское право. Договор поставки
Гражданское право. Договор поставки Текстовые процессоры и текстовые редакторы
Текстовые процессоры и текстовые редакторы Презентация Африка
Презентация Африка Әлемдік діндер мәдениеті: буддизм, християндық исламдық
Әлемдік діндер мәдениеті: буддизм, християндық исламдық Системы счисления. Основные понятия систем счисления
Системы счисления. Основные понятия систем счисления Царство Грибы. Общая характеристика грибов
Царство Грибы. Общая характеристика грибов Коронавирус COVID-19
Коронавирус COVID-19 Представление технологии Диск
Представление технологии Диск Патофизиология красной крови
Патофизиология красной крови Из опыта работы по формированию у дошкольников представлений о правилах дорожного движения (презентация)
Из опыта работы по формированию у дошкольников представлений о правилах дорожного движения (презентация) Что такое доброта?
Что такое доброта? Автоматизация звука Ш. Артикуляционная гимнастика
Автоматизация звука Ш. Артикуляционная гимнастика Программа оценки навыков речи и социального взаимодействия для детей с аутизмом и другими нарушениями VB-MAPP
Программа оценки навыков речи и социального взаимодействия для детей с аутизмом и другими нарушениями VB-MAPP Влияние сотовых телефонов на здоровье человека
Влияние сотовых телефонов на здоровье человека Уинстон Леонард Спенсер Черчилль
Уинстон Леонард Спенсер Черчилль Безопасное поведение детей в сети
Безопасное поведение детей в сети Логический квадрат. Ложные, истинные и неопределенные суждения
Логический квадрат. Ложные, истинные и неопределенные суждения 2615Імунофлуорисцентний експрес аналізатор LS-1100
2615Імунофлуорисцентний експрес аналізатор LS-1100 Явление паразитизма
Явление паразитизма Музыкальная композиция
Музыкальная композиция Проектирование водопроводной насосной станции II подъема
Проектирование водопроводной насосной станции II подъема Доколе я в мире, я свет миру
Доколе я в мире, я свет миру Алгоритм ветвления. Условный оператор
Алгоритм ветвления. Условный оператор Электронное портфолио по предмету Окружающий мир
Электронное портфолио по предмету Окружающий мир презентация проекта по ПДД Нам на улице не страшно
презентация проекта по ПДД Нам на улице не страшно Школьный спортивный клуб Спасатель
Школьный спортивный клуб Спасатель My favorite paintings
My favorite paintings Родительское собрание Подготовка ребёнка ко 2 классу
Родительское собрание Подготовка ребёнка ко 2 классу