Содержание
- 2. Поверхностное натяжение. Живые организмы представляют собой системы с очень развитыми поверхностями раздела, к которым относят кожные
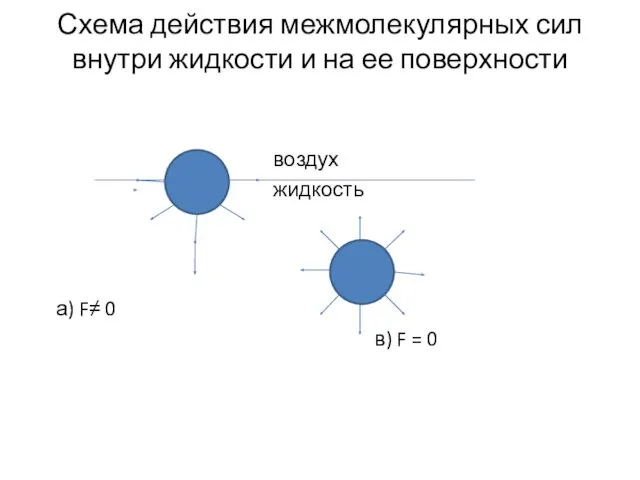
- 3. Схема действия межмолекулярных сил внутри жидкости и на ее поверхности воздух жидкость а) F≠ 0 в)
- 4. На молекулу, находящуюся в жидкости, со всех сторон равномерно действуют межмолекулярные силы. На поверхности жидкости этот
- 5. Поверхностное натяжение (σ) – это минимальная сила, сдерживающая движение частиц жидкости в глубину и тем самым
- 6. Поверхностное натяжение у различных жидкостей колеблется в значительных пределах и зависит от природы жидкости, ее температуры,
- 7. Зависимость поверхностного натяжения от Природы жидкости: Чем сильнее межмолекулярные связи в данной жидкости, тем больше поверхностное
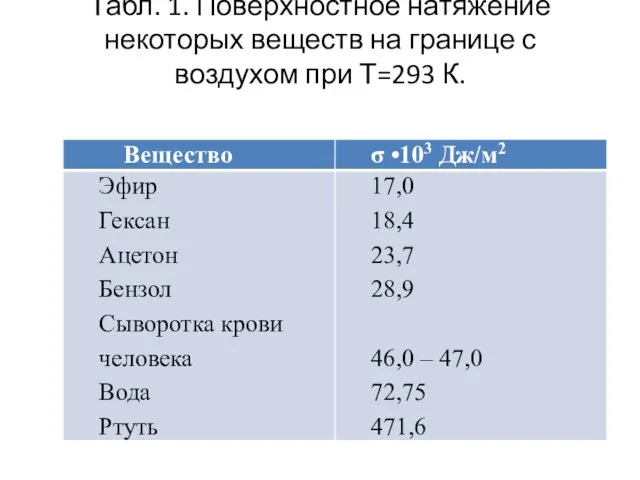
- 8. Табл. 1. Поверхностное натяжение некоторых веществ на границе с воздухом при Т=293 К.
- 9. Поверхностная активность Способность растворенных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью.
- 10. При растворении в данной жидкости, какого либо вещества наблюдают следующие случаи: 1). Растворенное вещество понижает поверхностное
- 11. Поверхностно-активные вещества (ПАВ) Типичные ПАВ- это органические вещества, обладающие поверхностным натяжением меньшим, чем вода, и имеющие
- 12. ПИВ У ПИВ поверхностное натяжение больше, чем у воды. Примерами ПИВ по отношению к воде являются
- 13. Поверхностно-неактивные вещества 3). Растворенное вещество не меняет поверхностное натяжение (ПНВ), т. к. эти вещества имеют близкое
- 14. Дифильные молекулы Молекулы, в которых имеются гидрофильная и гидрофобная группировки, называют дифильными. К ним относятся спирты,
- 15. Поверхностное натяжение биологических жидкостей используют в диагностических целях. Так поверхностное натяжение крови подвержено значительным колебаниям при
- 16. Адсорбция Разнообразные явления, возникающие на границах раздела фаз, происходят вследствие особого энергетического состояния пограничных поверхностей, которые
- 17. Адсорбция Адсорбция – это самопроизвольное повышение концентрации вещества у поверхности раздела двух фаз в гетерогенной системе,
- 18. Физическая адсорбция Силы, вызывающие физическую адсорбцию – силы межмолекулярного взаимодействия (Ван-дер-Ваальса). Процесс физической адсорбции легко можно
- 19. Хемосорбция Хемосорбцией называется сорбция, при которой поглощаемое вещество и сорбент между собой взаимодействуют с образованием нового
- 20. Адсорбция В зависимости от агрегатного состояния соприкасающихся фаз различают: адсорбцию газов на твердой поверхности; адсорбцию растворенных
- 21. Адсорбция на границе раствор-газ ПАВы и ПИВы вызывают перераспределение вещества между поверхностным слоем и объемом раствора.
- 22. Гиббсовская адсорбция Избыток или недостаток растворенного вещества в поверхностном слое, отнесенный к единице поверхности, обозначают -
- 23. Если производная ∆σ/∆С отрицательна (т.е. с увеличением концентрации вещества поверхностное натяжение уменьшается), то адсорбция Г >0
- 24. Если производная ∆σ/∆С - положительна, то адсорбция Г Это значит , что вещество уходит с поверхностного
- 25. Правило Дюкло-Траубе Способность различных ПАВ адсорбироваться в поверхностном слое и понижать поверхностное натяжение растворов, т.е. их
- 26. Правило Дюкло-Траубе: Поверхностная активность ПАВ на границе раздела водный раствор – газ увеличивается в среднем в
- 27. Теория Ленгмюра - адсорбция газа твердым адсорбентом Ленгмюр вывел простейшее уравнение адсорбции газа гладкой твердой поверхностью
- 28. Изотерма адсорбции Ленгмюра: где Г – адсорбция, Г∞ - количество вещества, адсорбированное единицей поверхности при полном
- 29. Уравнение Фрейндлиха -зависимости адсорбции от давления (концентрации) газа при постоянной температуре : x/m= К· Р 1/n,
- 30. Таким образом, уравнение изотермы Фрейндлиха применимо в области средних концентраций, а уравнение Ленгмюра - при низких
- 31. Значение адсорбции Явления адсорбции играют большую роль также и в жизнедеятельности животных организмов. Известно, что пища
- 33. Скачать презентацию




























 Київський міський центр зайнятості. Майстер-клас з пошуку роботи “Крок за кроком”
Київський міський центр зайнятості. Майстер-клас з пошуку роботи “Крок за кроком” Темперамент
Темперамент 20231026_mediaproekt_biografiya_ivana_susanina
20231026_mediaproekt_biografiya_ivana_susanina Республика Удмуртия
Республика Удмуртия Восславим женщину, чьё имя мать
Восславим женщину, чьё имя мать Классный час О тех, кто нас всегда любит и ждет 2 класс
Классный час О тех, кто нас всегда любит и ждет 2 класс Types of questions
Types of questions Новая система KPI's партнеров Tele 2
Новая система KPI's партнеров Tele 2 Шестерённые насосы
Шестерённые насосы От чего зависит сила трения?
От чего зависит сила трения? Достижения КГАСУ в области изучения эпоксидных смол
Достижения КГАСУ в области изучения эпоксидных смол Королевство Саудовская Аравия
Королевство Саудовская Аравия Скрининговые тесты в диагностике состояния системы гемостаза
Скрининговые тесты в диагностике состояния системы гемостаза Жердің ғаламшар ретіндегі жалпы сипаттамасы
Жердің ғаламшар ретіндегі жалпы сипаттамасы Детская игровая комната
Детская игровая комната Сушилки для сушки сыпучих материалов. Барабанные сушилки и их применение в производстве тугоплавких силикатных материалов
Сушилки для сушки сыпучих материалов. Барабанные сушилки и их применение в производстве тугоплавких силикатных материалов Задачи огневой подготовки
Задачи огневой подготовки Электролиттік диссоциация
Электролиттік диссоциация Организация проектной деятельности. Структура проекта
Организация проектной деятельности. Структура проекта Векторы. Тест. (Вариант 1)
Векторы. Тест. (Вариант 1) Моніторинг процесу децентралізації влади та реформування місцевого самоврядування
Моніторинг процесу децентралізації влади та реформування місцевого самоврядування Создание Дорожки здоровья на улице Набережная в городе Озёрске Челябинской области в рамках реализации проекта
Создание Дорожки здоровья на улице Набережная в городе Озёрске Челябинской области в рамках реализации проекта Начало освоения Новороссии и Крыма
Начало освоения Новороссии и Крыма Академия роботов
Академия роботов Розробка системи рекуперації електричної енергії для електроавтомобілів
Розробка системи рекуперації електричної енергії для електроавтомобілів Даму барысындағы ақаулар.Түсініктемесі. Бас, мойын, кеуде қуысының,іш, аяқ-қолдары даму барысындағы ақаулар
Даму барысындағы ақаулар.Түсініктемесі. Бас, мойын, кеуде қуысының,іш, аяқ-қолдары даму барысындағы ақаулар Тауелсіз елім Қазақстан
Тауелсіз елім Қазақстан Интерактивная игра по обучению грамоте Найди правильный слог (на звук Л)
Интерактивная игра по обучению грамоте Найди правильный слог (на звук Л)