Содержание
- 2. Оқу мақсаты 9.3.4.4 заттарды электролиттерге және бейэлектролиттерге, күшті және әлсіз электролиттерге жіктеу; 9.3.4.5 диссоциация үдерісіндегі судың
- 3. Бағалау критерийлері қосылыс суда еріген кезде ион туғызатынын түсінеді; иондық нысанда 4-5 қосылысты дұрыс құрады.
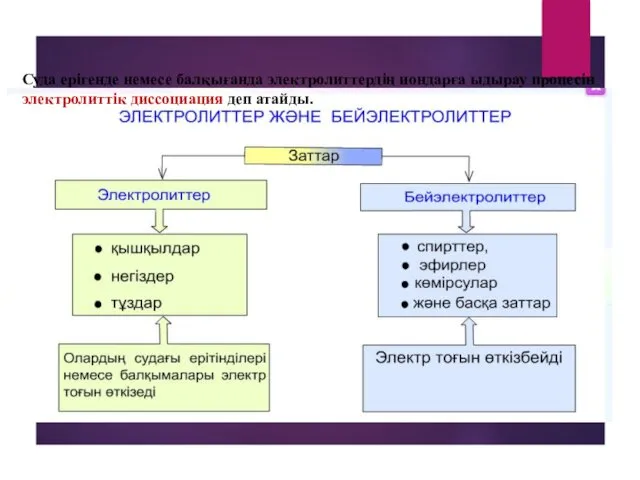
- 4. Суда ерігенде немесе балқығанда электролиттердің иондарға ыдырау процесін электролиттік диссоциация деп атайды.
- 5. Диссоциациялану дәрежесі Диссоциациялану дәрежесі дегеніміз - диссоциацияланған молекулалар санының ерітінрдідегі жалпы молекулалар санына қатынасы.Ол процентпен көрсетіледі.
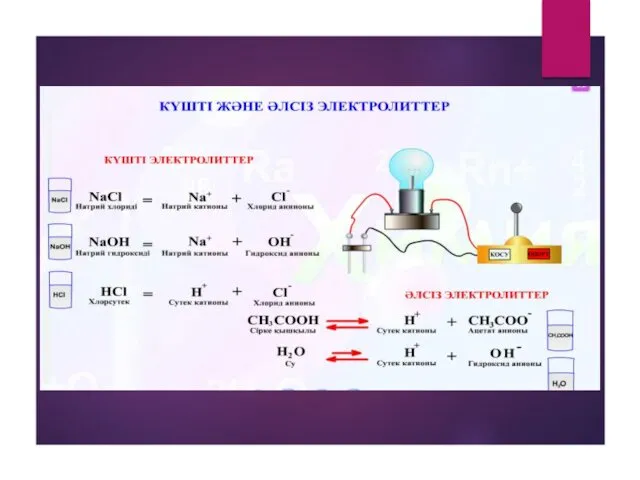
- 6. 1.Күшті электролиттер,олардың диссоциациялану дәрежелері 30%-тен жоғары болады. Мысалы: HNO3 91%, NaCI 84%,HCI 92%,KOH және NaOH 84%
- 9. Электролиттер суда ерігенде, неліктен диссоциацияланады?
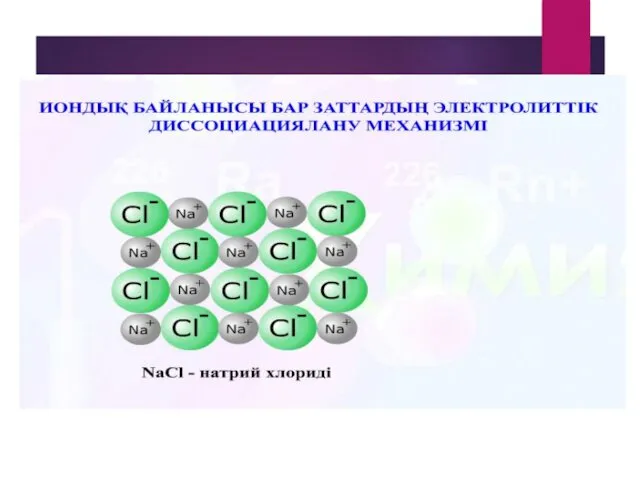
- 10. Заттардың диссоциация механизмі Химиялық элементтердің электролиттік диссоциациясы
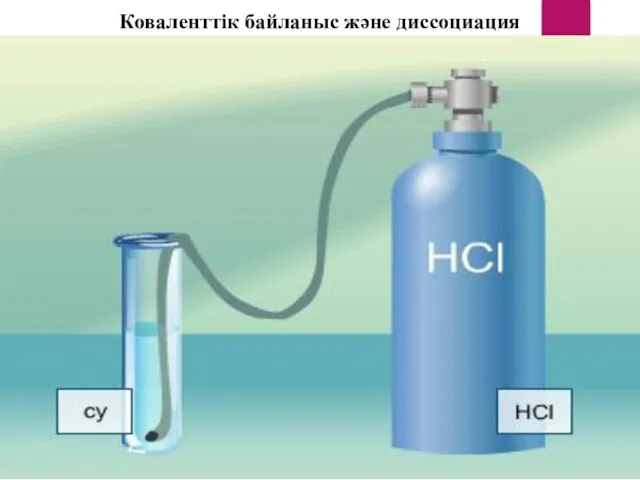
- 13. Коваленттік байланыс және диссоциация
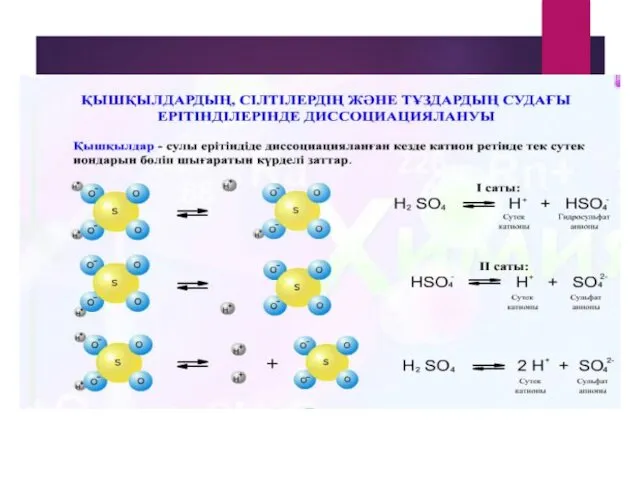
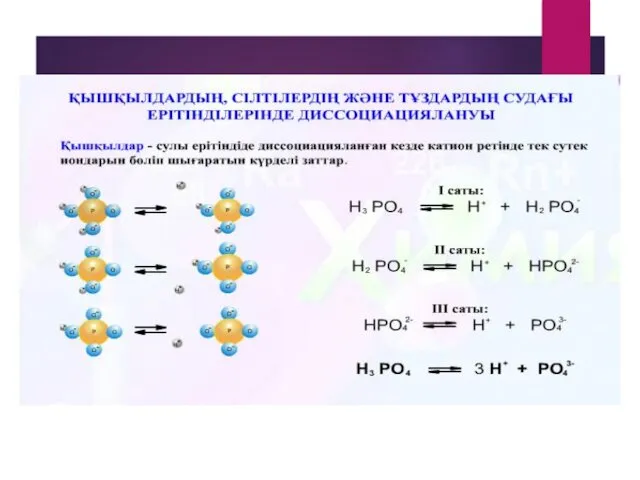
- 14. Химиялық элементтердің электролиттік диссоциациясы Қышқылдар қышқыл қалдықтарымен сутек иондарына диссоциацияланады. HCI = Н+ + CI- -2
- 17. Химиялық элементтердің электролиттік диссоциациясы Тұздар қышқыл қалдықтарымен металл иондарына диссоциацияланады. + - NaCI = Na +
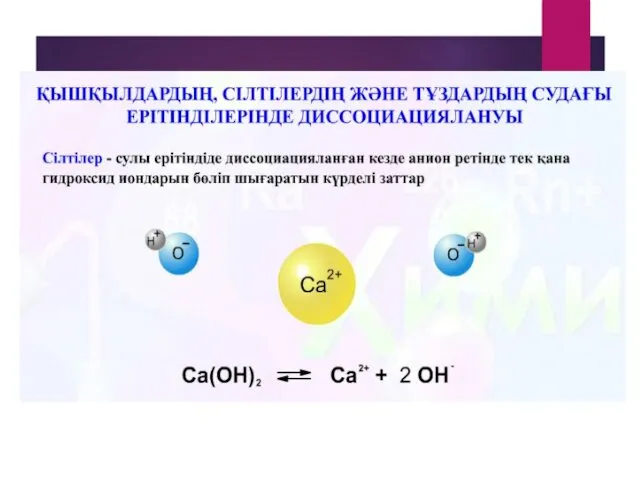
- 18. Химиялық элементтердің электролиттік диссоциациясы Негіздер гидроксид иондарымен металл иондарына диссоциацияланады + - Na OH = Na
- 20. Шағын тақтада кезекпен 5 химиялық қосылыстың формулалары бойынша сулы ерітіндіде түзетін иондарды жазу: Оқу мақсаты: иондық
- 21. Иондық реакция аяғына дейін жүру үшін реакция нәтижесінде: Тұнба түзілуі Газ бөлінуі нашар диссоцияланатын зат түзілу
- 22. КEYWORDS
- 24. Тұнба түзіле жүретін реакциялар. Кальций хлоридінің CaCl2 ертіндісіне күміс нитратының AgNO3 ертіндісін құямыз. CaCl2 + 2
- 25. Көмір қышқылының тұзы натрий карбонатының Na2CO3 ерітіндісіне күкірт қышқылының ертіндісін құямыз.Иондар алмасу нәтижесінде жаңа тұз натрий
- 26. Су және басқа аз диссоциацияланатын заттар түзіле жүретін реакциялар. Натрий гидроксидінің ертіндісіне хлорсутек қышқылының ертіндісіне құямыз.Бұл
- 31. Скачать презентацию





















 Повторение: квадратные уравнения. Решение упражнений с использованием сведений о космонавтике. 9 класс
Повторение: квадратные уравнения. Решение упражнений с использованием сведений о космонавтике. 9 класс Простейшие задачи в координатах
Простейшие задачи в координатах Подготовка к бою. Эпизод 7
Подготовка к бою. Эпизод 7 Библиотечно-библиографическая классификация
Библиотечно-библиографическая классификация Презентация по теме Оптинские старцы (православная культура)
Презентация по теме Оптинские старцы (православная культура) Функции и классификации складов. Оборудование складов
Функции и классификации складов. Оборудование складов Узбекская национальная кухня
Узбекская национальная кухня Семейное право
Семейное право X19-11-10A SDJ-85/200 双螺杆双阶机组
X19-11-10A SDJ-85/200 双螺杆双阶机组 Даешь ИКТ в ДОУ
Даешь ИКТ в ДОУ American celebrations
American celebrations Проектная работа на тему Экспериментальная деятельность детей старшего дошкольного возраста презентация
Проектная работа на тему Экспериментальная деятельность детей старшего дошкольного возраста презентация Однофазная цепь с последовательным соединением электроприемников (лекция 3)
Однофазная цепь с последовательным соединением электроприемников (лекция 3) Проект День Светлой Пасхи
Проект День Светлой Пасхи Самолёт-амфибия Бе-200
Самолёт-амфибия Бе-200 КВИЗ-игра Как велика моя Россия (1)
КВИЗ-игра Как велика моя Россия (1) lektsia2
lektsia2 Значение ТЭС ПП для эффективного использования топлива и других энергоресурсов
Значение ТЭС ПП для эффективного использования топлива и других энергоресурсов Понятие об информационных системах и автоматизации информационных процессов. Возможности настольных издательских систем
Понятие об информационных системах и автоматизации информационных процессов. Возможности настольных издательских систем Теория игр. Введение в матричные игры
Теория игр. Введение в матричные игры Правоохранительные органы Российской Федерации
Правоохранительные органы Российской Федерации Приставки на З и С
Приставки на З и С Обучение. Транспортная компания
Обучение. Транспортная компания Советско–Финляндская война 1939 – 1940 годов
Советско–Финляндская война 1939 – 1940 годов Технологическое и комплектующее оборудование технических средств службы горючего. (Тема 4.1)
Технологическое и комплектующее оборудование технических средств службы горючего. (Тема 4.1) Енисей жазба ескерткіштері
Енисей жазба ескерткіштері Нахождение металлов в природе
Нахождение металлов в природе Вредные привычки и их негативные влияния на здоровье
Вредные привычки и их негативные влияния на здоровье