Содержание
- 2. Джерела амінокислот 1. Білки корму (екзогенні амінокислоти). 2. Білки тканин при розпаді в процесі їх оновлення
- 3. Шляхи використання амінокислот в організмі Біосинтез білків, специфічних для даного організму. Синтез біологічно активних речовин (ферментів,
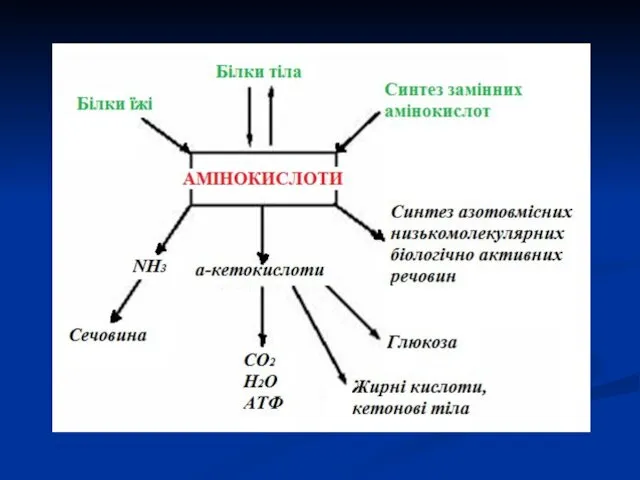
- 5. КАТАБОЛІЗМ АМІНОКИСЛОТ Амінокислоти, які утворилися в результаті перетравлення білків і потрапили в клітини тканин, підлягають катаболізму
- 6. Дезамінування Найбільш розповсюдженим видом перетворення амінокислот є їх дезамінування з утворенням кетокислот і амоніаку. Амоніак є
- 7. 1. Відновлювальне дезамінування
- 8. 2. Гідролітичне дезамінування Ці два шляхи дезамінування характерні для більшості бактерій, особливо тих, які містяться в
- 9. 3. Внутрішньомолекулярне дезамінування Цей вид дезамінування є характерним для деяких рослин і бактерій, а в тваринному
- 10. В печінці уроканінова кислота перетворюється в імідазолонпропіонову кислоту при дії уроканінази. Подальші перетворення в ході серії
- 11. 4. Окисне дезамінування Окисне дезамінування – переважний тип дезамінування амінокислот в організмі ссавців та більшості аеробних
- 12. Процес окисного дезамінування відбувається в два етапи.
- 13. В тканинах достатньо активною є дегідрогеназа, яка специфічно дезамінує α-глутамінову кислоту, перетворюючи її в α-кетоглутарову кислоту
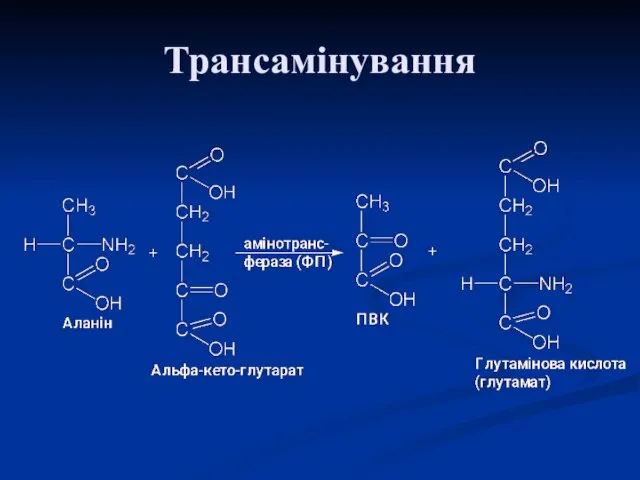
- 14. Трансамінування – непрямий шлях дезамінування Трансамінування ‒ реакція перенесення α-аміногрупи з амінокислоти на α-кетокислоту, в результаті
- 15. Найчастіше за все в реакціях трансамінування приймають участь амінокислоти, вміст яких у тканинах значно вище за
- 16. Вступати в реакції трансамінування можуть майже всі амінокислоти, за винятком лізину, треоніну та проліну.
- 17. Для амінотрансфераз характерною є субстратна специфічність до різних амінокислот. В тканинах людини виявлено більше 10 різних
- 18. Аланінамінотрансфераза АЛТ (АлАТ) каталізує реакцію трансамінування між аланіном і α-кетоглутаратом. Локалізований цей фермент у цитозолі клітин
- 19. ACT (АсАТ) каталізує реакцію трансамінування між аспартатом та α-кетоглутаратом аналогічно попередній. В результаті утворюються оксалоацетат і
- 20. Біологічне значення трансамінування Реакції трансамінування відіграють велику роль в обміні амінокислот. Оскільки цей процес є зворотним,
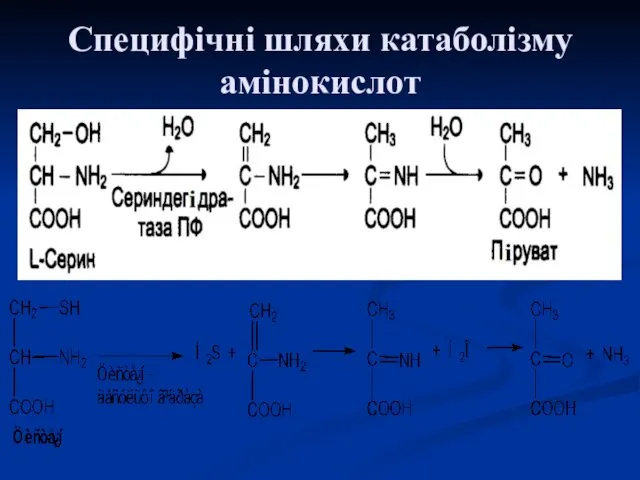
- 21. Специфічні шляхи катаболізму амінокислот
- 22. Синтез креатиніну Креатин є необхідним для утворення в м'язах високоенергетичної сполуки – креатинфосфату. Синтез креатину проходить
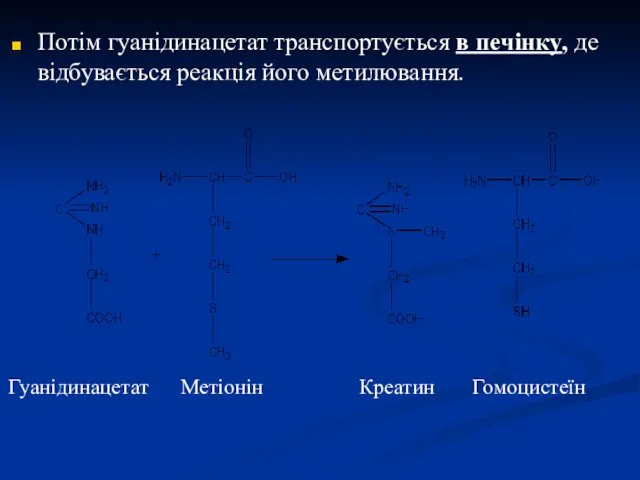
- 23. Потім гуанідинацетат транспортується в печінку, де відбувається реакція його метилювання. Гуанідинацетат Метіонін Креатин Гомоцистеїн
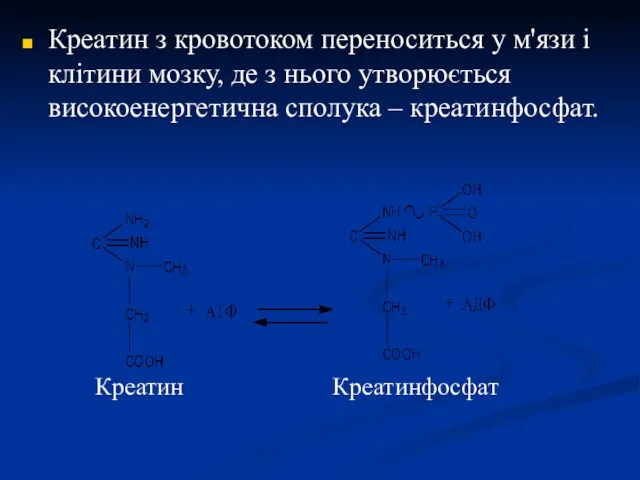
- 24. Креатин з кровотоком переноситься у м'язи і клітини мозку, де з нього утворюється високоенергетична сполука –
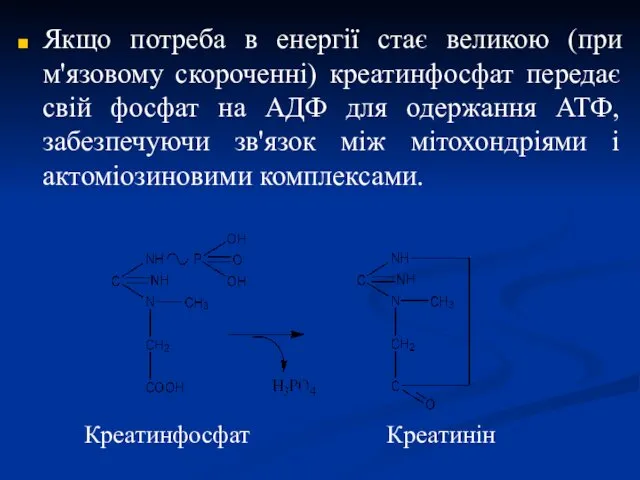
- 25. Якщо потреба в енергії стає великою (при м'язовому скороченні) креатинфосфат передає свій фосфат на АДФ для
- 26. Креатинфосфат відіграє важливу роль у забезпеченні енергією м'язу, що працює, в початковий період. В результаті неферментативного
- 27. Визначення вмісту креатину і креатиніну в крові та сечі використовується для характеристики інтенсивності роботи м'язів у
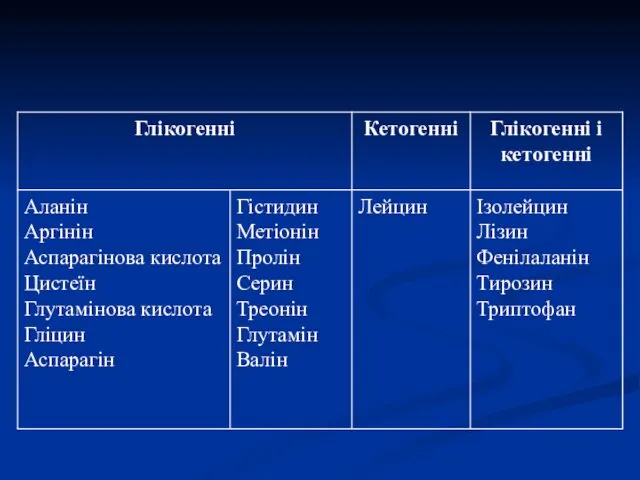
- 28. Глікогенні і кетогенні амінокислоти Амінокислоти, які в процесі катаболізму перетворюються в піруват, оксалоацетат (ЩОК) і фосфоєнолпіруват,
- 30. ДЕКАРБОКСИЛУВАННЯ АМІНОКИСЛОТ Процес відщеплення карбоксильної групи амінокислот у вигляді СО2 одержав назву декарбоксилування. Продукти реакції, що
- 31. Декарбоксилування амінокислот відбувається під впливом декарбоксилаз, коферментом яких є переважно фосфопіридоксаль (вітамін В6). Декарбоксилуванню підлягають лише
- 32. При декарбоксилуванні гістидину утворюється гістамін, який має сильну фармакологічну дію на кровоносні судини та кров'яний тиск
- 33. Біологічна роль гістаміну Багато синтезується в місці запалення: має судинорозширюючу дію, прискорює приплив лейкоцитів і активує
- 34. В результаті декарбоксилування глутамінової кислоти утворюється γ‑аміномасляна кислота, метаболіт, який синтезується в нервовій тканині, необхідний для
- 35. В організмі аміни окиснюються моноамінооксигеназами до альдегідів і виводяться нирками. В результаті декарбоксилування амінокислот виділяється третій
- 36. Токсичність амоніаку Амоніак легко проникає через мембрани в клітини і в мітохондріях змінює напрям реакції, яка
- 37. Підвищення концентрації амоніаку в крові змінює рН у лужну сторону (виникає алкалоз). Це, в свою чергу,
- 38. Шляхи знезараження амоніаку Тимчасове знезараження (у всіх тканинах): - утворення амонійних солей; - утворення амідів дикарбонових
- 39. Синтез амонійних солей органічних кислот відбувається тільки в нирках і займає незначне місце у всьому процесі
- 40. Знезараження амоніаку в місці його утворення (печінка, нирки, мозок, м'язи та ін.) відбувається, головним чином, за
- 41. Амоніак у складі аспарагіну і глутаміну надходить до печінки, де використовується для синтезу сечовини.
- 42. Глутамін — основний донор Нітрогену в організмі. Високий рівень глутаміну в крові та легкість його надходження
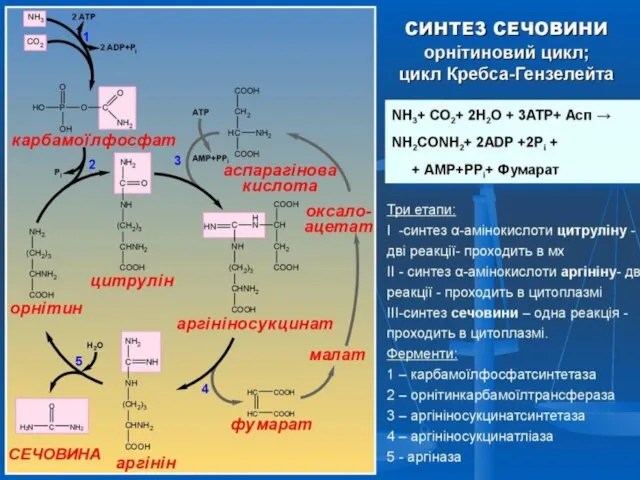
- 43. Орнітиновий цикл Сечовина − основний кінцевий продукт азотистого обміну, в складі якого з організму виділяється до
- 44. Перша стадія синтезу сечовини заключається в утворенні карбамоїлфосфату за участі АТФ і N-ацетилглутамінової кислоти, яка є
- 45. Карбамоїлфосфат за участі ферменту орнітинкарбамоїл-трансферази перетворюється в амінокислоту цитрулін:
- 46. В присутності ферменту аргінінсукцинатсинтетази і АТФ цитрулін вступає в реакцію конденсації з аспарагіновою кислотою, в результаті
- 47. Аргінінянтарна кислота при дії ферменту аргінінсукцинат-ліази розщеплюється на аргінін і фумарову кислоту:
- 48. Аргінін при дії аргінази перетворюється в орнітин і сечовину. Орнітин може включатися в новий цикл знезараження
- 49. Фумарова кислота при цьому перетворюється в яблучну і щавлевооцтову, а остання в результаті трансамінування або відновлювального
- 50. У жуйних частина її виділяється із сечею, а інша частина через слинні залози в складі слини
- 51. При утворенні сечовини використовується А) амоніак – одна молекула Б) СО2 – одна молекула В) аміногрупа
- 53. Анаболічна фаза обміну білків Синтез замінних амінокислот. Синтез специфічних білків. Синтез азотвмісних речовин: - біогенні аміни;
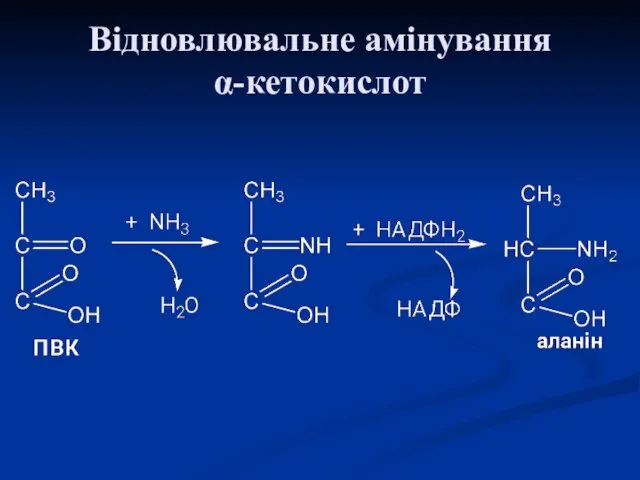
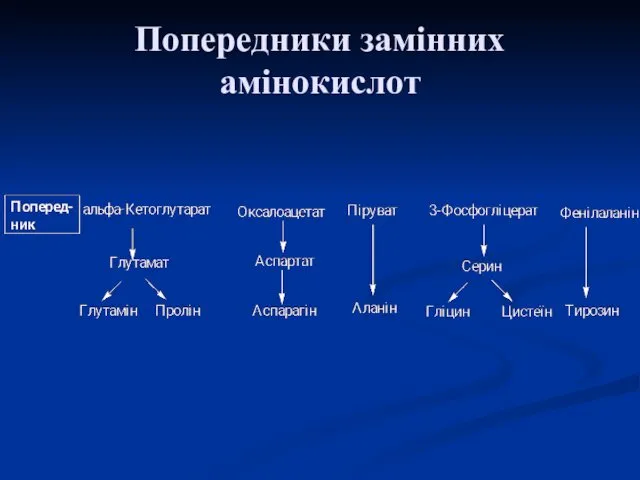
- 54. Синтез замінних амінокислот Вуглецевий скелет замінних амінокислот утворюється з проміжних метаболітів гліколізу, пентозофосфатного шляху, циклу трикарбонових
- 55. Відновлювальне амінування α-кетокислот
- 56. Трансамінування
- 57. Попередники замінних амінокислот
- 59. Скачать презентацию














































 Князь Василий Ярославович Костромской
Князь Василий Ярославович Костромской Музейная педагогика в ДОУ (презентация)
Музейная педагогика в ДОУ (презентация) Профилактика суицида среди детей и подростков
Профилактика суицида среди детей и подростков Маленький пешеход
Маленький пешеход Итоговый тест по окружающему миру. 1 класс
Итоговый тест по окружающему миру. 1 класс Налоговая система России
Налоговая система России Основи технологічного проектування виробництв
Основи технологічного проектування виробництв Ильин день. Народные традиции
Ильин день. Народные традиции Аргумент от бытия
Аргумент от бытия Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период
Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период Комплексное исследование вод реки Уень в окрестностях села Батурино
Комплексное исследование вод реки Уень в окрестностях села Батурино Разработка Урока Знаний Мир - главное слово на свете!
Разработка Урока Знаний Мир - главное слово на свете! Угадай страну
Угадай страну Христианская апологетика и логика
Христианская апологетика и логика Одаренные дети: психологические аспекты развития
Одаренные дети: психологические аспекты развития Цитирование в научной сфере. Основные правила оформления цитат
Цитирование в научной сфере. Основные правила оформления цитат Конкурс Супер-Золушка 21 века
Конкурс Супер-Золушка 21 века Презентация Берингово море
Презентация Берингово море Практический вебинар. Как продвигать партнерские эзотерические продукты
Практический вебинар. Как продвигать партнерские эзотерические продукты Идеология американского общества
Идеология американского общества Достопримечательности стран мира
Достопримечательности стран мира Ресторан Волгоград
Ресторан Волгоград Международные портфельные инвестиции
Международные портфельные инвестиции Основы проектирования строительных конструкций
Основы проектирования строительных конструкций Территориальный маркетинг в системе регионального управления
Территориальный маркетинг в системе регионального управления Привітання для мами
Привітання для мами Полупроводниковые диоды
Полупроводниковые диоды Высокая классика
Высокая классика