Содержание
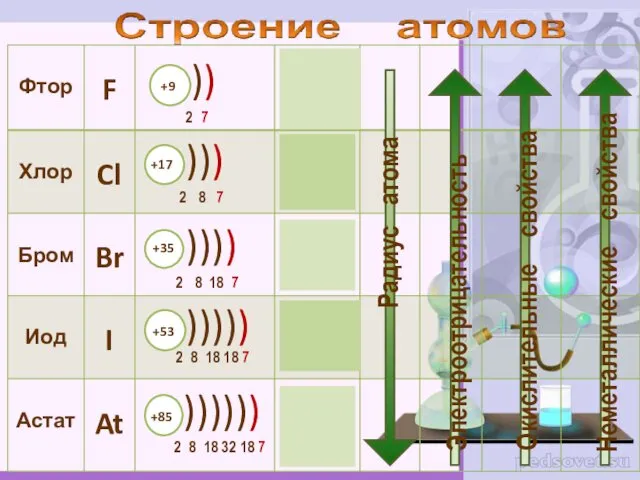
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
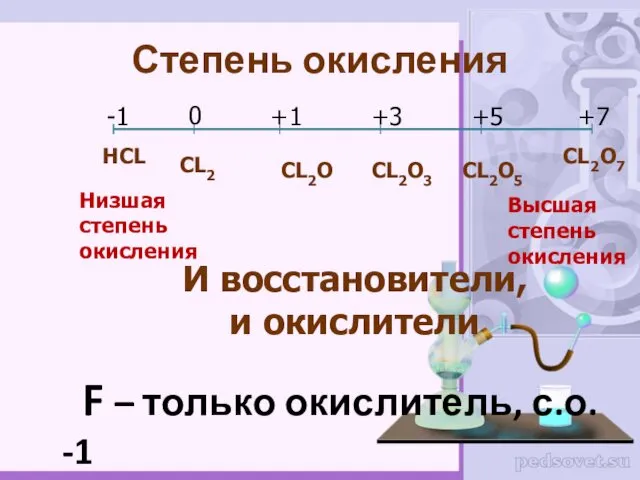
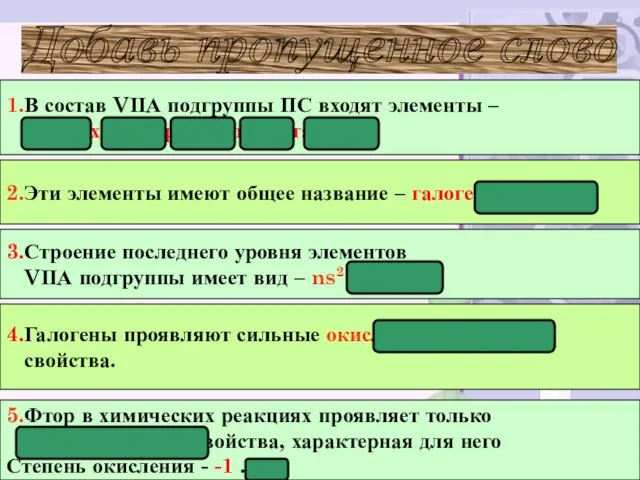
- 4. Степень окисления НCL CL2O7 F – только окислитель, с.о. -1 -1 0 +1 +3 +5 +7
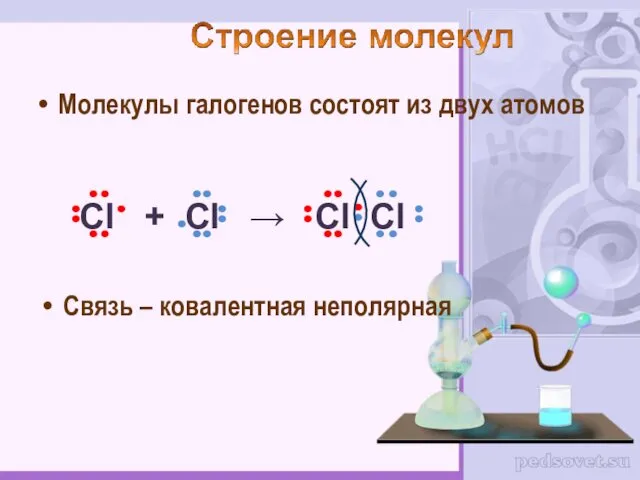
- 5. Молекулы галогенов состоят из двух атомов Связь – ковалентная неполярная
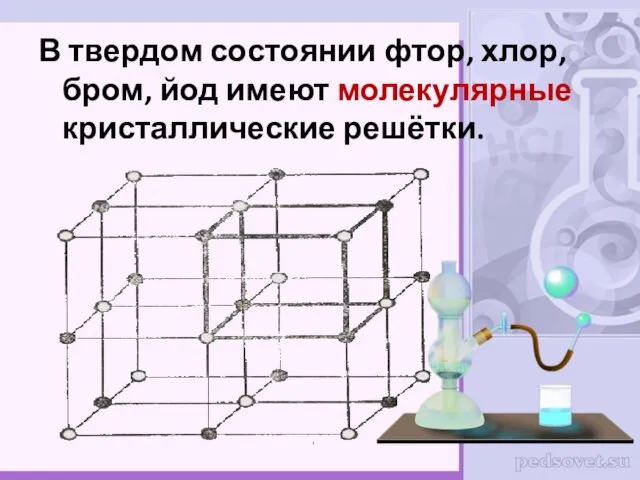
- 6. В твердом состоянии фтор, хлор, бром, йод имеют молекулярные кристаллические решётки.
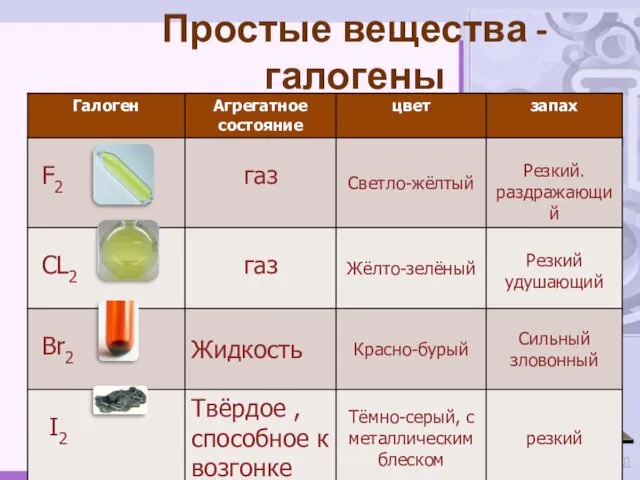
- 7. Простые вещества - галогены
- 8. Температуры кипения и плавления с увеличением атомной массы галогенов увеличиваются. Галогены как простые вещества.
- 9. Все галогены – токсичные вещества! Галогены как простые вещества. Жидкий хлор вызывает серьезные ожоги кожи. Газообразный
- 10. ФТОР Повышает устойчивость зубов к кариесу, Стимулирует кроветворение, Репаративные процессы при переломах костей, Реакции иммунитета, Участвует
- 11. Потребность во фторе взрослого человека - 2-3 мг/сут. Накапливается в костной ткани и зубах. !!!При недостатке
- 12. ХЛОР Убивает болезнетворные бактерии
- 13. Хлор всегда добавляют в бассейны!
- 14. Жидкий хлор вызывает серьезные ожоги кожи. Газообразный хлор оказывает сильное раздражающее действие, особенно на глаза и
- 15. Советуем: прежде, чем пить воду из-под крана, обязательно пропустите её через фильтры, а по возможности Прокипятите!
- 16. БРОМ NaBr и KBr – одни из лучших средств против бессонницы и усталости!!! LiBr - предотвращает
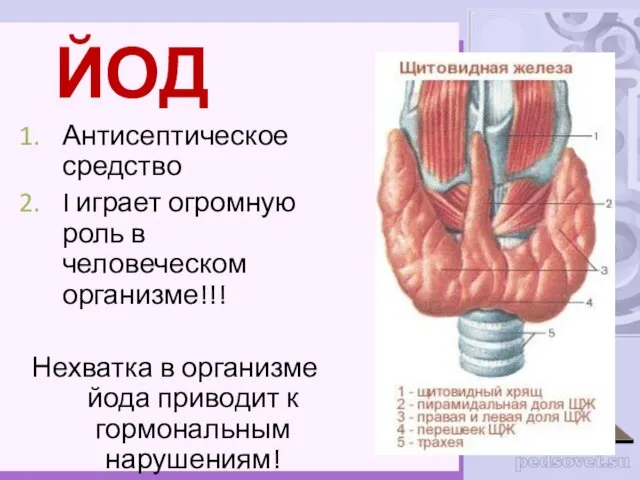
- 17. ЙОД Антисептическое средство I играет огромную роль в человеческом организме!!! Нехватка в организме йода приводит к
- 18. Советуем: каждый день употреблять Препараты, восстанавливающие Содержание йода в организме!!!
- 20. АСТАТ Очень радиоактивен!!! Необходим человеческому организму в небольших количествах (щитовидная железа)
- 22. Распространенность в природе галит NaCl сильвин KCl сильвинит KCl•NaCl флюорит CaF2
- 23. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
- 24. H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 +
- 25. 3. Взаимодействие с водой 2F2 + 2H2O = 4HF + O2 с образованием смеси кислот 4.
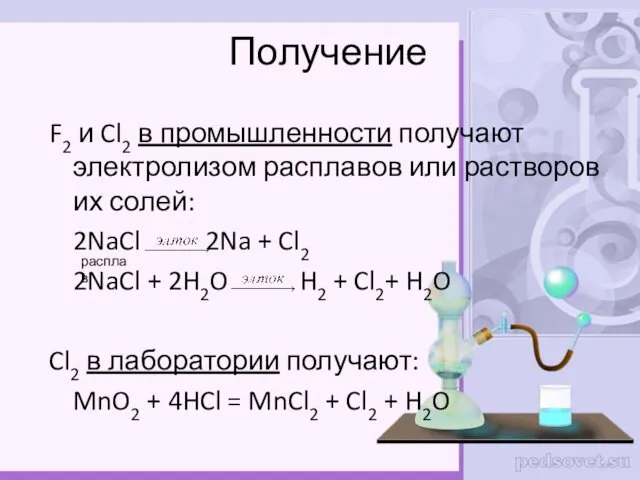
- 26. Получение F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: 2NaCl 2Na +
- 27. Добавь пропущенное слово 1.В состав VΙΙА подгруппы ПС входят элементы – фтор, хлор, бром, йод, астат.
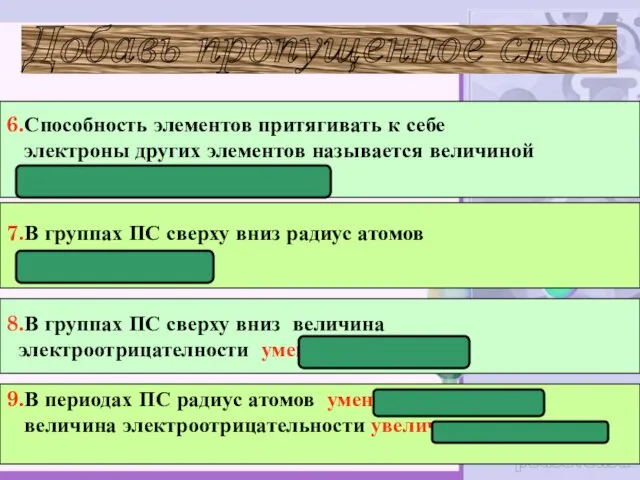
- 28. 6.Способность элементов притягивать к себе электроны других элементов называется величиной электроотрицательности. 8.В группах ПС сверху вниз
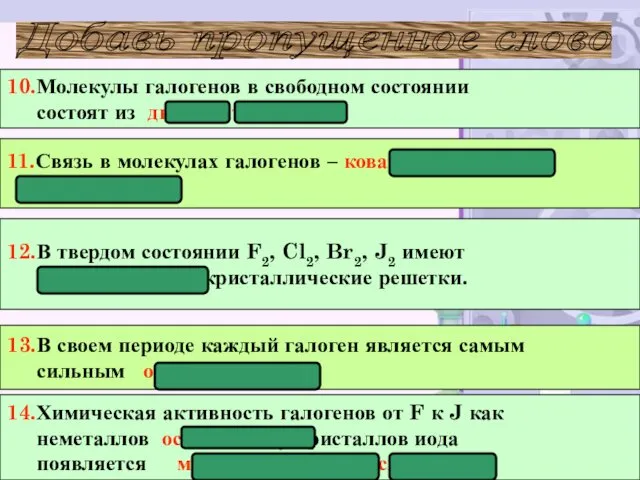
- 29. 12.В твердом состоянии F2, Cl2, Br2, J2 имеют молекулярные кристаллические решетки. 10.Молекулы галогенов в свободном состоянии
- 30. В периодической системе галогены находятся в: А) главной подгруппе VIII группы; Б) побочной подгруппе VII группы;
- 31. Для галогенов характерна степень окисления: А) -2; Б) -1 и -2; В) -2 и -3; Г)
- 32. Галогены могут проявлять положительную степень окисления в соединениях с: А) водородом; Б) кислородом; В) с металлами;
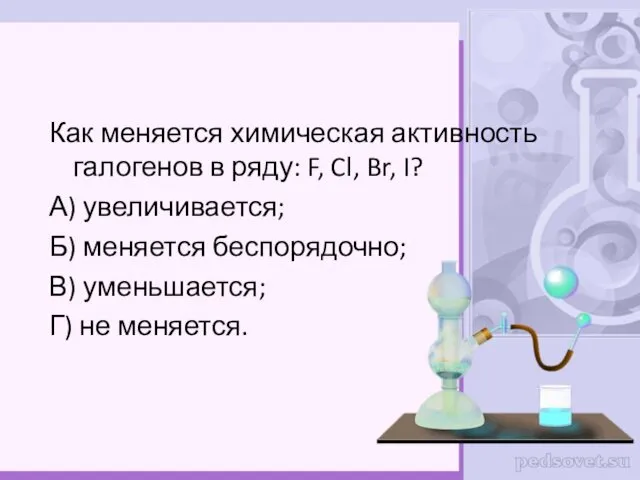
- 33. Как меняется химическая активность галогенов в ряду: F, Cl, Br, I? А) увеличивается; Б) меняется беспорядочно;
- 34. При обычных условиях бром - это: А) газ; Б) жидкость; В) кристаллическое в-во; Г) жидкость или
- 35. Свободных орбиталей нет у: А) хлора; Б) брома; В) йода; Г) фтора.
- 36. Галогены в твердом состоянии имеют: А) атомную кристаллическую решетку; Б) молекулярную кристаллическую решетку; В) А и
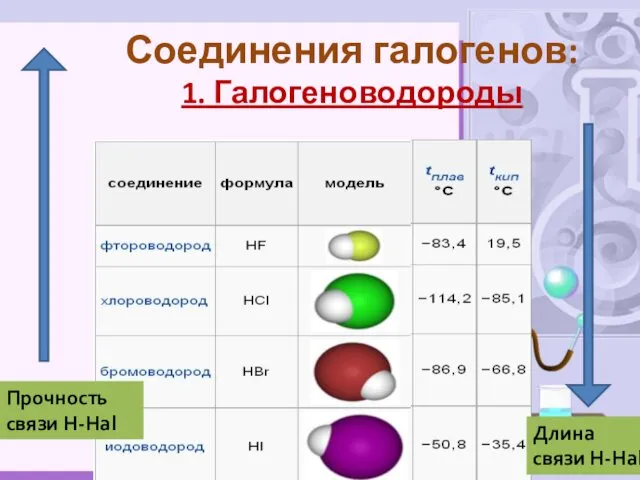
- 37. Соединения галогенов: 1. Галогеноводороды Длина связи Н-Hal Прочность связи Н-Hal
- 38. Бесцветные газы (HF при t С резким запахом Токсичны Хорошо растворяются в воде Дымят во влажном
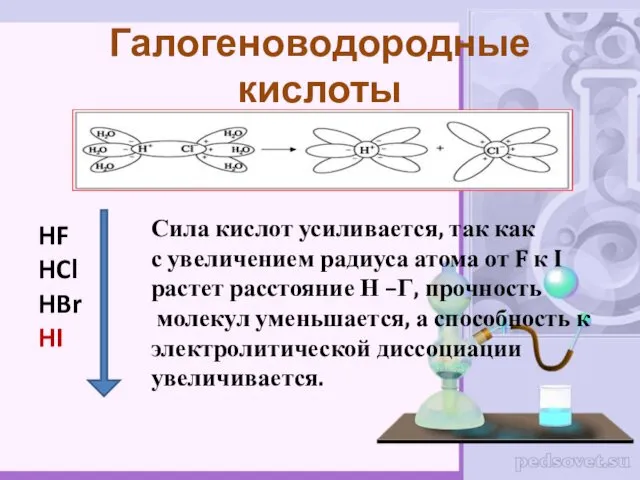
- 39. HF HCl HBr HI Галогеноводородные кислоты Сила кислот усиливается, так как с увеличением радиуса атома от
- 40. В промышленности: синтезом из водорода и хлора: H2 + Cl2 = 2HCl 2) В лаборатории: NaCl
- 41. Физические свойства: бесцветная, дымящая на воздухе жидкость, тяжелее воды Химические свойства: Типичная кислота Соляная кислота С
- 42. Используют для изготовления надписей и рисунков на стекле. SiO2 + 2HF = SiF4↑ + 2H2O Плавиковая
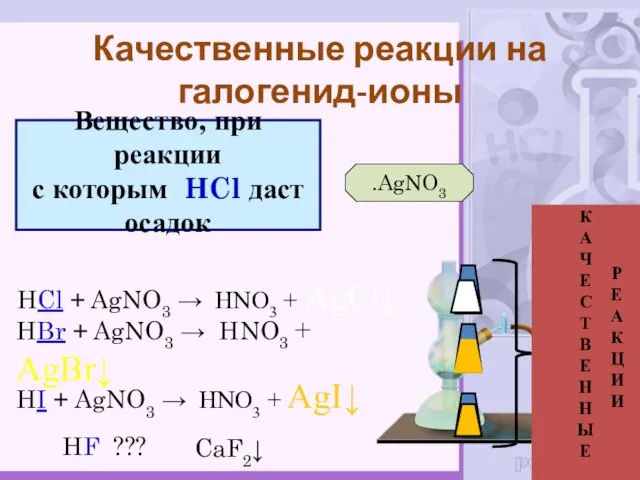
- 43. Вещество, при реакции с которым HCl даст осадок .AgNO3 HCl + AgNO3 → HNO3 + AgCl↓
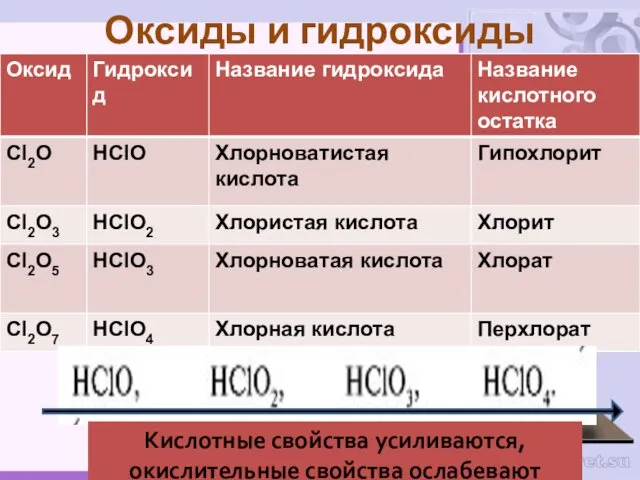
- 44. Оксиды и гидроксиды Кислотные свойства усиливаются, окислительные свойства ослабевают
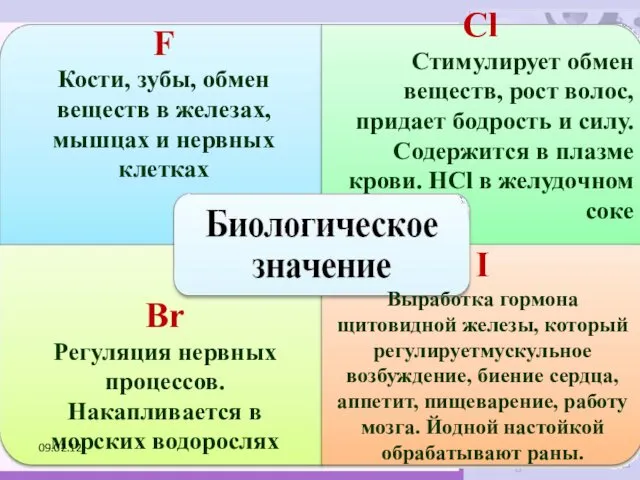
- 45. F Кости, зубы, обмен веществ в железах, мышцах и нервных клетках Сl Стимулирует обмен веществ, рост
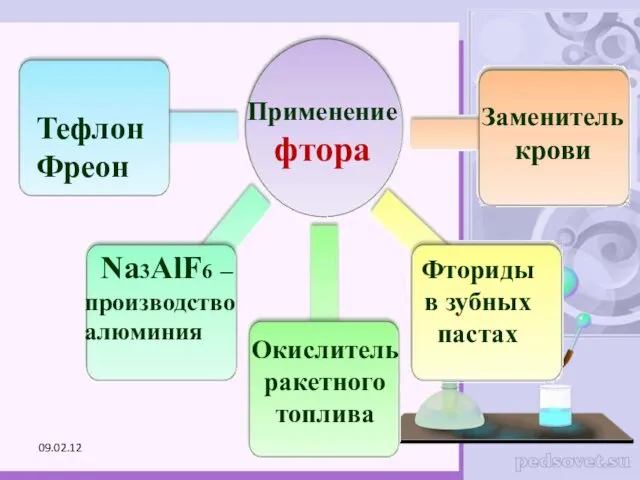
- 46. Применение фтора Тефлон Фреон Na3AlF6 – производство алюминия Окислитель ракетного топлива Заменитель крови Фториды в зубных
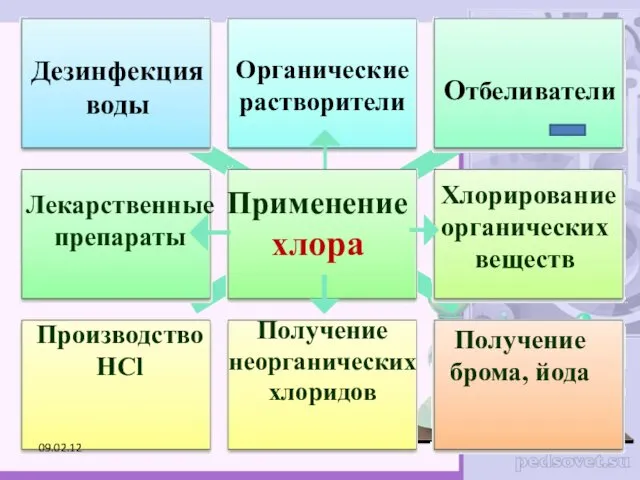
- 47. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
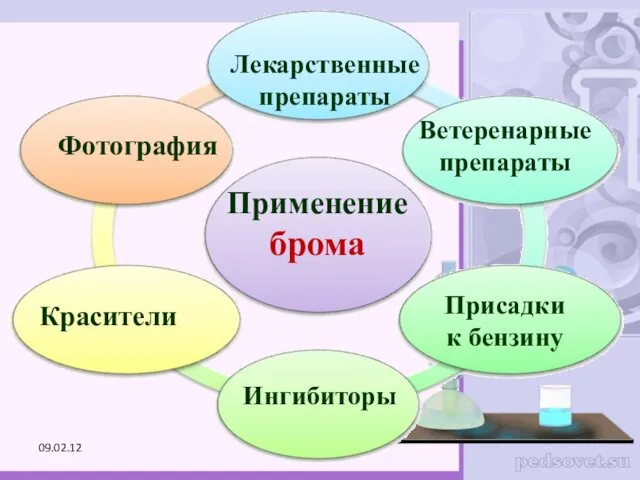
- 48. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину 09.02.12
- 50. Скачать презентацию

























 Презентация Оценка сформированности УУД
Презентация Оценка сформированности УУД Read the word-combinations
Read the word-combinations Классный час Моё свободное время для 3 класса.
Классный час Моё свободное время для 3 класса. Деловая игра как способ совершенствования личности ребенка
Деловая игра как способ совершенствования личности ребенка Види і функції сучасних медіа
Види і функції сучасних медіа Проблемно-диалогическое обучение как средствореализации требований ФГОС на уроках химии
Проблемно-диалогическое обучение как средствореализации требований ФГОС на уроках химии Презентация для педагогов Организация музыкальной предметно-развивающей среды в ДОУ
Презентация для педагогов Организация музыкальной предметно-развивающей среды в ДОУ Почетные граждане села Селты
Почетные граждане села Селты Моя будущая профессия: Стоматолог
Моя будущая профессия: Стоматолог Учебно-методическое пособие
Учебно-методическое пособие Метод проектов в обучении школьников
Метод проектов в обучении школьников Колонны. Расчет центрально-сжатых колонн по материалам
Колонны. Расчет центрально-сжатых колонн по материалам координатная прямая
координатная прямая Красный плоский лишай слизистой оболочки полости рта
Красный плоский лишай слизистой оболочки полости рта Разработка урока на тему: Алгебраическая дробь.Сокращение алгебраических дробей.
Разработка урока на тему: Алгебраическая дробь.Сокращение алгебраических дробей. Альфа- и Бета- распад
Альфа- и Бета- распад Другу
Другу Christmas
Christmas Крещение Иисуса Христа
Крещение Иисуса Христа Презентация к уроку Семья - важнейший институт духовно-нравственного развития
Презентация к уроку Семья - важнейший институт духовно-нравственного развития Знакомство с ТРИК Студией
Знакомство с ТРИК Студией Презентация к уроку Экскурсия по Санкт-петербургу с математикой 5 класс.
Презентация к уроку Экскурсия по Санкт-петербургу с математикой 5 класс. Динамический массив
Динамический массив Basic rules of the articles
Basic rules of the articles Применение здоровьесберегающих технологий в работе с детьми и семьей в средней группе
Применение здоровьесберегающих технологий в работе с детьми и семьей в средней группе Ручная электродуговая и газовая сварка
Ручная электродуговая и газовая сварка Централізоване теплопостачання міста
Централізоване теплопостачання міста Презентация для обобщающего урока- игры по теме Африка 7 класс
Презентация для обобщающего урока- игры по теме Африка 7 класс