Содержание
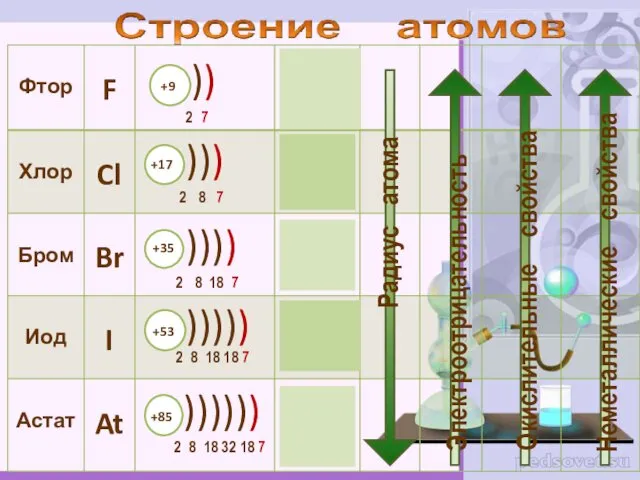
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
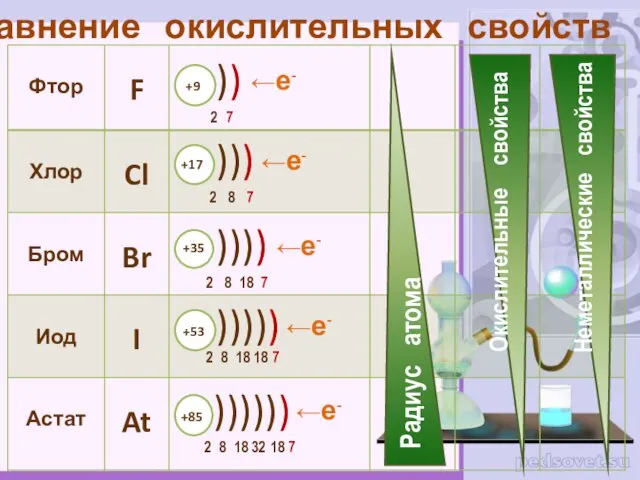
- 4. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
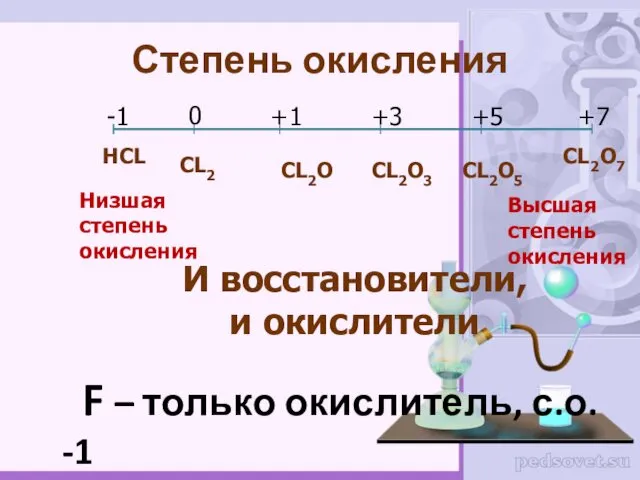
- 5. Степень окисления НCL CL2O7 F – только окислитель, с.о. -1 -1 0 +1 +3 +5 +7
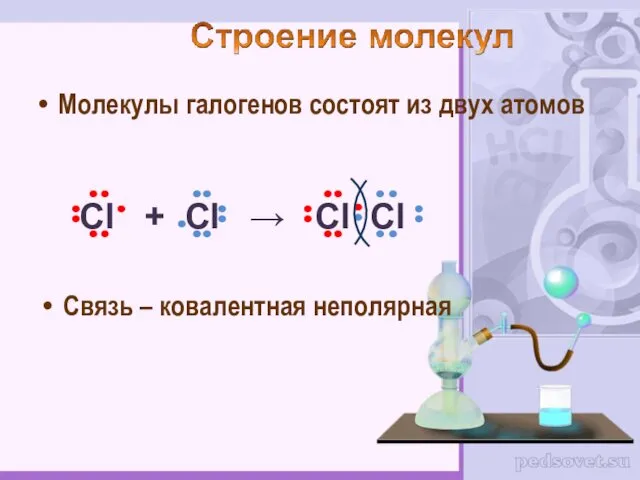
- 6. Молекулы галогенов состоят из двух атомов Связь – ковалентная неполярная
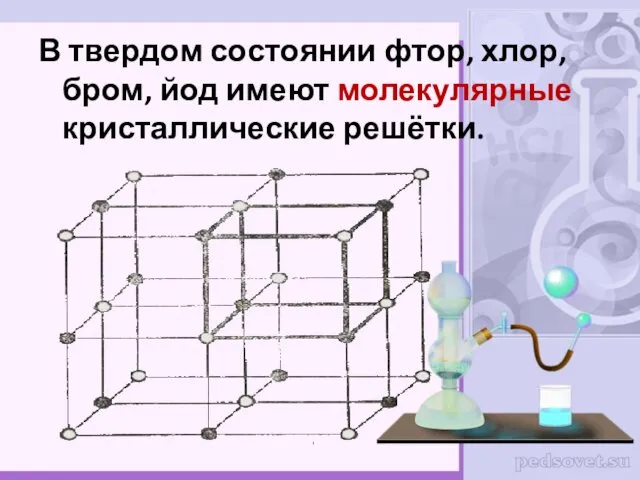
- 7. В твердом состоянии фтор, хлор, бром, йод имеют молекулярные кристаллические решётки.
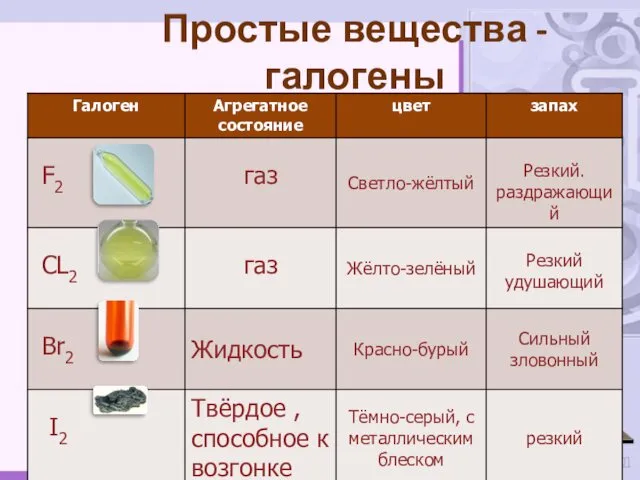
- 8. Простые вещества - галогены
- 9. Выберите два высказывания, в которых говорится о броме как о химическом элементе: : 1) Бром принадлежит
- 10. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
- 11. H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 +
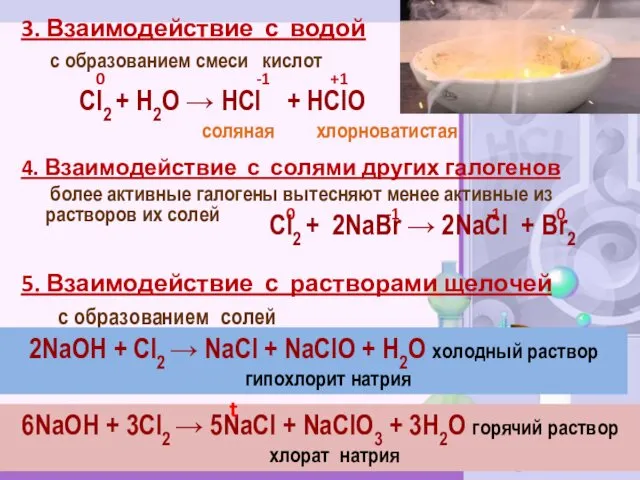
- 12. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 13. Историческая справка Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиус галогены (греч. hals – соль, gen –
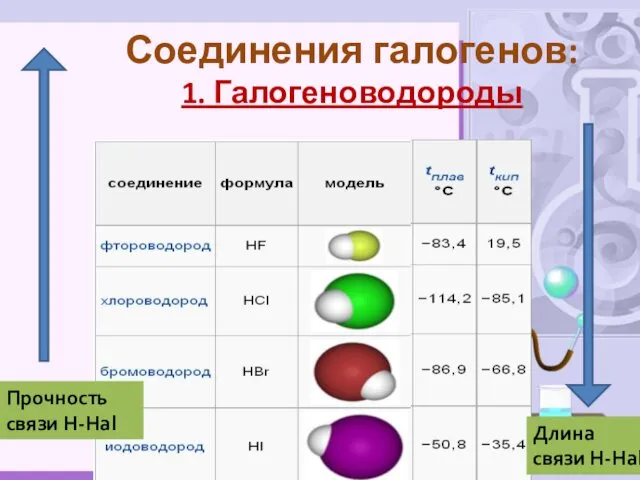
- 14. Соединения галогенов: 1. Галогеноводороды Длина связи Н-Hal Прочность связи Н-Hal
- 15. Бесцветные газы (HF при t С резким запахом Токсичны Хорошо растворяются в воде Дымят во влажном
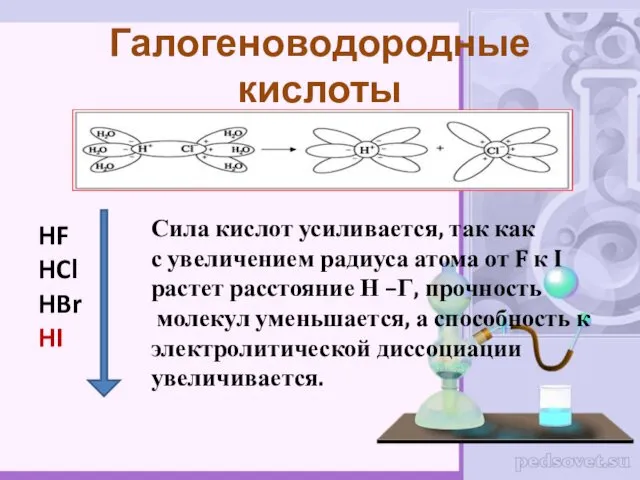
- 16. HF HCl HBr HI Галогеноводородные кислоты Сила кислот усиливается, так как с увеличением радиуса атома от
- 17. В промышленности: синтезом из водорода и хлора: H2 + Cl2 = 2HCl 2) В лаборатории: NaCl
- 18. Физические свойства: бесцветная, дымящая на воздухе жидкость, тяжелее воды Химические свойства: Типичная кислота Соляная кислота С
- 19. Используют для изготовления надписей и рисунков на стекле. SiO2 + 2HF = SiF4↑ + 2H2O Плавиковая
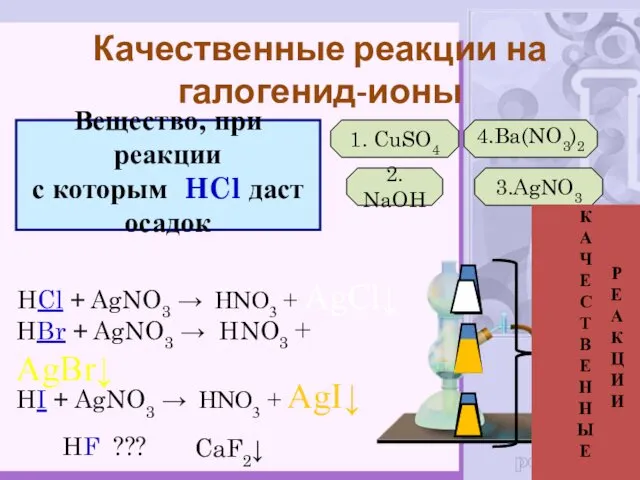
- 20. Вещество, при реакции с которым HCl даст осадок 1. CuSO4 2. NaOH 3.AgNO3 4.Ba(NO3)2 HCl +
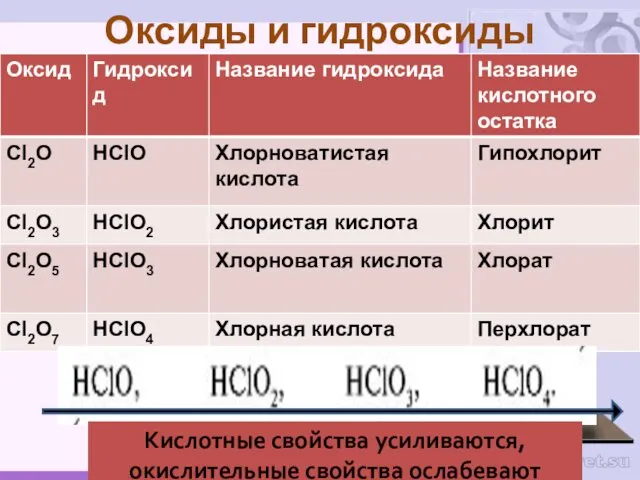
- 21. Оксиды и гидроксиды Кислотные свойства усиливаются, окислительные свойства ослабевают
- 22. Распространенность в природе галит NaCl сильвин KCl сильвинит KCl•NaCl Плавиковый шпат - флюорит CaF2
- 23. Получение галогенов: F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: 2NaCl 2Na
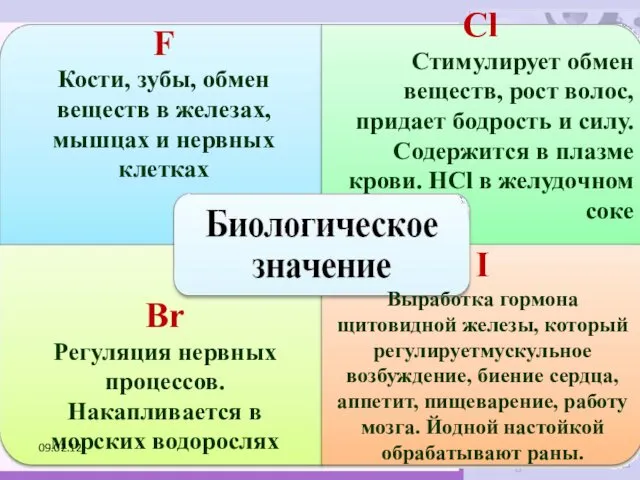
- 24. F Кости, зубы, обмен веществ в железах, мышцах и нервных клетках Сl Стимулирует обмен веществ, рост
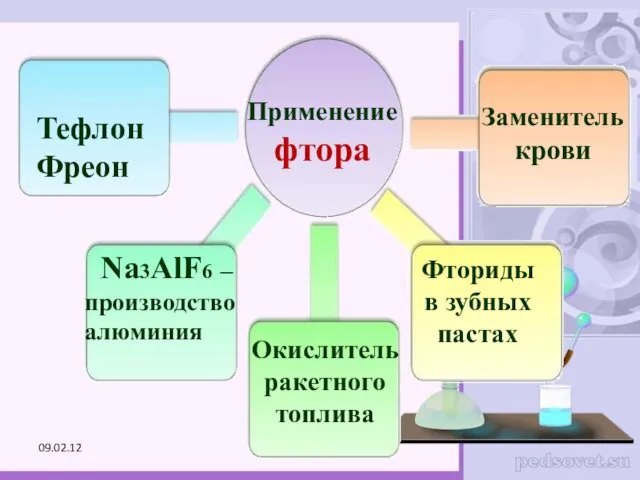
- 25. Применение фтора Тефлон Фреон Na3AlF6 – производство алюминия Окислитель ракетного топлива Заменитель крови Фториды в зубных
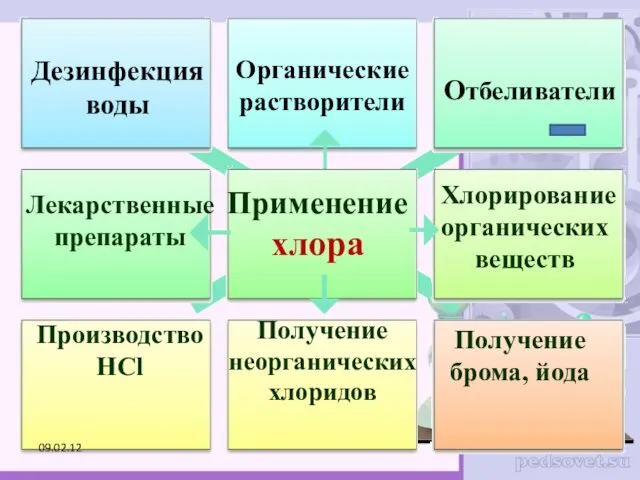
- 26. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
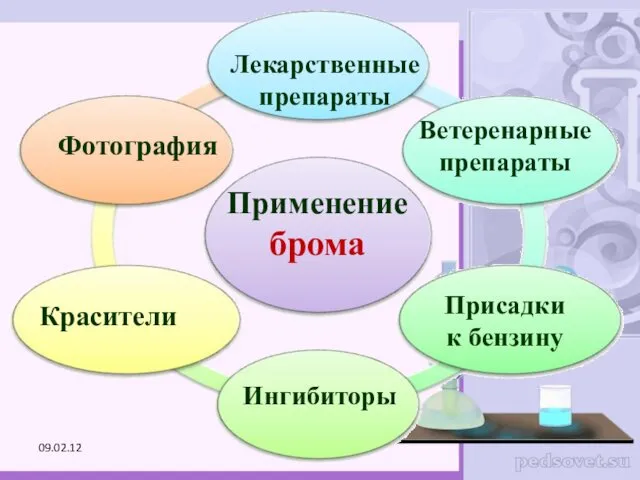
- 27. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину 09.02.12
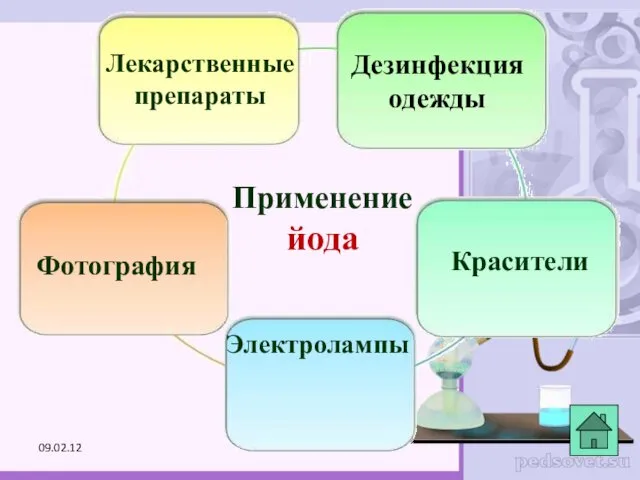
- 28. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы 09.02.12
- 30. Скачать презентацию











 Презентация CONTEMPORARY-свобода мысли и движения
Презентация CONTEMPORARY-свобода мысли и движения Аппараты цепей управления
Аппараты цепей управления Города на старых водных торговых путях
Города на старых водных торговых путях Режимы и техника газовой сварки
Режимы и техника газовой сварки Ортодонтиялық емдеуде қолданылатын функционалды әсер ететін аппараттар
Ортодонтиялық емдеуде қолданылатын функционалды әсер ететін аппараттар Разработка открытого занятия по внеурочной дечтельности, техника Оригами во 2 классе Веселые лягушата
Разработка открытого занятия по внеурочной дечтельности, техника Оригами во 2 классе Веселые лягушата Болезнь Альцгеймера
Болезнь Альцгеймера Санитарно-эпидемиологические требования к обращению с медицинскими отходами
Санитарно-эпидемиологические требования к обращению с медицинскими отходами Соблюдайте правила дорожного движения. Родительское собрание
Соблюдайте правила дорожного движения. Родительское собрание Профилактика дорожно – транспортного травматизма
Профилактика дорожно – транспортного травматизма С.Т. Аксаков в памятниках
С.Т. Аксаков в памятниках Загальні відомості про роботу станцій. Схеми станцій дитячої залізниці “Мала Південна”
Загальні відомості про роботу станцій. Схеми станцій дитячої залізниці “Мала Південна” 3D-моделирование
3D-моделирование Оспа обезьян
Оспа обезьян Симметрия-асимметрия
Симметрия-асимметрия Из жизни слов. Слово любовь
Из жизни слов. Слово любовь Виды цветовых контрастов
Виды цветовых контрастов Ой қозғау
Ой қозғау Презентация к методической разработке Сокровища малахитового сундучка
Презентация к методической разработке Сокровища малахитового сундучка Населення світу
Населення світу Прогнозирование в маркетинговых исследованиях
Прогнозирование в маркетинговых исследованиях Интерактивная игра Мои друзья дорожные знаки
Интерактивная игра Мои друзья дорожные знаки Электрический заряд. Электризация тел. Закон сохранения электрического заряда
Электрический заряд. Электризация тел. Закон сохранения электрического заряда 20231230_zheludok_zuby_serdtse
20231230_zheludok_zuby_serdtse Основные аспекты иммунопрофилактики инфекционных заболеваний
Основные аспекты иммунопрофилактики инфекционных заболеваний How to write an informal letter
How to write an informal letter презентация Экологическое воспитание младших школьников
презентация Экологическое воспитание младших школьников Entertainment
Entertainment