Содержание
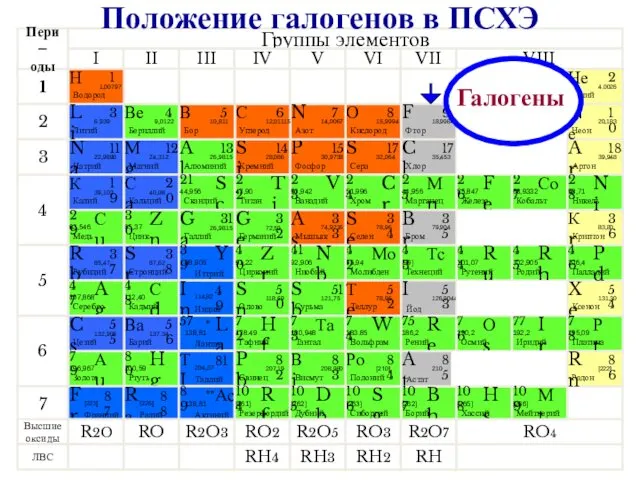
- 2. Галогены Положение галогенов в ПСХЭ
- 3. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 4. В свободном виде не встречаются
- 5. Галит NaCl
- 7. Нахождение галогенов в природе Апатит 3Ca(PO4 ) 2*CaF2
- 8. AgI (йодаргирит)- примесь к другим минералам
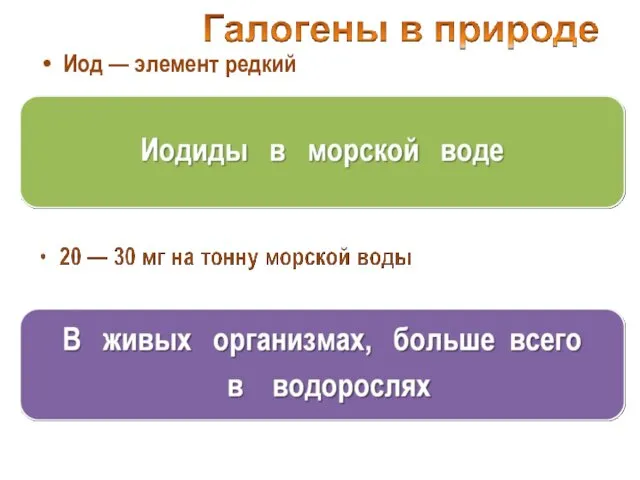
- 9. Иод — элемент редкий
- 10. 5 кг на тонну высушенной морской капусты (ламинарии)
- 13. Галогены
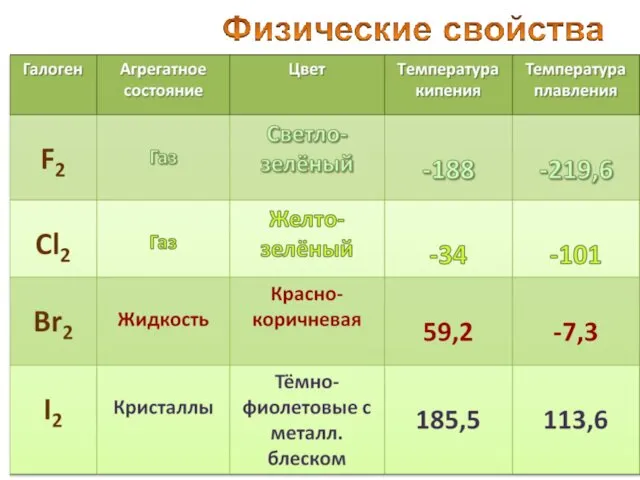
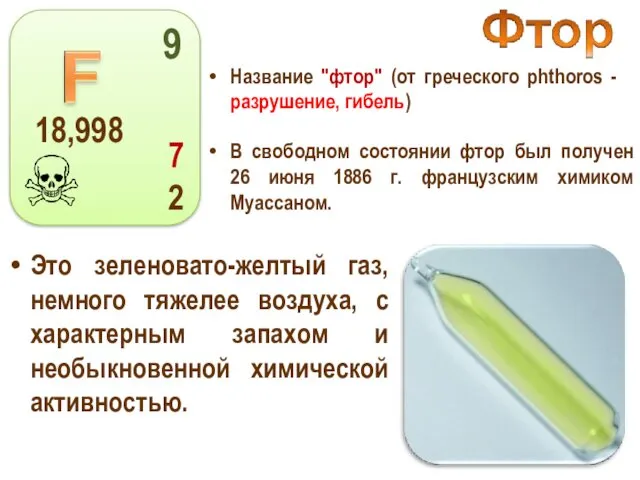
- 14. Название "фтор" (от греческого phthoros - разрушение, гибель) Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным
- 15. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
- 16. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79Вr (50,56%) 81Вr (49,44%) пары
- 17. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 18. Превращение в пары, минуя жидкое состояние
- 19. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
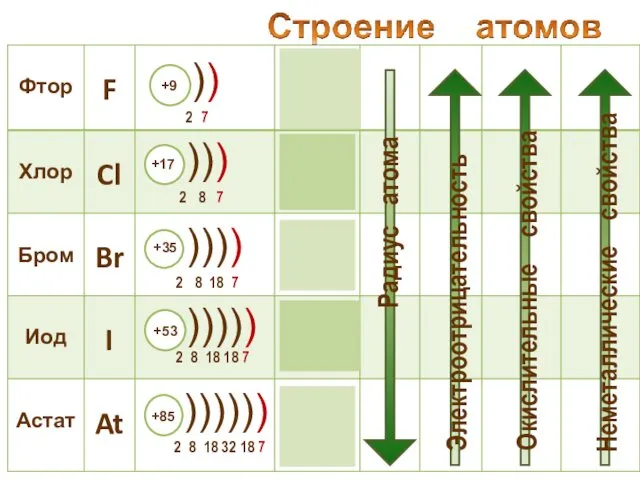
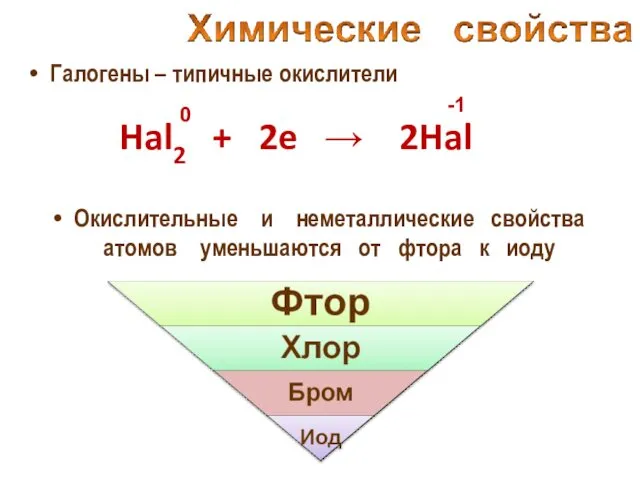
- 20. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
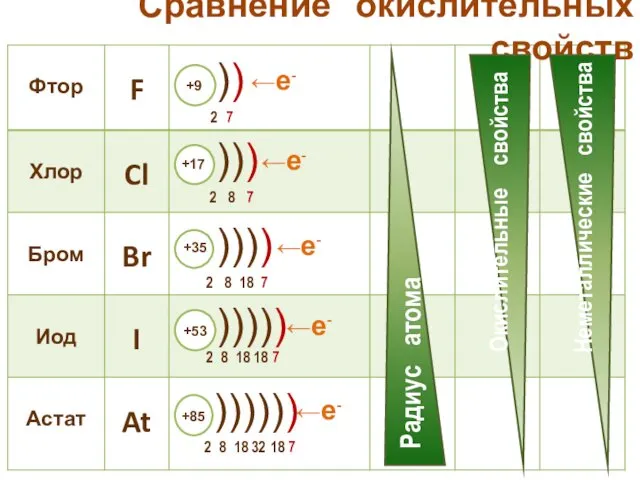
- 21. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
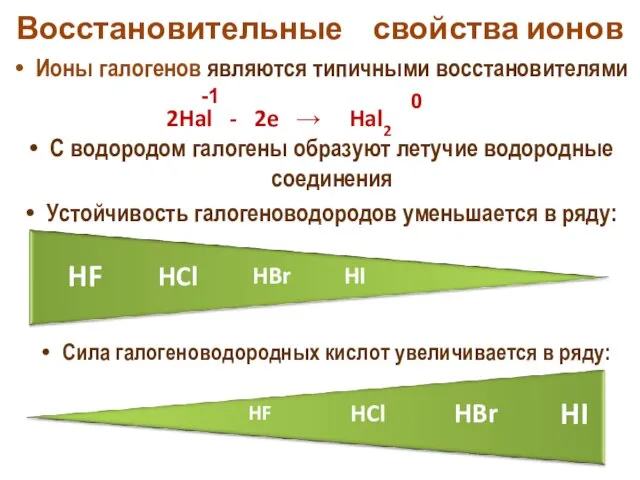
- 22. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
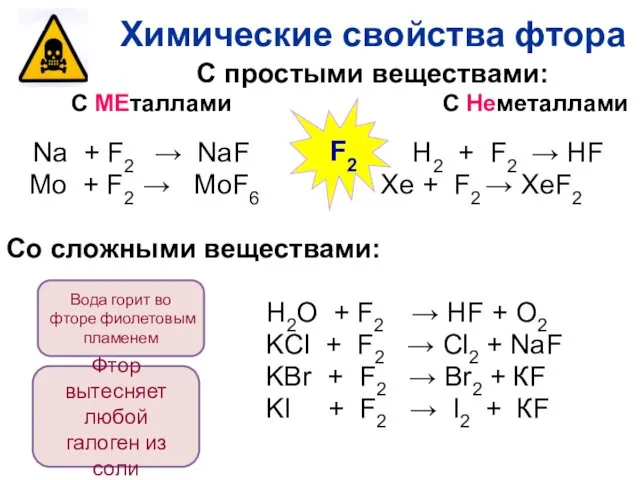
- 23. С простыми веществами: С МЕталлами С Неметаллами Na + F2 → NaF H2 + F2 →
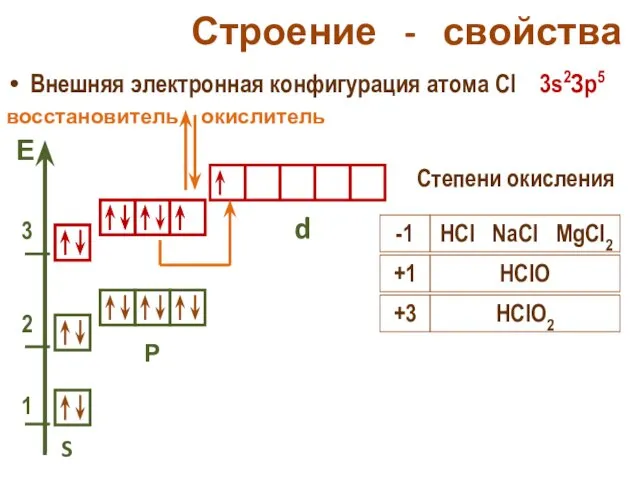
- 24. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления окислитель -1
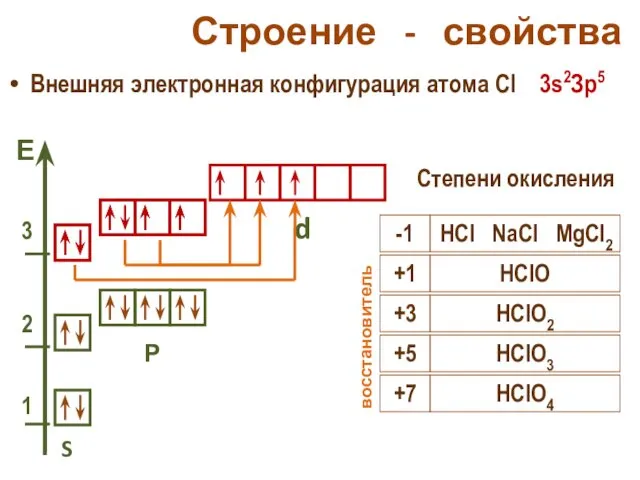
- 25. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления -1 HCl
- 26. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
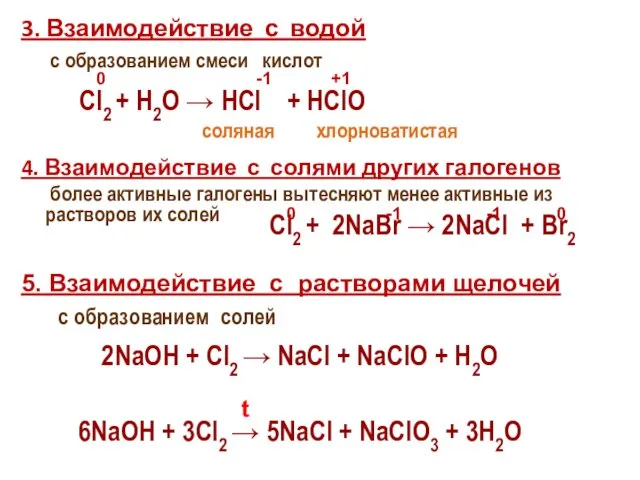
- 27. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 28. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
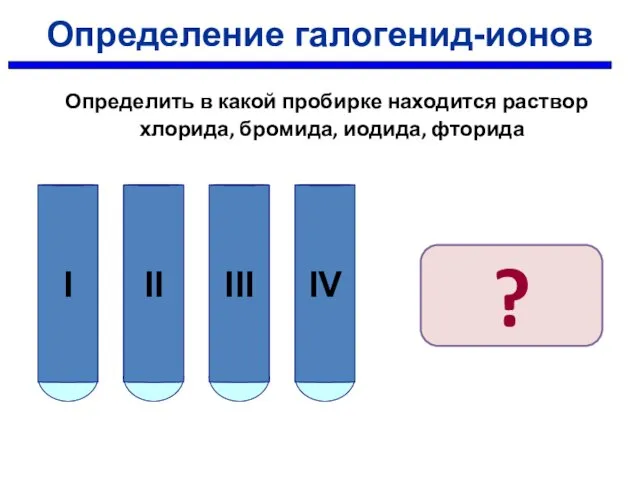
- 29. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
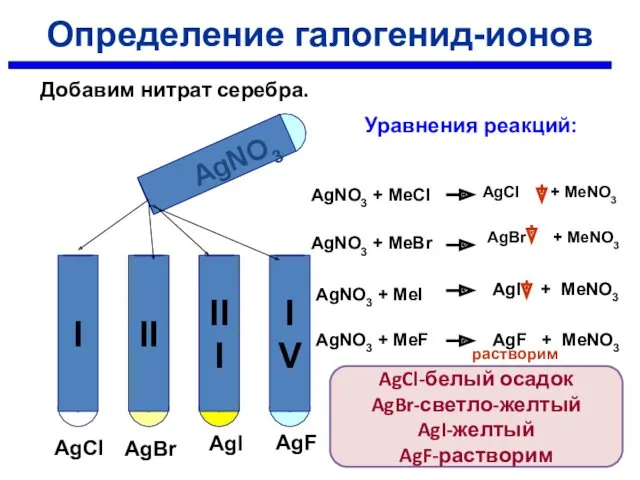
- 30. AgNO3 AgCl AgBr AgI AgF Уравнения реакций: AgNO3 + MeCl AgNO3 + MeBr AgNO3 + MeI
- 31. Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё
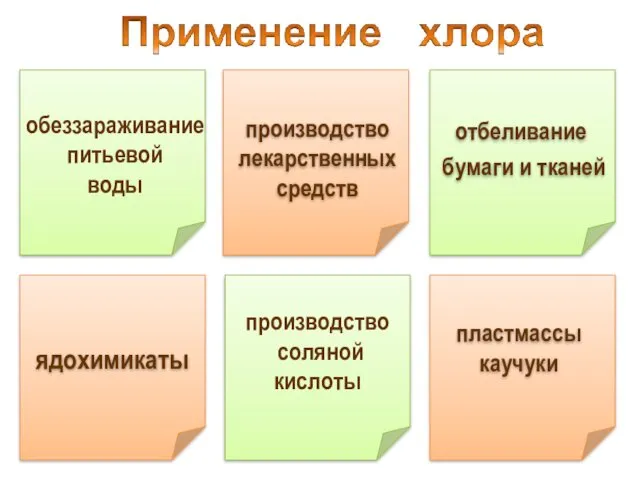
- 32. производство соляной кислоты
- 34. Скачать презентацию
















 Промышленность Донбасса в ХIX веке
Промышленность Донбасса в ХIX веке Исходы беременностей у женщин с миомой матки
Исходы беременностей у женщин с миомой матки Повторение
Повторение Презентация Как ребята помогли Буратино домой вернуться!
Презентация Как ребята помогли Буратино домой вернуться! Влияние химических элементов на свойства сталей
Влияние химических элементов на свойства сталей Гормональная контрацепция. Медикаментозные аборты
Гормональная контрацепция. Медикаментозные аборты Развивающая среда
Развивающая среда Закупки. Дополнение к 1С:БГУ 8
Закупки. Дополнение к 1С:БГУ 8 Отношения объектов и их множеств
Отношения объектов и их множеств Транснациональные компании
Транснациональные компании Классный час по теме Конституция РФ
Классный час по теме Конституция РФ Культура и искусство Древней Греции
Культура и искусство Древней Греции Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа
Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа Влияние алкоголя на организм человека
Влияние алкоголя на организм человека Застывшая музыка
Застывшая музыка Игра 100 к 1
Игра 100 к 1 Нейроэндокринные опухоли поджелудочной железы
Нейроэндокринные опухоли поджелудочной железы Портфоліо. Мазурчук Олена Григорівна
Портфоліо. Мазурчук Олена Григорівна Дозирование жидких лекарственных форм
Дозирование жидких лекарственных форм Кодирование информации
Кодирование информации Сооружение опор выше обреза фундамента. Тема № 3
Сооружение опор выше обреза фундамента. Тема № 3 Рисующий свет
Рисующий свет Проверка электронного документа. Личный кабинет
Проверка электронного документа. Личный кабинет Методы и стили семейного воспитания
Методы и стили семейного воспитания Инструктаж по правилам дорожного движения (для детей)
Инструктаж по правилам дорожного движения (для детей) Соберём пазлы на тему:Масленица. 1 класс.
Соберём пазлы на тему:Масленица. 1 класс. Компьютерные презентации. Дизайн презентации и макеты слайдов
Компьютерные презентации. Дизайн презентации и макеты слайдов Творческий отчет заместителя директора по УР как показатель успешности деятельности образовательного учреждения 2013-2014 уч.год
Творческий отчет заместителя директора по УР как показатель успешности деятельности образовательного учреждения 2013-2014 уч.год