Содержание
- 2. Цели урока: Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства
- 3. Основное содержание Понятие о галогеноводородах Галогеноводородные кислоты Оксокислоты Галогениды.(соли) Значение соединений галогенов.
- 4. Соединения галогенов Галогеноводороды, – Это едкие газы с резким запахом, хорошо раствормые в воде HF HCl
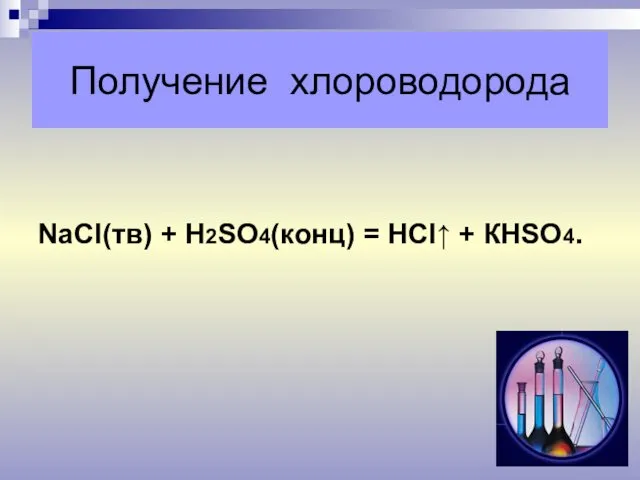
- 5. Получение хлороводорода NaСl(тв) + Н2SО4(конц) = НСl↑ + КНSО4.
- 6. Галогеноводородные кислоты Образуются при растворении галогеноводородов в воде. HF HCl HBr HI Фтороводородная кислота ( плавиковая)
- 7. Оксокислоты Хлорная – НСlO4 Сl2O7 Хлорноватая – НСlO3 Сl2O5 Хлористая – НСlO2 Сl2O3 Хлорноватистая- НСlO Сl2O
- 8. Соли Фториды Хлориды Бромиды Йодиды Галогениды Na F KCl KBr NaI
- 9. Качественная реакция на галогенид - ионы Взаимодействие с ионом серебра: (AgNO3) AgNO3 + KCl = KNO3
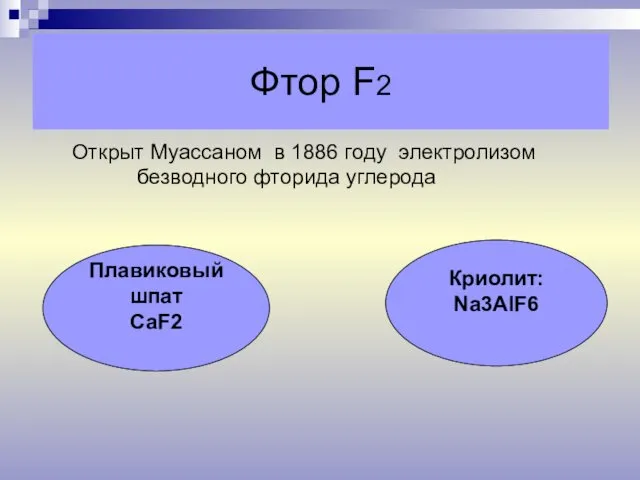
- 10. Фтор F2 Открыт Муассаном в 1886 году электролизом безводного фторида углерода Плавиковый шпат СаF2 Криолит: Na3AlF6
- 11. Соединения фтора n(-CF2-CF2-) Тефлон устойчив к действию всех известных кислот и их смесей. Он выдерживает температуры
- 12. Галит (NaCl ) Хлор ДДТ (дихлородифенилтрихлорэтан) KClO3 - Бертолетова соль. 2KClO3 + 3S = 2KСl +
- 13. AgBr- фотография NaBr- дубление кожи KBr- линзы LiBr- используется в кондиционерах. Бром
- 14. Получил Б.Куртуа. (1811 г) 2NaI + 2H2SO4 = I2 + SO2↑ + Na2SO4 + 2H2O 3I2
- 16. Скачать презентацию











 Занятие по экологии Амурский тигр - хозяин Дальневосточной тайги
Занятие по экологии Амурский тигр - хозяин Дальневосточной тайги Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Необычные животные
Необычные животные Игра Умницы и умники
Игра Умницы и умники Мажор, минор
Мажор, минор Особенности копинг-стратегий подростков, входящих в группу суицидального риска
Особенности копинг-стратегий подростков, входящих в группу суицидального риска Презентация Технология развивающих игр
Презентация Технология развивающих игр Презентация Хозяйство мира
Презентация Хозяйство мира презентация История робототехники
презентация История робототехники Микроконтроллеры. Платформа Arduino UNO
Микроконтроллеры. Платформа Arduino UNO Нейропсихологические основы современных методов коррекции речевых расстройств (Полуэктова Е. Н. - учитель-логопед)
Нейропсихологические основы современных методов коррекции речевых расстройств (Полуэктова Е. Н. - учитель-логопед) Оборудование процессов ректификации
Оборудование процессов ректификации Познавательно – игровая программа: Благодарное слово.
Познавательно – игровая программа: Благодарное слово. Задачи по управленческому учету
Задачи по управленческому учету Портативна координатно-вимірювальна машина
Портативна координатно-вимірювальна машина Куликовская битва
Куликовская битва Проект про маму
Проект про маму Тест Твое здоровье
Тест Твое здоровье Проект:Эх, да Масленица
Проект:Эх, да Масленица Система сбора и подготовки нефти
Система сбора и подготовки нефти Рисуем Космос
Рисуем Космос Материалы для родителей
Материалы для родителей Протокол HTTP
Протокол HTTP XXI Всероссийская олимпиада школьников по информатике
XXI Всероссийская олимпиада школьников по информатике Выставка Зимняя сказка
Выставка Зимняя сказка Мифы о космонавтике
Мифы о космонавтике Вода- источник жизни на земле (презентация)
Вода- источник жизни на земле (презентация) Общественно-транспортные комплексы
Общественно-транспортные комплексы