Содержание
- 2. Агрегатные состояния вещества Лед Вода Пар Газы не имеют собственной формы и объема, занимают весь объем
- 3. Закон Авогадро В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул Следствие из
- 4. Решение задач Рассчитайте массу веселящего газа (оксида азота (I)), который занимает объем 0,56 л (н.у.) Рассчитайте
- 5. Воздух – смесь газов Ранняя атмосфера: метан (CH4), аммиак (NH3), углекислый газ (CO2) Современная атмосфера: азот
- 6. Водород H2 Физические свойства: легкий газ (Mr=2), бесцветный, без запаха, малорастворим в воде Способы получения: в
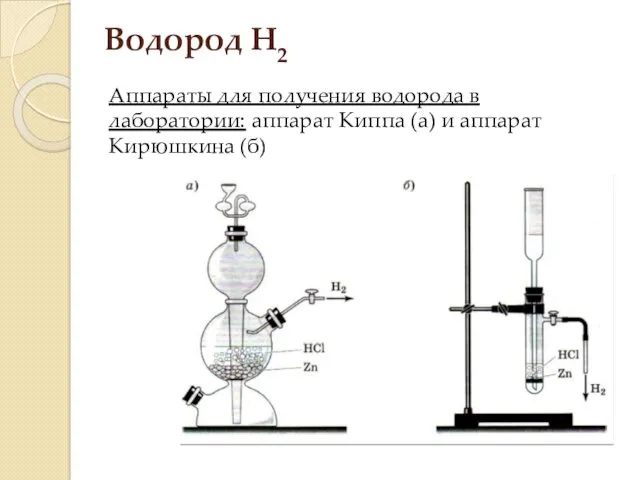
- 7. Водород H2 Аппараты для получения водорода в лаборатории: аппарат Киппа (а) и аппарат Кирюшкина (б)
- 8. Водород H2 Собирание водорода: вытеснением воздуха (б) или вытеснением воды (а) (сосуд направлен вверх дном, т.к.
- 9. Водород H2 Применение: сырье для производство аммиака, хлороводорода; получение маргарина; водородная резка и сварка металла; топливо
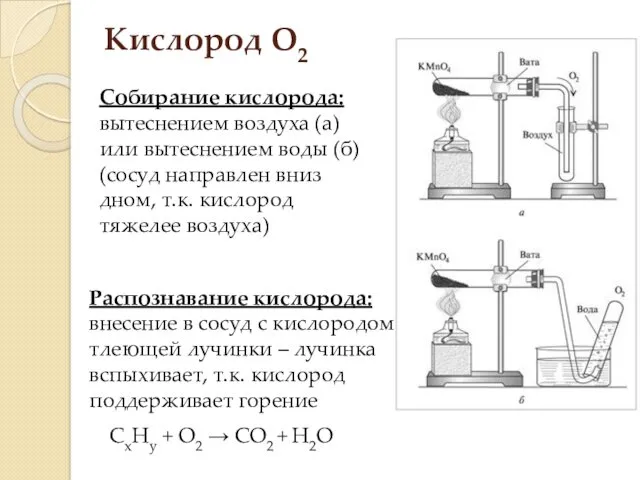
- 10. Кислород O2 Физические свойства: газ тяжелее воздуха (Mr=32), бесцветный, без запаха, малорастворим в воде Способы получения:
- 11. Кислород О2 Собирание кислорода: вытеснением воздуха (а) или вытеснением воды (б) (сосуд направлен вниз дном, т.к.
- 12. Кислород О2 Применение: поддержание дыхания и горения кислородные камеры
- 13. Углекислый газ СО2 Физические свойства: газ тяжелее воздуха (Mr=44), бесцветный, без запаха, хорошо растворяется в воде
- 14. Углекислый газ СО2 Собирание углекислого газа: вытеснением воздуха (сосуд направлен вниз дном, т.к. углекислый газ тяжелее
- 15. Углекислый газ СО2 Применение: изготовление шипучих напитков, тушение пожаров, получение «сухого льда» ягоды на сухом льде
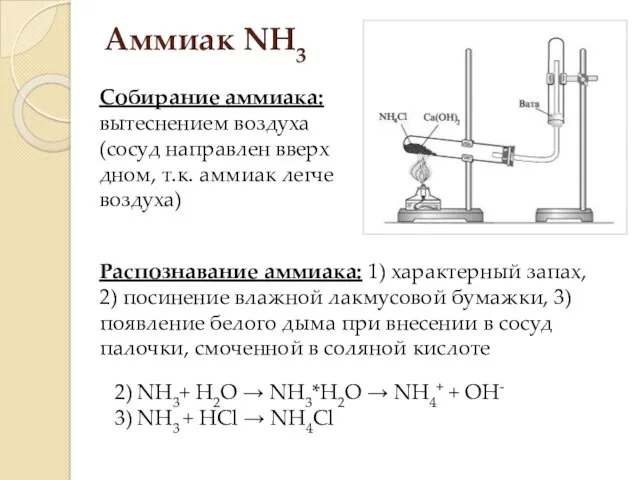
- 16. Аммиак NH3 Физические свойства: газ легче воздуха (Mr=17), бесцветный, с резким запахом, хорошо растворяется в воде
- 17. Аммиак NH3 Собирание аммиака: вытеснением воздуха (сосуд направлен вверх дном, т.к. аммиак легче воздуха) Распознавание аммиака:
- 18. Аммиак NH3 Применение: в медицине, получение удобрений, производство азотной кислоты
- 19. Этилен (этен) С2H4 Физические свойства: газ немного легче воздуха (Mr=26), бесцветный, со слабым запахом, частично растворим
- 20. Этилен С2H4 Собирание этилена: вытеснением воздуха (сосуд направлен вверх дном, т.к. этилен легче воздуха) Распознавание этилена:
- 21. Этилен С2H4 Применение: производство полиэтилена, органических растворителей; ускорение созревания плодов в овощехранилищах дозревание плодов полиэтилен
- 23. Скачать презентацию

















 Показатели надежности невосстанавливаемых и восстанавливаемых объектов
Показатели надежности невосстанавливаемых и восстанавливаемых объектов Дидактические игры на уроках химии и биологии
Дидактические игры на уроках химии и биологии Микропротезирование. Вкладки, виниры. Штифтовый зуб
Микропротезирование. Вкладки, виниры. Штифтовый зуб Экологические зарисовки
Экологические зарисовки Масленица
Масленица Обобщение опыта: Развитие мелкой моторики и координации движений рук у детей младшего дошкольного возраста через игры и специальные упражнения
Обобщение опыта: Развитие мелкой моторики и координации движений рук у детей младшего дошкольного возраста через игры и специальные упражнения Анатомо-физиологические особенности дыхательной системы у детей
Анатомо-физиологические особенности дыхательной системы у детей Отравляющие вещества раздражающего действии. Клиника, диагностика, лечение
Отравляющие вещества раздражающего действии. Клиника, диагностика, лечение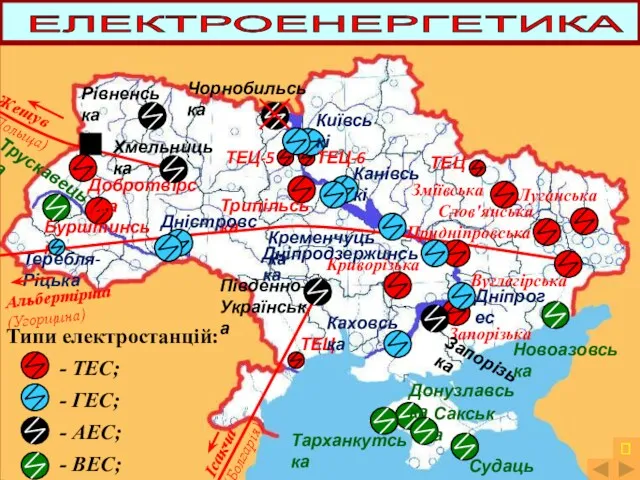 Металургiйний комплекс України
Металургiйний комплекс України Презентация Красная книга Саратовской области
Презентация Красная книга Саратовской области Современные гаджеты для дома
Современные гаджеты для дома Levi Strauss & Co. brand
Levi Strauss & Co. brand Обогащение бериллиевых руд. Обогащение руд и россыпей редкоземельных металлов и тория
Обогащение бериллиевых руд. Обогащение руд и россыпей редкоземельных металлов и тория Своя игра
Своя игра سياحة علاجية
سياحة علاجية Фибрилляция предсердий и её лечение
Фибрилляция предсердий и её лечение Химически опасные объекты
Химически опасные объекты преподавание регионального компонента в курсе экономической географии России
преподавание регионального компонента в курсе экономической географии России Оформление групповой комнаты
Оформление групповой комнаты Презентация к классному часу Великие женщины России
Презентация к классному часу Великие женщины России Формирование грамматически правильной речи. Дидактическая игра Чудесный мешочек
Формирование грамматически правильной речи. Дидактическая игра Чудесный мешочек Композицияның басты бөлігі
Композицияның басты бөлігі Проект Использование приёмов мультимедиа-технологий в логопедической работе. На примере занятия по развитию речи по теме: Зима
Проект Использование приёмов мультимедиа-технологий в логопедической работе. На примере занятия по развитию речи по теме: Зима Светодиоды. История создания светодиодов
Светодиоды. История создания светодиодов Windows Server 2012 R2
Windows Server 2012 R2 Основы логики
Основы логики класс Окружающий мир (1)
класс Окружающий мир (1) Сущность железобетонных конструкций
Сущность железобетонных конструкций