Содержание
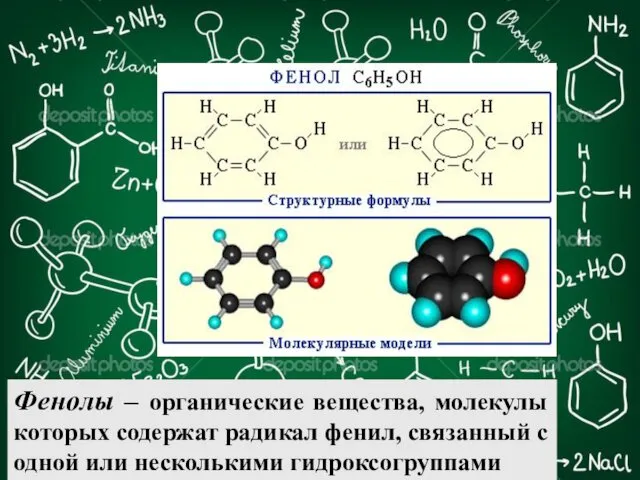
- 2. Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами
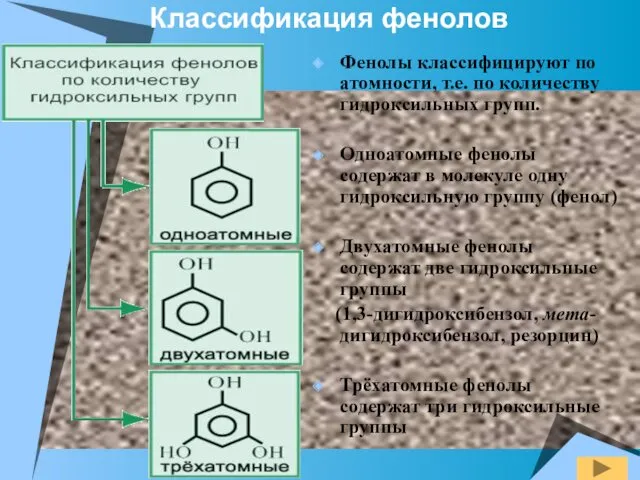
- 3. Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп. Одноатомные фенолы содержат в молекуле одну гидроксильную
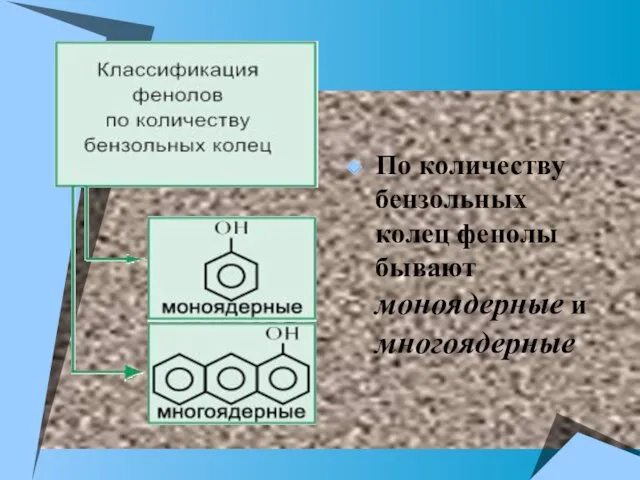
- 4. По количеству бензольных колец фенолы бывают моноядерные и многоядерные
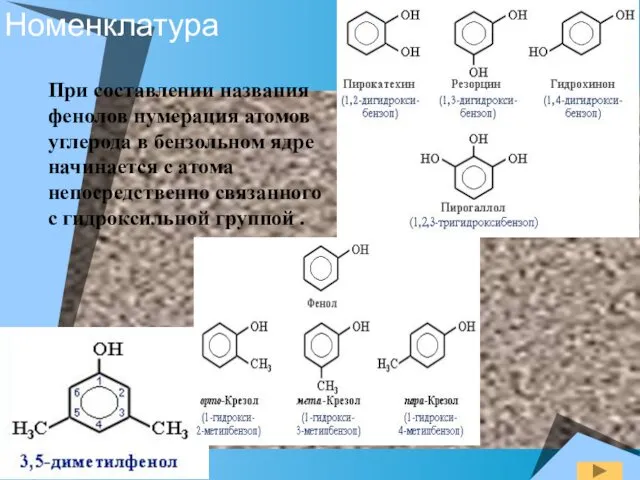
- 5. Номенклатура При составлении названия фенолов нумерация атомов углерода в бензольном ядре начинается с атома непосредственно связанного
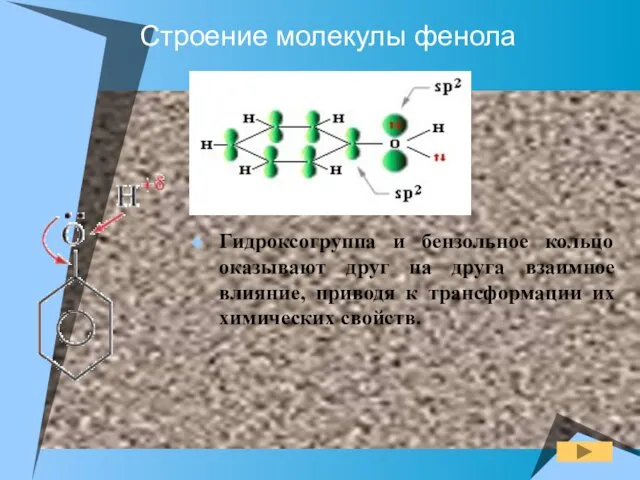
- 6. Строение молекулы фенола Гидроксогруппа и бензольное кольцо оказывают друг на друга взаимное влияние, приводя к трансформации
- 7. Физические свойства фенола Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного окисления на воздухе он бывает
- 8. на план урока
- 9. Химические свойства фенола Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы бензольного ядра
- 10. Химические свойства, обусловленные наличием гидроксильной группы 1. Диссоциация фенола Влияние бензольного кольца на гидроксильную группу выражается
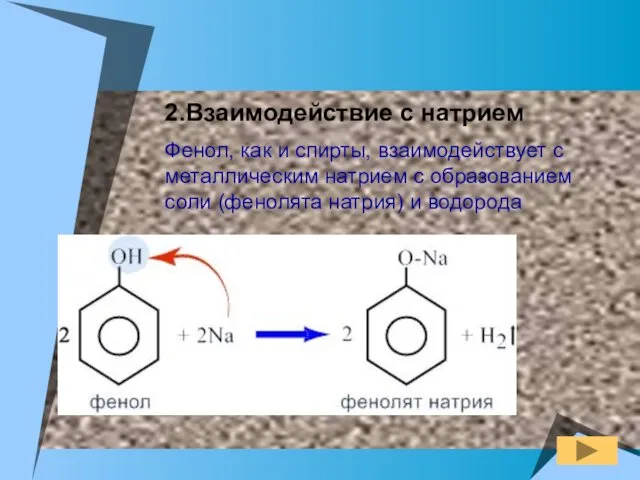
- 11. 2.Взаимодействие с натрием Фенол, как и спирты, взаимодействует с металлическим натрием с образованием соли (фенолята натрия)
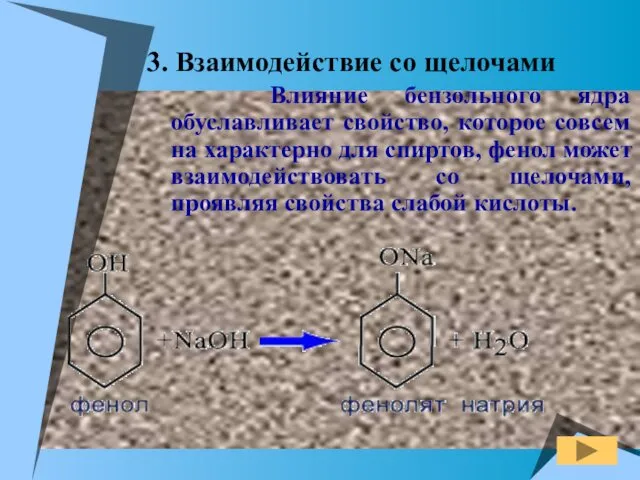
- 12. 3. Взаимодействие со щелочами Влияние бензольного ядра обуславливает свойство, которое совсем на характерно для спиртов, фенол
- 14. Карболовая кислота в 300 раз слабее угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют
- 15. Химические свойства, обусловленные наличием бензольного ядра Отличия от ароматических углеводородов: 1. Реакции окисления Фенол окисляется кислородом
- 16. 2. Реакции замещения. А. Галогенирование – для фенола характерны реакции замещения с галогенами. Они проходят значительно
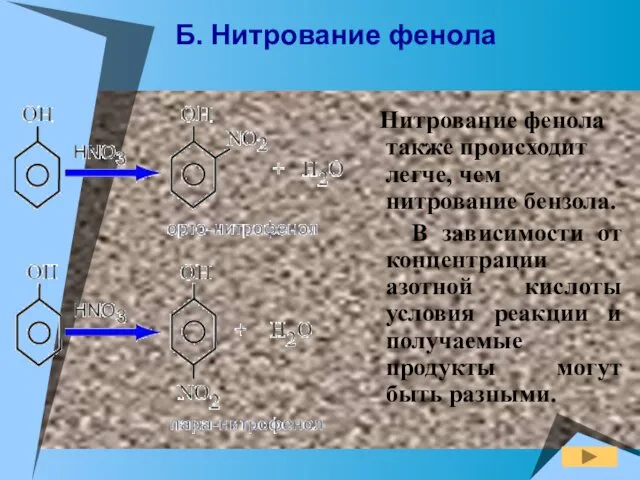
- 18. Б. Нитрование фенола Нитрование фенола также происходит легче, чем нитрование бензола. В зависимости от концентрации азотной
- 19. В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество. В XIX столетии её применяли
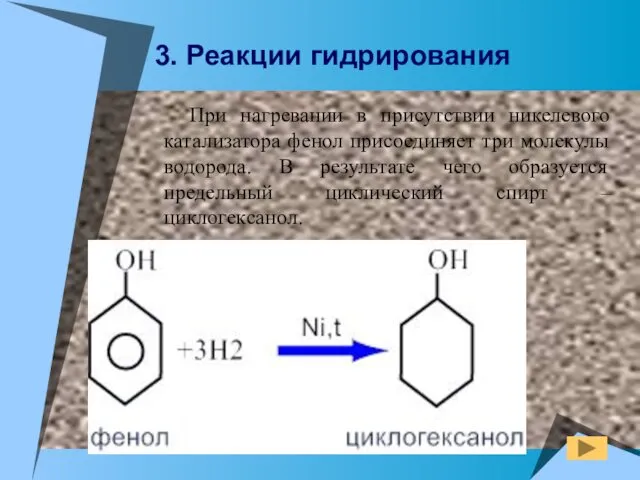
- 20. При нагревании в присутствии никелевого катализатора фенол присоединяет три молекулы водорода. В результате чего образуется предельный
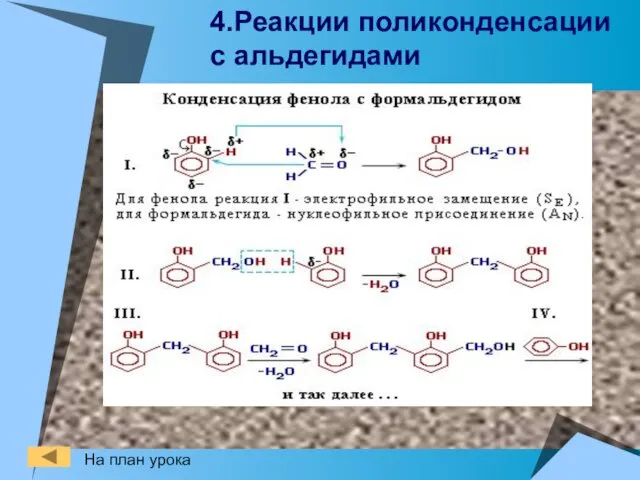
- 21. 4.Реакции поликонденсации с альдегидами На план урока
- 22. 5. Качественная реакция на фенол
- 23. Получение фенола 1. Фенол выделяют из каменноугольной смолы. Однако потребность в феноле настолько велика, что этого
- 24. Применение фенола. Фенол применяют для производства фенолформальдегидных пластмасс, синтетического волокна капролактам, красителей, лекарств, взрывчатых веществ и
- 25. Чем опасен фенол. Практически сразу после получения фенола ученые установили, что это химическое вещество обладает не
- 26. Сфера применения фенолов достаточно широка, но большинство жителей нашей страны узнало о них из-за скандала, разразившегося
- 28. Скачать презентацию















 Во что играют ваши дети
Во что играют ваши дети Классный час Разговор о вредных привычках
Классный час Разговор о вредных привычках Десятичные дроби. Исторический материал
Десятичные дроби. Исторический материал Инфаркт миокарда и сахарный диабет
Инфаркт миокарда и сахарный диабет Система управления химико-технологическими процессами
Система управления химико-технологическими процессами Проблемные методы в развивающем обучении дошкольников.
Проблемные методы в развивающем обучении дошкольников. Тренды 2018
Тренды 2018 Презентация к родительскому собранию Авторитет родителей.
Презентация к родительскому собранию Авторитет родителей. Пора к неврологу
Пора к неврологу Цитология – наука о клетке. Современные методы исследования
Цитология – наука о клетке. Современные методы исследования Описторхоз кезіндегі шаралар стандарттары мен алгоритмдері
Описторхоз кезіндегі шаралар стандарттары мен алгоритмдері Галузь промисловості - металургія
Галузь промисловості - металургія Эти удивительные животные
Эти удивительные животные Қазіргі әлемдегі машина жасау өнеркәсібінің дамуы
Қазіргі әлемдегі машина жасау өнеркәсібінің дамуы Пришла весна
Пришла весна Машины постоянного тока
Машины постоянного тока Презентация к уроку. Черчение - 8 класс (по А.Д.Ботвинникову). Тема урока: Общие сведения о проецировании.
Презентация к уроку. Черчение - 8 класс (по А.Д.Ботвинникову). Тема урока: Общие сведения о проецировании. Классный час Моя семья - мое богатство
Классный час Моя семья - мое богатство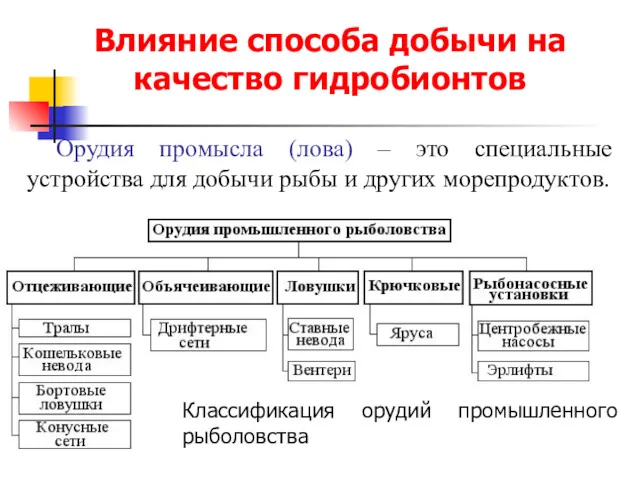 Влияние способа добычи на качество гидробионтов. Орудия промысла (лова)
Влияние способа добычи на качество гидробионтов. Орудия промысла (лова) Поздравление папы
Поздравление папы Эксплуатация электрических сетей и систем электроснабжения
Эксплуатация электрических сетей и систем электроснабжения Консультация для воспитателей Реализация ФГОС ДО в практике работы дошкольных образовательных учреждений
Консультация для воспитателей Реализация ФГОС ДО в практике работы дошкольных образовательных учреждений Шизофрения. Параноидная форма. Аспекты клиники, этиологии и патогенеза
Шизофрения. Параноидная форма. Аспекты клиники, этиологии и патогенеза А.Т.Болотов-первый русский агроном
А.Т.Болотов-первый русский агроном Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш
Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш Тактика. Борьба с танками, бронированными машинами и противотанковыми средствами противника. (Тема 6.1)
Тактика. Борьба с танками, бронированными машинами и противотанковыми средствами противника. (Тема 6.1) Мир цветов
Мир цветов Функции современной семьи
Функции современной семьи