Содержание
- 2. Литература 1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2007. -976 с. 2.Пузаков
- 3. 5.Биоорганическая химия. Учебник. (Тюкавкина Н.А., Бауков Ю.И.). 7 изд., Дрофа. 2008 – 543 с. 6.Руководство к
- 4. Интернет-источники http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://www.chemlib.ru http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/
- 5. Значение химии в медицине 1.78 химических элементов входят в состав живых организмов. 2.44 элемента входят в
- 6. Задача, стоящая перед медиками в ближайшее время, предупреждать, а не лечить болезни. Чтобы стать высококвалифицированным специалистом
- 7. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
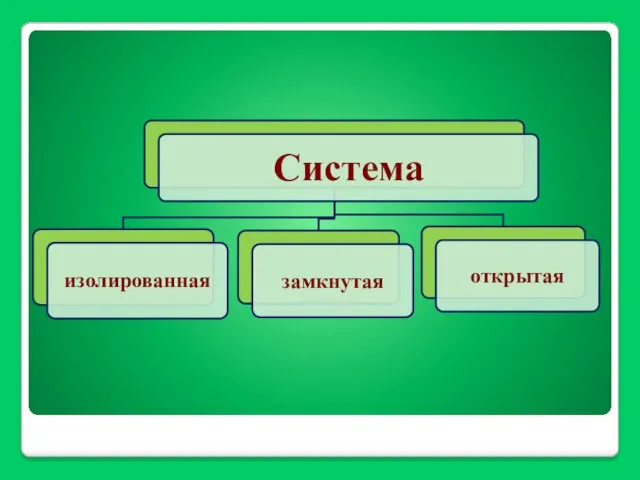
- 8. Термодинамика – наука, изучающая общие законы взаимного превращения одной формы энергии в другую. Система – это
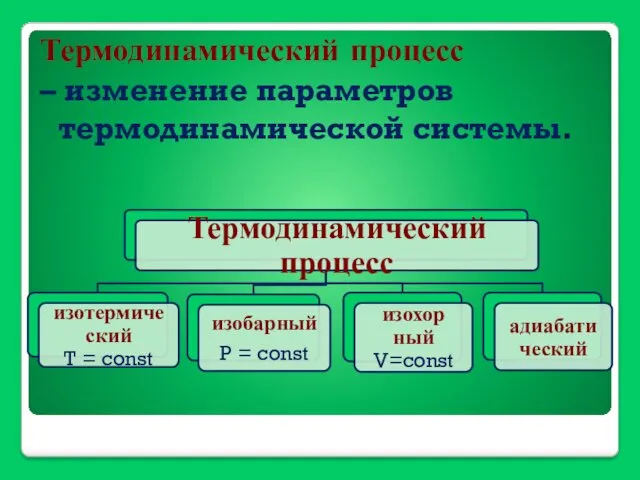
- 11. Термодинамический процесс – изменение параметров термодинамической системы.
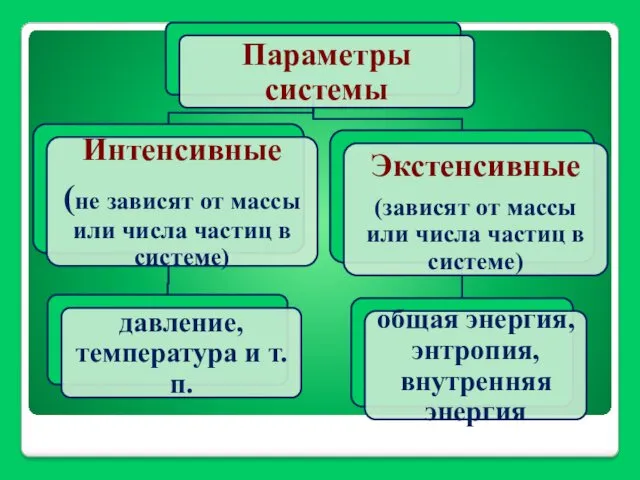
- 12. Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц)
- 13. Внутренняя энергия разделяется на свободную энергию и связанную энергию: U = G + Wсв Свободная энергия
- 14. При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы
- 15. Энергия расширенной системы, или внутреннее теплосодержание системы называется энтальпией (Н). Для экзотермических реакций Q>0, ΔH Для
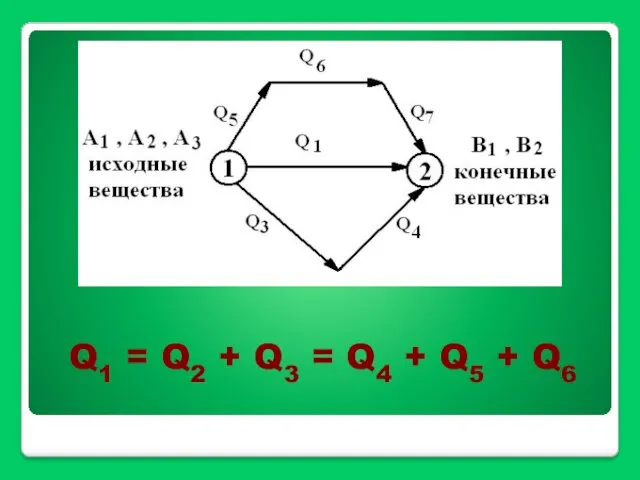
- 16. Q1 = Q2 + Q3 = Q4 + Q5 + Q6
- 17. I следствие закона Гесса где νн, νк - стехиометрические коэффициенты для реакции аА + bB→dD ∆Hреакц.
- 18. Величина и знак теплоты образования характеризуют устойчивость соединения в данных условиях Вещество NH3 PH3 AsH3 SbH3
- 19. Энтропия (S) - функция состояния термодинамической системы, используемая во втором законе т/д для выражения через нее
- 20. ΔG – изобарно-изотермический потенциал (свободная энергия Гиббса) ΔG = ΔH – T · ΔS где ΔH
- 21. Особенности живых организмов с позиции термодинамики 1.Живой организм – открытая система, непрерывно обменивающаяся с окружающей средой
- 22. 3. Все биохимические процессы, происходящие в клетках живых организмов, протекают при постоянной температуре, давлении, при незначительных
- 23. Главными компонентами пищи являются углеводы, жиры и белки. Калорийность, то есть энергия, выделяемая в процессе диссимиляции
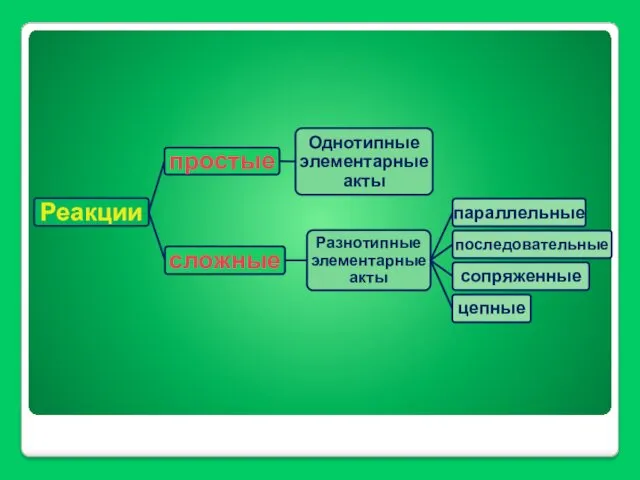
- 24. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
- 25. Химическая кинетика занимается исследованием механизмов реакций и течения их во времени. Механизм реакции – последовательность и
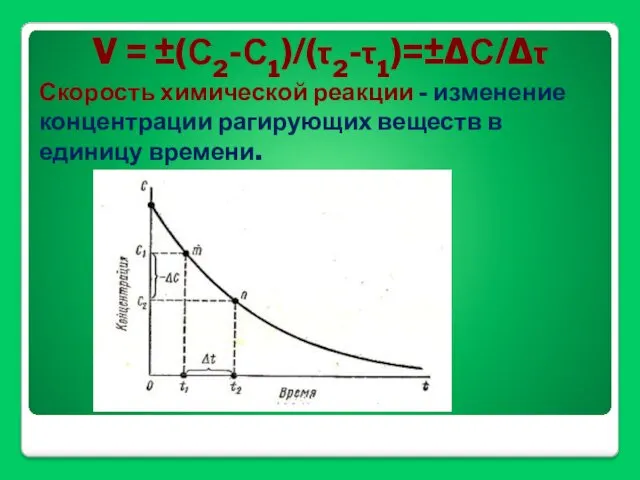
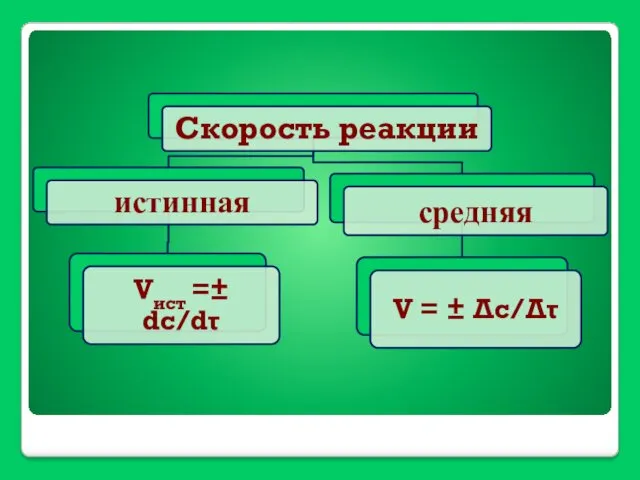
- 27. V = ±(С2-С1)/(τ2-τ1)=±ΔС/Δτ Скорость химической реакции - изменение концентрации рагирующих веществ в единицу времени.
- 29. Факторы, влияющие на скорость химических реакций Концентрация (давление) природа и дисперсность реагентов температура присутствие катализатора рН
- 30. Закон действующих масс (К. Гульдберг и П. Вааге) При постоянной температуре скорость химической реакции прямо пропорциональна
- 31. Реакции I порядка СuО(к) + Н2(г) = Сu(к) + Н2О (г) v=kC(H2) Реакции II порядка H2+
- 32. 2N2O5=4NO2+O2 N2O5=N2O3+O2 N2O3 + N2O5=4NO2
- 33. τ1/2 = Время, в течение которого прореагировала половина начального количества вещества, называется временем полураспада и обозначается
- 34. правило Вант - Гоффа γ (Δt/10)=kt+10/ kt γ - температурный коэффициент реакции, показывающий, во сколько раз
- 35. Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести
- 36. Уравнение Аррениуса k = Aexp(-Ea/RT) ln k = - (Ea/RT) + C еxp (е) – основание
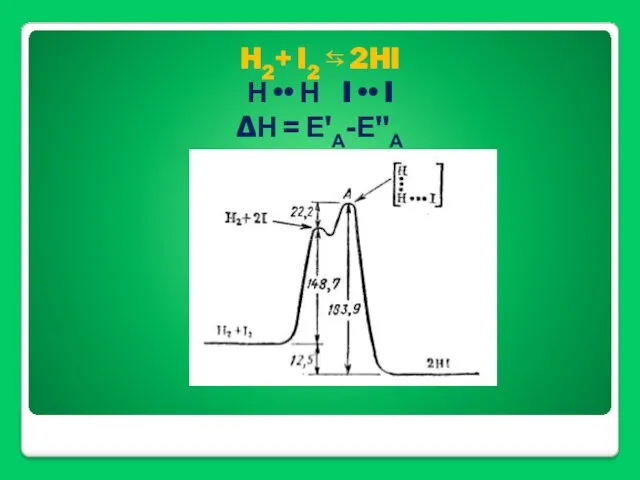
- 37. H2+ I2 ⇆ 2HI Н •• Н I •• I ΔН = Е'А-Е"А
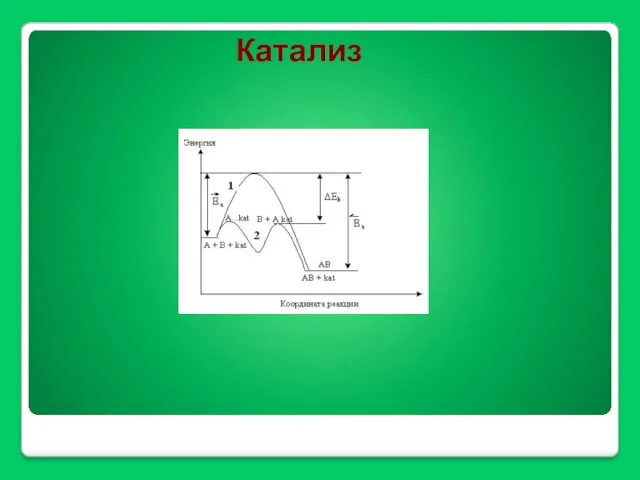
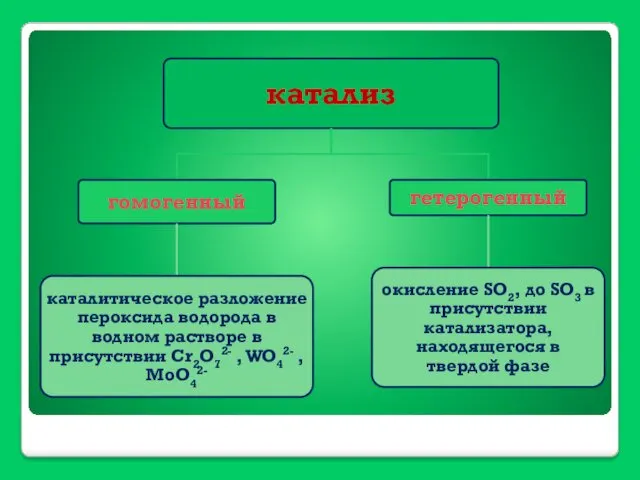
- 38. Катализ
- 40. Механизм гомогенной каталитической реакции А+В К АВ A + K = AK AK + B =
- 41. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 42. Mg+2HCl=MgCl2 + H2↑ Данная реакция протекает только в одном направлении и поэтому называется необратимой. H2+ I2⇆
- 43. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём
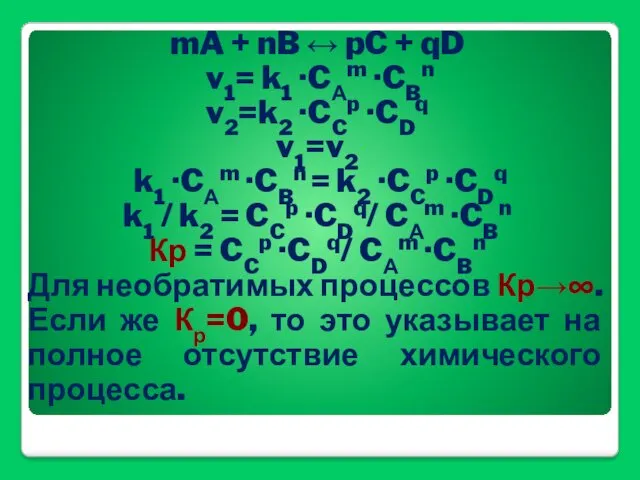
- 44. mA + nB ↔ pC + qD v1= k1 ·CАm ·CBn v2=k2 ·CCp ·CDq v1=v2 k1
- 45. ΔG°= -RT lnKр Если ΔG° Если же ΔG° > 0, то в равновесной смеси преобладают исходные
- 46. Принцип Ле-Шателье 2SO2 (г)+О2 (г) ⇆ 2SO3 (г), ΔH = -396,1 кДж/моль Т↑ ← С(SO2 )
- 48. Скачать презентацию


































 итоги первого года обучения ОРКСЭ
итоги первого года обучения ОРКСЭ Правила дорожного движения
Правила дорожного движения Тест по правилам дорожного движения
Тест по правилам дорожного движения Буллинг в школе
Буллинг в школе Step by step немесе Тәй-Тәй технологиясы
Step by step немесе Тәй-Тәй технологиясы Электромеханический преобразователь. Блок управления приводом. Электромеханический привод
Электромеханический преобразователь. Блок управления приводом. Электромеханический привод Computer’s hardware
Computer’s hardware Несущая система
Несущая система Shinto
Shinto Инструкция для граждан по дистанционному взаимодействию (на признание безработными)
Инструкция для граждан по дистанционному взаимодействию (на признание безработными) Эпизоотии и эпифитотии
Эпизоотии и эпифитотии Игра Мойгород. Пешком по любимой улице Свободы. Г. Ялуторовск
Игра Мойгород. Пешком по любимой улице Свободы. Г. Ялуторовск Математический КВН между 7 классами
Математический КВН между 7 классами Исход евреев из Египта
Исход евреев из Египта Презентация музыкального руководителя специальной (коррекционной) школы-интерната для детей-сирот и детей, оставшихся без попечения родителей, с ограниченными возможностями здоровья г.Саянска Белянкиной Любови Петровны
Презентация музыкального руководителя специальной (коррекционной) школы-интерната для детей-сирот и детей, оставшихся без попечения родителей, с ограниченными возможностями здоровья г.Саянска Белянкиной Любови Петровны Международные компании по предотвращению и расследованию киберпреступлений
Международные компании по предотвращению и расследованию киберпреступлений Предметно-развивающая среда во второй младшей группе
Предметно-развивающая среда во второй младшей группе Система работы по гражданскому и военно-патриотическому воспитанию в МОУ Лицей № 7. Военно-патриотический клуб Граница
Система работы по гражданскому и военно-патриотическому воспитанию в МОУ Лицей № 7. Военно-патриотический клуб Граница Электронная трудовая книжка. Федеральный закон № 439-ФЗ от 16.12.2019 О внесении изменений в Трудовой кодекс
Электронная трудовая книжка. Федеральный закон № 439-ФЗ от 16.12.2019 О внесении изменений в Трудовой кодекс Қант диабеті ауруының алдын алу шаралары тақырыбындағы диплом жұмысы
Қант диабеті ауруының алдын алу шаралары тақырыбындағы диплом жұмысы Спутники и кольца планет-гигантов Солнечной системы
Спутники и кольца планет-гигантов Солнечной системы Интерактивная игра Пешеходы и водители
Интерактивная игра Пешеходы и водители Фразеология русского языка
Фразеология русского языка Презентация Программы Кройка и шитьё
Презентация Программы Кройка и шитьё Отчетная конференция_2021
Отчетная конференция_2021 Спасибо тебе,солдат! - презентация
Спасибо тебе,солдат! - презентация Средства языка программирования VB.NET
Средства языка программирования VB.NET Процессы и потоки
Процессы и потоки