Содержание
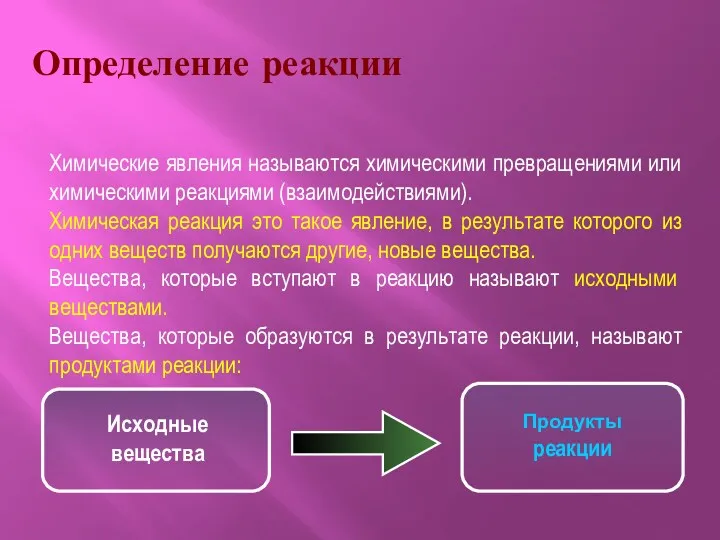
- 2. Определение реакции Химические явления называются химическими превращениями или химическими реакциями (взаимодействиями). Химическая реакция это такое явление,
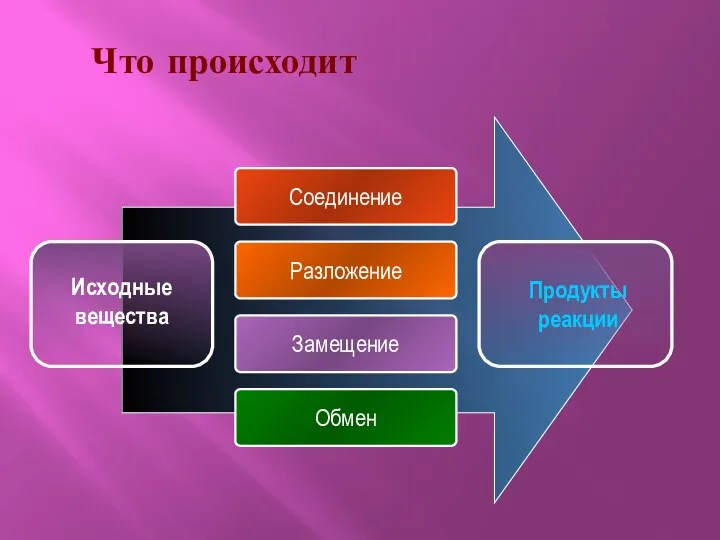
- 3. Что происходит Соединение Разложение Замещение Обмен Продукты реакции Исходные вещества
- 4. Типы реакций Реакция соединения Реакция разложения Реакция замещения Реакция обмена
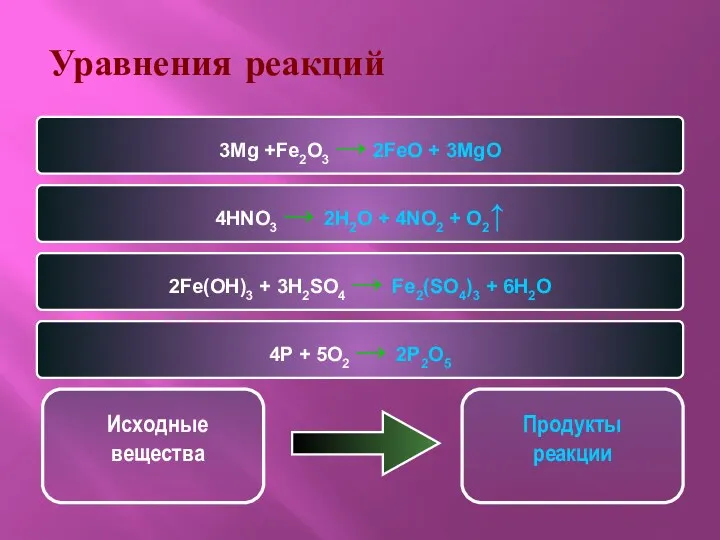
- 5. Уравнения реакций 3Mg +Fe2O3 → 2FeO + 3MgO 4HNO3 → 2H2O + 4NO2 + O2↑ 2Fe(OH)3
- 6. Признаки реакции 1.Выпадение или растворение осадка 2.Выделение или поглощение газа (запаха) 3.Изменение цвета (окраски) вещества 4.Повышение
- 7. Условия протекания Измельчение веществ Смешивание веществ Нагревание смеси
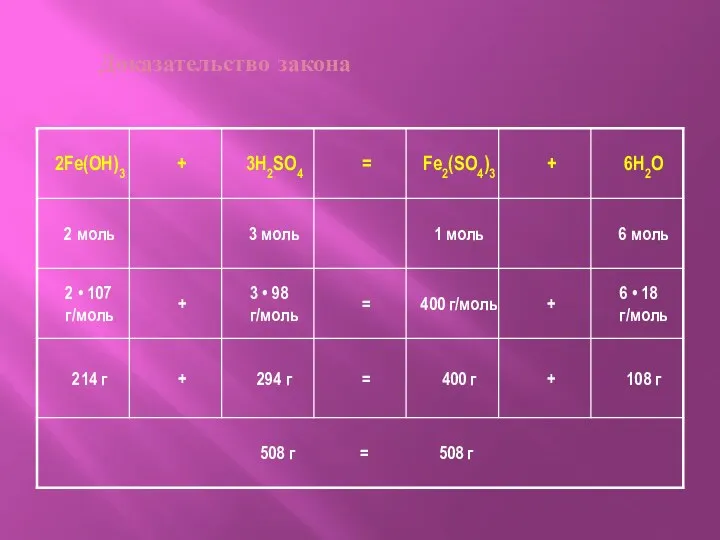
- 8. Закон сохранения массы
- 9. Доказательство закона
- 10. Реакция соединения A + B = AB A +B + C = ABC AB + C
- 11. Пример реакции соединения Горение стальной проволоки в колбе с кислородом: 3Fe + 2O2 = Fe3O4 +
- 12. Укажите правильное уравнение 2Na + O2 = 2Na2O 4NO2 + 2H2O + O2 = 4HNO3 2SO2
- 13. Реакция разложения AB = A +B ABC = A + B + C ABC = AB
- 14. Пример реакции разложения Разложение кислородсодержащего отбеливателя «Персоль» при нагревании: 2H2O2 + Q кДж → 2H2O +
- 15. Укажите правильное уравнение 2KClO3 → 2KCl + 3O2 ↑ 2CuCO3 → CuO + CO2 ↑ Fe(OH)3
- 16. Реакция замещения AB + C= CB +A ABC + D = DBC + A Математический алгоритм
- 17. Пример реакций замещения Взаимодействие цинка с соляной кислотой выражается уравнением: Zn + 2HCl = H2↑ +
- 18. Укажите правильное уравнение Mg + MnO2 = Mn + MgO + Q кДж 3Mg + H3PO4
- 19. Реакция обмена AB + CD = CB + AD Математический алгоритм Реакция обмена это такая реакция,
- 20. Пример реакции обмена Взаимодействие двух веществ, находящихся в растворённом виде – гидроксида калия и сульфата железа
- 21. Укажите правильные уравнения CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 H3PO4 + KOH = K3PO4 +
- 22. Повторим ещё раз: Химическая реакция – … Химическое уравнение – … Типы химических реакций … Признаки
- 23. Задания для успешных Тест №1: химическая реакция Тест №2: химическое уравнение Тест №3: типы химических реакций
- 24. Урок окончен, спасибо!
- 25. Это правильный ответ! Отлично! Так держать! обратно
- 26. Это правильный ответ! Отлично! Так держать! обратно
- 27. Это правильный ответ! Отлично! Так держать! обратно
- 28. Это правильный ответ! Отлично! Так держать! обратно
- 29. Это неверный ответ! Подумай ещё! обратно
- 30. Это неверный ответ! Подумай ещё! обратно
- 31. Это неверный ответ! Подумай ещё! обратно
- 33. Скачать презентацию


























 Предмет, метод и место истории государства и права России в системе юридических наук. (Тема 1)
Предмет, метод и место истории государства и права России в системе юридических наук. (Тема 1) Население Африки
Население Африки Сексуалды мәдениет. Денсаулығында ақауы бар индивидтерді тұлға түрінде гигеналық және жыныстық тәрбиелеу әлеуметтік үрдіс
Сексуалды мәдениет. Денсаулығында ақауы бар индивидтерді тұлға түрінде гигеналық және жыныстық тәрбиелеу әлеуметтік үрдіс Методика обучения пространственно-объемным видам искусства
Методика обучения пространственно-объемным видам искусства Швейцарский лингвист Фердинанд де Соссюр ( 26 ноября 1857, Женева — 22 февраля 1913)
Швейцарский лингвист Фердинанд де Соссюр ( 26 ноября 1857, Женева — 22 февраля 1913) Показательные неравенства
Показательные неравенства Продукты, насыщенные жирами.
Продукты, насыщенные жирами. Презентация Грибы. Споровые растения
Презентация Грибы. Споровые растения Надзор за деятельностью саморегулируемых организаций оценщиков
Надзор за деятельностью саморегулируемых организаций оценщиков Перевод учета со стороны 6кВ на 150 кВ Подстанция М-14 на ПАО Запорожсталь в 2018 году
Перевод учета со стороны 6кВ на 150 кВ Подстанция М-14 на ПАО Запорожсталь в 2018 году Вектор. Понятие вектора, длина вектора, коллинеарные векторы, равные векторы, откладывание вектора
Вектор. Понятие вектора, длина вектора, коллинеарные векторы, равные векторы, откладывание вектора Утраченные храмы и монастыри Твери
Утраченные храмы и монастыри Твери Достопримечательности Санкт-Петербурга
Достопримечательности Санкт-Петербурга Мюзикл и его особенности
Мюзикл и его особенности Технологическая прочность сварных соединений и методы ее повышения
Технологическая прочность сварных соединений и методы ее повышения Доказательства и доказывание в уголовном процессе. (Тема 3)
Доказательства и доказывание в уголовном процессе. (Тема 3) Процессы адаптации. Регенерация. Заживление ран
Процессы адаптации. Регенерация. Заживление ран Культура России во второй половине 19 века
Культура России во второй половине 19 века тренажер по математике Порядок действий
тренажер по математике Порядок действий Ways of traveling to London
Ways of traveling to London презентация Нагайцева Петра к докладу
презентация Нагайцева Петра к докладу Подземные воды. 6 класс
Подземные воды. 6 класс Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период
Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период Формирование УУД на уроках химии
Формирование УУД на уроках химии Город Челябинск
Город Челябинск Я - избиратель, я - патриот
Я - избиратель, я - патриот родительское собрание совместно с детьми в 1 классе
родительское собрание совместно с детьми в 1 классе Жедел бүйрек жетіспеушілігі
Жедел бүйрек жетіспеушілігі