Содержание
- 2. Перед началом эксперимента внимательно ознакомьтесь с инструкциями
- 3. Цель работы: Объяснить химические свойства карбоновых кислот. Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная
- 4. Таблица Сделайте общий вывод о проделанной работе.
- 5. Опыт 1. Получение уксусной кислоты. В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной
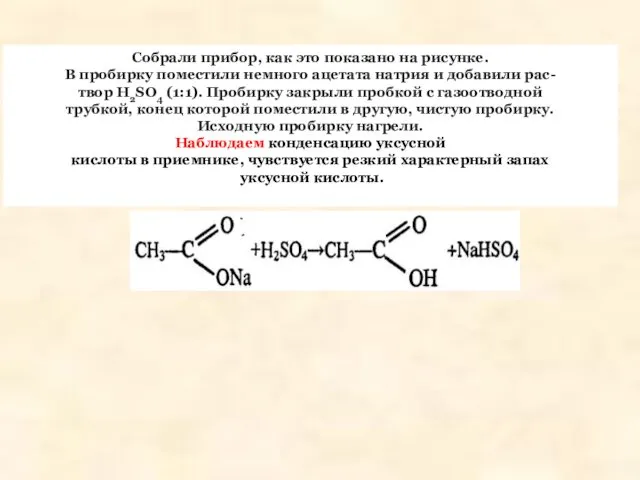
- 6. Собрали прибор, как это показано на рисунке. В пробирку поместили немного ацетата натрия и добавили рас-
- 7. Опыт 2б. Взаимодействие уксусной кислоты с металлами. Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами» В одну
- 8. Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа. Составьте уравнение в молекулярном и ионном
- 9. Опыт 2а. Свойства карбоновых кислот. Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями» В пробирку налейте 1
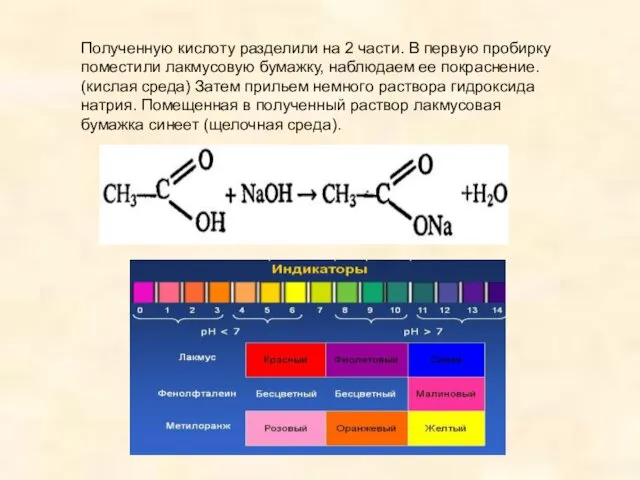
- 10. Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку, наблюдаем ее покраснение. (кислая
- 11. Опыт 2в. Взаимодействие уксусной кислоты с солями слабых неорганических кислот. Посмотрите видео-опыт «Взаимодействие уксусной кислоты с
- 12. 1).Na2CO3 + 2 CH3COOH ---> 2CH3COONa + H2O + CO2 2Na(+) + CO3(-2) + 2 CH3COO(-)
- 13. Опыт 3. Получение уксусно- этилового эфира Посмотрите видео-опыт «Получение уксусно- этилового эфира» В пробирку налейте 1
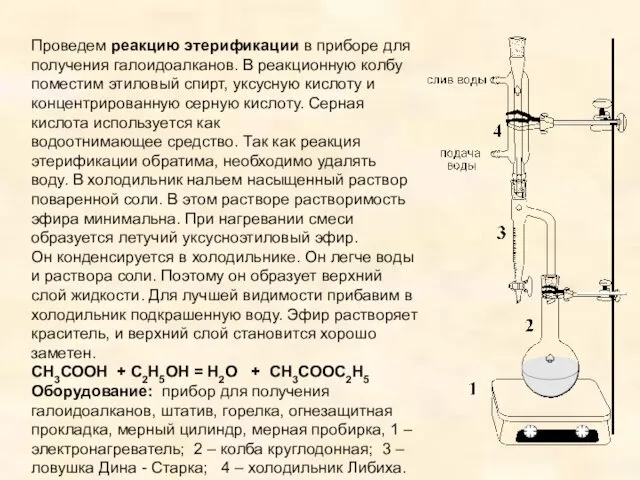
- 14. Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу поместим этиловый спирт, уксусную кислоту
- 16. Скачать презентацию










 Викторина ПДД
Викторина ПДД УПЗ как средство развития логических УУД на уроках геометрии в 5-7 классах
УПЗ как средство развития логических УУД на уроках геометрии в 5-7 классах Иван Петрович Кулибин (1735-1818)
Иван Петрович Кулибин (1735-1818) Здоровье - основная ценность человека
Здоровье - основная ценность человека Технологія збирання ПК на основі процесора Intel Core I9 з відеокартою Nvidia Geforce RTX 2080 Ti
Технологія збирання ПК на основі процесора Intel Core I9 з відеокартою Nvidia Geforce RTX 2080 Ti Экология строительных материалов и объектов
Экология строительных материалов и объектов Концепция благоустройства села Луговское
Концепция благоустройства села Луговское Физика и медицина
Физика и медицина Цифровые устройства. Виды устройств
Цифровые устройства. Виды устройств Основы двигательной активности детей раннего и дошкольного возраста
Основы двигательной активности детей раннего и дошкольного возраста Презентация по биографии А.Милна
Презентация по биографии А.Милна Фонтанный способ эксплуатации скважин
Фонтанный способ эксплуатации скважин Философские проблемы современного образования.
Философские проблемы современного образования. Борьба России со Швецией
Борьба России со Швецией ПроектСказки дедушки Корнея часть2
ПроектСказки дедушки Корнея часть2 Методы синтеза и анализа цифровых фильтров. БИХ-фильтры. Метод билинейного z-преобразования
Методы синтеза и анализа цифровых фильтров. БИХ-фильтры. Метод билинейного z-преобразования Количественные методы анализа информации. Кластерный анализ. Основы анализа данных
Количественные методы анализа информации. Кластерный анализ. Основы анализа данных Древние образы в народном искусстве. 5 класс
Древние образы в народном искусстве. 5 класс Правила продажи обувных товаров
Правила продажи обувных товаров Молярный объем газов.
Молярный объем газов. Хирургические насадки
Хирургические насадки Родительское собрание на тему Поощрение и наказание
Родительское собрание на тему Поощрение и наказание Факторы риска, эпидемиология и профилактика важнейших неинфекционных болезней и их медико-социальные аспекты (БСК, ЗНО, БОД)
Факторы риска, эпидемиология и профилактика важнейших неинфекционных болезней и их медико-социальные аспекты (БСК, ЗНО, БОД) Работа с соцсетями. Ювелирочка и ОТ и ДО
Работа с соцсетями. Ювелирочка и ОТ и ДО Схемы холодильных установок
Схемы холодильных установок План для свай
План для свай Тепловые схемы теплогенерирующих установок
Тепловые схемы теплогенерирующих установок Қоғамдық денсаулық сақтаудағы ғылыми зерттеуді жоспарлаудың ерекшелігі
Қоғамдық денсаулық сақтаудағы ғылыми зерттеуді жоспарлаудың ерекшелігі