Содержание
- 2. физические свойства щелочных металлов Щелочные металлы - металлы серебристо–белого цвета, за исключением цезия - золотисто-белого цвета,
- 3. 1. Предложил назвать калий от арабского «алкали» - щелочь И. Арфведсон Г.Деви Й. Берцеллиус 2. В
- 4. О каких свойствах ЩМ идет речь? Электрон на внешнем слое Еле держится у нас, Отдаём его
- 5. Химические свойства щелочных металлов. Биологическая роль металлов в организме человека.
- 6. цели урока 1. Изучить химические свойства щелочных металлов. 2. Рассмотреть метод качественного определения соединений щелочных металлов
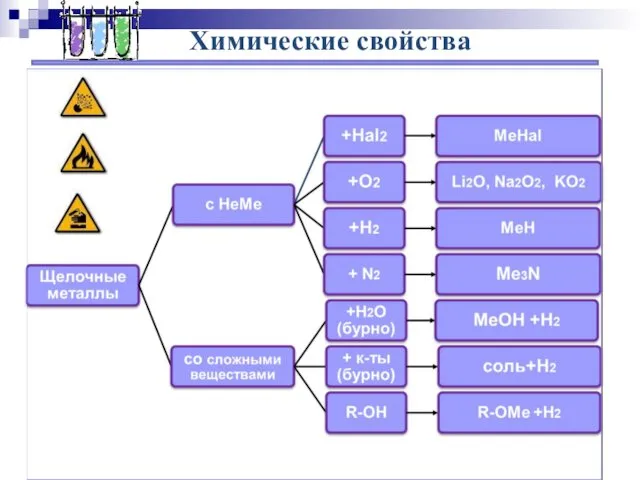
- 7. Химические свойства
- 8. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 9. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
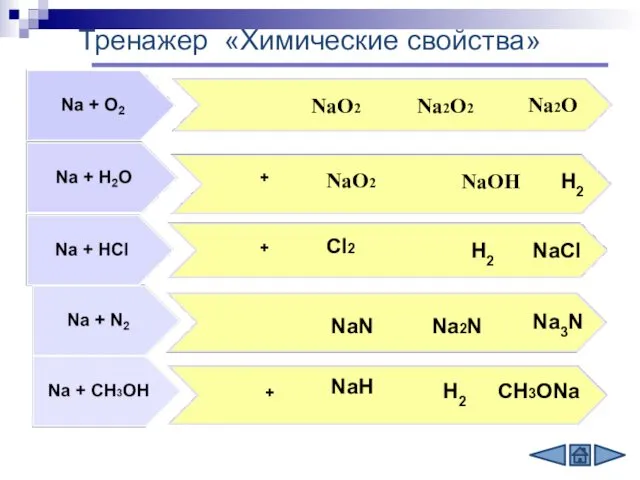
- 10. + + + NаО2 Nа2O NаОН NaCl Na2N Na3N NаО2 Cl2 NaN NaH Na2O2 H2 H2
- 11. ЛИТИЙ Li +
- 12. Na +
- 13. КАЛИЙ K +
- 14. Решите вкусную задачу В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть,
- 16. Скачать презентацию











 Битва за Ленинград 8 сентября 1941 - 27 января 1944
Битва за Ленинград 8 сентября 1941 - 27 января 1944 Философия любви
Философия любви Меры поддержки фонда развития Югры
Меры поддержки фонда развития Югры Классный час Ежели Вы вежливы
Классный час Ежели Вы вежливы Связь музыкального образа с исходными интонациями. исходными интонациями. Слушание музыки 2 класс
Связь музыкального образа с исходными интонациями. исходными интонациями. Слушание музыки 2 класс 20230816_soli
20230816_soli Никто не забыт, ничто не забыто. Великая Отечественная война
Никто не забыт, ничто не забыто. Великая Отечественная война Презентация по алгебре Предел функции в точке
Презентация по алгебре Предел функции в точке Щелочно-земельные металлы
Щелочно-земельные металлы Приобщение родителей и детей к здоровому образу жизни в совместной деятельности
Приобщение родителей и детей к здоровому образу жизни в совместной деятельности Викторина Своя игра
Викторина Своя игра Новые возможности для Серебряных волонтёров
Новые возможности для Серебряных волонтёров Романовы. Правление Петра III
Романовы. Правление Петра III Вода в атмосфере
Вода в атмосфере Презентация творческого проекта Школа моей мечты (4 класс)
Презентация творческого проекта Школа моей мечты (4 класс) Пародонт. Обследование
Пародонт. Обследование Rally Robin
Rally Robin Сварка. Виды сварки
Сварка. Виды сварки Eyelab. Help maintain eye health
Eyelab. Help maintain eye health deteyling_prez
deteyling_prez Теремкәй әкияте.
Теремкәй әкияте. Установка дистанционного управления для винта с регулируемым шагом
Установка дистанционного управления для винта с регулируемым шагом Лакокрасочные материалы. Виды, состав
Лакокрасочные материалы. Виды, состав Презентация Развитие приемов и навыков исследовательской деятельности на уроках географии
Презентация Развитие приемов и навыков исследовательской деятельности на уроках географии Угадай героев сказок
Угадай героев сказок Multivariable process control system
Multivariable process control system Презентация диплом НАК лемачко версия2
Презентация диплом НАК лемачко версия2 Проект Чистый город
Проект Чистый город