Содержание
- 2. Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию,
- 3. Следовательно, все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие
- 4. В конце 19 в. немецкий физхимик Макс Боденштейн (1871–1942) детально изучил процессы образования и термической диссоциации
- 5. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 6. Количественно состояние химического равновесия описывается законом действующих масс. При равновесии отношение произведения концентраций продуктов реакции (в
- 7. Если происходит обратимая гомогенная реакция: Здесь а, b, c, d – стехиометрические коэффициенты перед веществами в
- 8. При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
- 9. а из полученного уравнения уже легко получается выражение для константы равновесия Кр: Это не что иное,
- 10. Например, для реакции: N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж константа равновесия
- 11. Для гетерогенной реакции вида: А(г) + 2В(тв)↔АВ2(ж) К=[AB2]/ [A] А(г) + 2В(ж)↔АВ2(ж) К=[AB2]/ [A] А(ж) +
- 12. Знание константы равновесия позволяет судить о практической возможности протекания реакции, а также о глубине её протекания,
- 13. Для синтеза аммиака при комнатной температуре К=3,5·108. Это довольно большое число, свидетельствующее о том, что химическое
- 14. Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое
- 15. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ. Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и
- 16. Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая): N2 (г)
- 17. Меняем концентрацию Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:
- 18. Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем
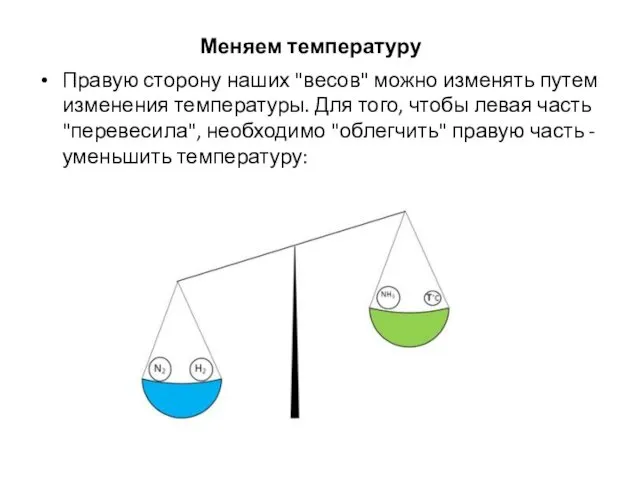
- 19. Меняем температуру Правую сторону наших "весов" можно изменять путем изменения температуры. Для того, чтобы левая часть
- 20. Меняем давление Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить
- 21. Подведем итог. Согласно принципу Ле Шателье увеличить производство аммиака можно: увеличивая концентрацию реагентов; уменьшая концентрацию продуктов
- 22. Примеры решения задач Укажите, как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода
- 24. Скачать презентацию









![Для гетерогенной реакции вида: А(г) + 2В(тв)↔АВ2(ж) К=[AB2]/ [A] А(г)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52339/slide-10.jpg)










 Презентация Времена года.Зима к НОД по лексической теме Зима.
Презентация Времена года.Зима к НОД по лексической теме Зима. Характеристические уравнения реакторов
Характеристические уравнения реакторов Профессиональная пригодность
Профессиональная пригодность Презентация Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов 9 класс
Презентация Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов 9 класс Нанотехнології наноматеріалу
Нанотехнології наноматеріалу Химическая промышленность
Химическая промышленность Францішак Багушэвіч (9-11 класы)
Францішак Багушэвіч (9-11 класы) С праздником весны!
С праздником весны! Пам'ять. Мислення
Пам'ять. Мислення Любовная лирика А.С. Пушкина. Вдохновенные строки
Любовная лирика А.С. Пушкина. Вдохновенные строки Из опыта работы воспитателя МДОУ детского сада комбинированного вида №100 Дюймовочка
Из опыта работы воспитателя МДОУ детского сада комбинированного вида №100 Дюймовочка Страны Востока в XVI – XVIII веках
Страны Востока в XVI – XVIII веках Перемещение тела при равноускоренном движении
Перемещение тела при равноускоренном движении Творческо - познавательный проект Времена года. Осень.
Творческо - познавательный проект Времена года. Осень. Презентация
Презентация Федеральный закон Об информации, информационных технологиях и о защите информации
Федеральный закон Об информации, информационных технологиях и о защите информации Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология
Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология Ты сам мастер декоративно-прикладного искусства
Ты сам мастер декоративно-прикладного искусства Классный час О вреде курения
Классный час О вреде курения Мезенская роспись
Мезенская роспись Налог на прибыль организаций
Налог на прибыль организаций Инвестиционный проект как объект финансирования
Инвестиционный проект как объект финансирования Царство животные. Трехслойные животные. Черви
Царство животные. Трехслойные животные. Черви Проблемы строительства и реконструкции в геотехнических условиях города Тюмени
Проблемы строительства и реконструкции в геотехнических условиях города Тюмени Шаблон для защиты дипломного проекта. Рязанский колледж электроники
Шаблон для защиты дипломного проекта. Рязанский колледж электроники Развитие туризма в Чукотском автономном округе
Развитие туризма в Чукотском автономном округе Урок 20 Заполнение основной надписи и печать в КОМПАС
Урок 20 Заполнение основной надписи и печать в КОМПАС Презентация..Роль комнатных растений в жизни человека
Презентация..Роль комнатных растений в жизни человека